探索替莫唑胺联合amlexanox对胶质瘤细胞的作用效果及机制
熊金彪,郭高超,曹艺耀,陈旨娟,黄强,杨卫东
(天津医科大学总医院神经外科,天津300052)
多形性胶质母细胞瘤(GBM)占所有胶质瘤的60%~70%,是成人恶性程度和死亡率最高的原发性脑肿瘤[1]。过去几十年,胶质瘤治疗技术飞速发展,主要以脑肿瘤近全切,辅以放疗和(或)化疗为主,尽管如此,胶质瘤患者平均生存中位数仅约14.6个月,5年生存率仅为9.8%[2-3]。因此临床上迫切需要一种针对GBM更有效的治疗方案。
替莫唑胺(TMZ)是一种新型口服甲基化药物,具有多种抗肿瘤效果,被广泛用于治疗GBM[4]。尽管TMZ被视为治疗GBM最具前景的化疗药物,但由于耐药性,大部分患者接受TMZ治疗7个月后会出现GBM复发[5]。越来越多证据表明,蛋白激酶B(Akt)异常激活涉及多种类型肿瘤耐药性[6]。并且TMZ能诱导Akt激活,进而降低TMZ对肿瘤细胞的毒性作用[7]。此外,最近有研究表明,核因子κ-B激酶抑制剂(IKBKE、IKKε 或 IKKi)也能诱导激活 Akt[8]。
Amlexanox是一种选择性IKBKE抑制剂,被批准用于口疮溃疡和哮喘治疗[9-10],对肥胖和2型糖尿病也有明确治疗效果[11-12]。而且,有研究证明amlexanox能有效抑制GBM细胞生长[13]。因此,笔者假设amlexanox能通过抑制IKBKE而逆转TMZ诱导的Akt激活,进而降低胶质瘤细胞耐药性,增强TMZ细胞毒作用,并通过一系列体内外实验对该假设进行验证。
1 材料与方法
1.1化学试剂抗IKBKE(#2690)、抗p-Akt(phospho-Ser473,#9271) 抗体购于美国 Cell Signaling Technology公司。抗 m-TOR(#36991)、抗 p-mTOR(phospho-Ser2448、#21214)抗体购于美国Signalway Antibody公司。抗Akt(#A18675)抗体购于美国AB-clonal公司。辣根过氧化物酶标记的山羊抗鼠、抗兔IgG(#ZB-2307、#ZB-2301)和 GAPDH(#TA505454)抗体购于北京中杉金桥生物技术有限公司。Amlexanox(#S364805)购于Selleck.cn中国分公司,TMZ(#IT1330)购于中国索莱宝科技公司。Amlexanox和TMZ分别溶于二甲基亚砜试剂(DMSO、#D2650,Sigma,美国),储存于-20℃,储存浓度分别为500mmol/L(Amlexanox)和 100 mmol/L(TMZ)。
1.2 细胞培养
1.2.1 U87 MG细胞系 该细胞系购于美国ATCC中心,于含有10%胎牛血清(FBS)的DMEM培养基中,孵育在37℃、5%CO2细胞培养箱。为防止细胞污染,培养基中混有100 U/mL青霉素/链霉素双抗。
1.2.2 原代GBM细胞 术后病理证实为星形胶质细胞瘤Ⅳ的新鲜肿瘤组织来源于天津医科大学总医院手术患者。被分离新鲜组织在离体1 h内经磷酸盐缓冲液(PBS)清洗,去除血迹及正常脑组织,然后经胰酶于37℃环境中消化1 h。消化后的组织经离心后去掉上清液,剩余沉淀培养于含有10%FBS的F12培养基(Gibco,美国)中,并加入100 U/mL青霉素/链霉素预防污染,孵育于37℃、5%CO2恒温细胞培养箱。
1.3 细胞增殖能力测定 细胞增殖能力由CCK-8实验测定。实验分为4组:对照组、amlexanox组、TMZ组、TMZ+amlexanox组,每组3个复孔。U87 MG和原代GBM细胞经离心、重悬、计数后接种至96孔板,每孔约 4×103细胞,于 37℃、5%CO2过夜贴壁。次日,更换含有设定浓度的单药(TMZ或amlexanox)或联合药物(TMZ和amlexanox)的培养基。继续于恒温细胞培养箱中孵育24、48、72 h后,分别于每孔中加入10 μL CCK-8试剂,轻柔晃动后,置于恒温细胞箱中培养2 h。培养结束后,用酶标仪检测每孔于450 nm处吸光度值,利用统计方法测定每组吸光度值的平均值以反映细胞增殖能力。实验重复3次。
1.4 迁移能力测定 利用划痕和Transwell迁移实验检测U87 MG和原代GBM细胞迁移能力。实验分组同CCK-8实验。细胞划痕实验过程如下:U87MG和原代GBM细胞经设定浓度单药或联合药物处理72 h后,离心、重悬,以每孔2×105细胞数接种至6孔板,于37℃、5%CO2恒温细胞培养箱中过夜贴壁。至每孔单层细胞铺满底壁80%~90%时,用200 μL移液枪头于每孔底壁做出十字划痕,更换培养基以清除游离细胞。再于37℃、5%CO2恒温箱中培养0、12、24 h后,用相差倒置显微镜观察细胞迁移情况,每组取5个独立划痕视野拍照,计算划痕愈合面积进行统计学分析。Transwell迁移实验参照Liu等[13]研究。该实验独立重复3次。
1.5 侵袭能力测定 利用Transwell侵袭实验检测U87 MG和原代GBM细胞侵袭能力。实验分组同CCK-8实验。Transwell侵袭实验过程如下:处理后的 U87 MG 和原代 GBM 细胞(4×103)重悬于 200 μL无血清培养基,接种至被聚碳酸酯膜包被的Transwell小室的上室中,然后将上室置于含有700 μL 10%FBS培养基的下室(六孔板)中,于37℃恒温箱中培养24 h。培养结束后用棉棒擦除上室中未穿出细胞,经4%甲醛于室温下固定,再用0.1%结晶紫染色,流水清洗后室温干燥,最后在显微镜下观察,每个小室于10×显微镜下取3个独立视野拍照,计数穿出细胞进行统计学分析。该实验独立重复3次。
1.6 Western印迹实验 U87 MG和原代GBM细胞经设定浓度的单药和联合药物处理72 h,用胰酶消化收集细胞,离心去除上清液,将沉淀于混有蛋白酶抑制剂的RIPA裂解液中裂解1 h。总蛋白浓度依据BCA法测定。利用聚丙烯酰胺凝胶电泳检(SDS-PAGE)测IKBKE及Akt通路蛋白变化,具体过程如下:取等量蛋白样品,于6%、10%、12%的SDS-PAGE中电泳分离,然后将蛋白质转至PVDF膜(360 mA,60 min)。结束后,该膜经PBS洗涤5 min×3次,洗涤结束后将膜置于5%脱脂牛奶中,于37℃恒温箱中封闭1 h。封闭完成后,去除封闭液,用特定一抗于4℃环境中孵育过夜。次日于室温下复温1 h,回收一抗后,用PBS将PVDF膜洗涤5 min×3次,然后用辣根过氧化物酶标记的二抗于室温下再孵育1 h。最后丢弃二抗,用PBS再次洗涤PVDF膜后,利用ECL法测定蛋白表达水平。其中以GAPDH为内参。
1.7 免疫组织化学染色(IHC) 裸鼠经颈椎脱臼法处死后,取出鼠脑标本固定于4%福尔马林中,石蜡包埋后做成5 μm切片。将石蜡切片置于60℃环境中烤片1 h,然后经二甲苯和梯度乙醇水化脱蜡。结束后于92~99℃柠檬酸钠溶液中抗原修复15 min,室温中冷却,然后将切片用PBS洗涤5 min×3次,再经3%H2O2于室温下孵育30 min以清除内源性过氧化物酶活性。结束后经PBS洗涤5 min×3次,切片经1%牛血清白蛋白(BSA)于37℃恒温箱中封闭30 min,最后经特定一抗于4℃孵育过夜。次日室温下复温1 h后回收一抗,PBS洗涤5 min×3次,再经二抗孵育1 h,结束后经DAB染色、苏木素复染,然后分化、反蓝、水化、封片。显微镜下观察、拍照进行统计学分析。
1.8 动物实验 本实验利用裸鼠颅内模型进行药物体内实验。4周龄雌性裸鼠(约10 g/只)购买于中国医学科学院血液病研究所。颅内裸鼠模型构建及处理过程如下:将感染荧光病毒的原代GBM细胞用立体定向仪于裸鼠前后囟中点偏右2 mm处注射入裸鼠颅内。7 d后,利用小动物活体成像系统测定裸鼠颅内肿瘤大小,记录数据。将裸鼠随机分配至3组,每组15只,分别为对照组、TMZ组、TMZ+amlexanox组。TMZ组裸鼠接受5 mg/(kg·d)TMZ处理,联合药物组接受5 mg/(kg·d)TMZ+100 mg/(kg·d)amlexanox处理,对照组接受DMSO处理。3组裸鼠接受药物处理5 d后休息2 d,接着再处理5 d,以此循环至实验结束。以后每周对裸鼠成像1次。4周后,每组处死3只裸鼠,取出鼠脑后固定于福尔马林,用于苏木素伊红(HE)染色和IHC实验。每组剩余裸鼠饲养至实验结束,用于动物生存分析。
1.9 统计学处理 用x±s表示所有实验数据。用Graphpad Prism 6软件进行统计学分析。One-way ANOVA法用于分析多组数据是否具有统计学意义。采用Kaplan-Meier法检验各组生存率差异。P<0.05为差异具有统计学意义。
2 结果
2.1 TMZ联合amlexanox显著抑制肿瘤细胞增殖 U87 MG和原代GBM细胞经不同浓度的单药或联合药物处理24、48、72 h。CCK-8结果显示,TMZ或amlexanox对肿瘤细胞增殖能力的抑制作用随药物浓度增加而增强(图1)。与其他3组比较,TMZ+amlexanox组U87 MG和原代GBM细胞增殖能力明显抑制(图1)。而且,TMZ组和amlexanox组U87 MG 72 h药物半抑制浓度(IC50)分别为200 μmol/L 和 600 μmol/L,二者联合处理后 IC50分别降至 130 μmol/L(TMZ) 和 180 μmol/L。TMZ+amlexanox组原代GBM细胞72 h药物IC50值也显著降低。依据IC50值,本研究分别选择TMZ:100μmol/L和 amlexanox:50 μmol/L 进行后续实验。
2.2 TMZ联合amlexanox能有效抑制Akt激活 Western印迹实验结果显示,无论是U87 MG细胞还是原代GBM细胞,不同处理方式均不能改变细胞中Akt和mTOR蛋白质表达量,但TMZ组p-Akt表达量轻度升高,amlexanox组IKBKE表达量明显降低。TMZ+amlexanox组U87 MG和原代GBM细胞中p-Akt和p-mTOR表达水平显著降低(图2)。
2.3 TMZ联合amlexanox能显著抑制细胞侵袭和迁移能力 划痕实验结果表明,TMZ+amlexanox组U87 MG和原代GBM细胞划痕愈合面积显著低于TMZ 组和 amlexanox组(P<0.001,图 3A、2B),Transwell迁移实验结果也表明,TMZ+amlexanox组U87MG和原代GBM细胞24 h后穿出小室细胞数量显著低于 TMZ 组和 amlexanox组(P<0.05,图 3C、D)。Transwell侵袭实验结果表明,TMZ+amlexanox组U87 MG和原代GBM细胞穿出数量显著降低(P<0.01,图 3C、3D)。
2.4 TMZ联合amlexanox抑制裸鼠颅内肿瘤生长 动物实验结果如图4A、4B、4C所示,TMZ组裸鼠颅内肿瘤体积略小于对照组,而TMZ+amlexanox组裸鼠颅内肿瘤体积显著小于TMZ组和对照组,且TMZ+amlexanox组裸鼠生存中位数也显著高于TMZ组和对照组(31 d比25.5 d和21 d)。HE结果也提示,TMZ+amlexanox组裸鼠颅内肿瘤体积显著小于另外两组(图4D)。另外,与体外细胞实验结果一致,IHC结果表明,TMZ+amelexanx组p-Akt和p-mTOR在颅内肿瘤中表达水平明显降低(图4D)。

图1 TMZ联合amlexanox对U87 MG和原代GBM细胞增殖能力的影响Fig 1 Effect of TMZ combined with amlexanox on proliferation of U87 MG and primary GBM cells
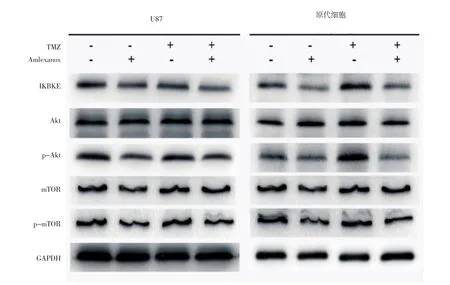
图2 TMZ联合amlexanox对U87 MG和原代细胞中IKBKE、Akt、mTOR等蛋白表达的影响Fig 2 Effect of TMZ combinedwith amlexanox on the expression of IKBKE,Akt,mTOR and other proteins for U87 MG and primary GBM cells
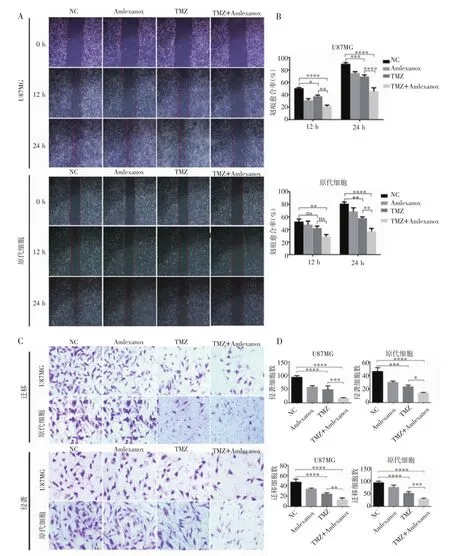
图3 TMZ联合amlexanox对U87 MG细胞和原代细胞迁移和侵袭能力的影响Fig 3 Effect of TMZ combined with amlexanox on the migration and invasion of U87 MG and primary GBM cells
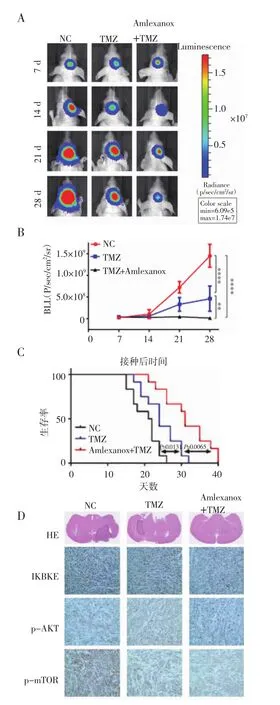
图4 TMZ联合amlexanox对裸鼠颅内肿瘤的影响Fig 4 Effect of TMZ combined with amlexanox on orthotopic intracranial tumors of nude mice
3 讨论
TMZ普遍用于胶质瘤治疗,诱导DNA加合物形成是TMZ产生细胞毒性最主要机制[14]。尽管TMZ能改善GBM患者预后,但易产生耐药性[15]。临床上迫切需要一种针对胶质瘤患者更有效的治疗措施。本研究利用一系列实验证明TMZ联合小分子抑制剂amlexanox,能有效抑制U87 MG细胞和原代GBM细胞增殖、侵袭和迁移能力,并能显著抑制裸鼠颅内肿瘤生长和延长裸鼠生存期。
耐药性的产生是治疗胶质瘤患者失败的最主要原因。Akt作为重要的细胞蛋白质,其异常激活参与多种细胞活动,如细胞增殖、生存、糖代谢等。日益增多的研究证实,Akt激活与TMZ耐药性相关,而且TMZ能诱导Akt异常激活更增加肿瘤细胞对TMZ耐药性[16-17]。大量研究已经证实,抑制Akt通路能降低肿瘤细胞对TMZ耐药性,增强其细胞毒性作用[18-22]。其中Bi等[19]证实Cordycepin能通过激活AMP活化蛋白激酶(AMPK)和抑制Akt通路,抑制胶质瘤细胞增殖、促进凋亡。Wu等[20]证实FK228能通过抑制磷脂酰肌醇-3激酶(PI3K)/Akt/mTOR通路促进胶质瘤细胞凋亡,并抑制裸鼠颅内肿瘤生长。本研究也表明,TMZ联合amlexanox能显著抑制p-Akt和p-mTOR表达水平,进而抑制细胞增殖能力。Amlexanox作为IKBKE的选择性抑制剂,不仅能调节糖代谢[23],还能通过抑制Hippo通路而发挥抗肿瘤作用[13]。另外,IKBKE在乳腺癌和小细胞肺癌中参与Akt的异常激活[16,24]。因此,本研究发现,amlexanox能增强TMZ对胶质瘤细胞毒性作用,可能与amlexanox抑制IKBKE活性而抑制p-Akt表达并逆转TMZ诱导Akt激活有关。
综上所述,本研究证实TMZ联合amlexanox能显著抑制胶质瘤细胞增殖、迁移和侵袭能力,并能显著抑制原代GBM细胞在裸鼠颅内成瘤。Amlexanox能降低肿瘤细胞对TMZ耐药性,增强TMZ细胞毒性作用,可能与amlexanox抑制IKBKE活性而部分逆转TMZ诱导Akt激活有关。这为TMZ联合小分子抑制剂治疗胶质瘤提供新的临床治疗思路。

