雪旺细胞外泌体影响胶质瘢痕形成修复小鼠脊髓损伤的实验研究
潘大宇,宁广智,冯世庆
(天津医科大学总医院骨科,天津市神经科学院,中枢神经系统神经损伤后神经修复和再生教育部重点实验室,天津 300052)
脊髓损伤(spinal cord injury,SCI)后轴突严重受损和神经元死亡,导致运动和/或感觉功能永久丧失,影响脊髓通过大脑向身体损伤部位以下控制感觉、运动以及自主功能的系统传递信息的能力[1-5]。雪旺细胞的外表面有基膜,能够分泌营养因子来支持轴突生长,包括神经生长因子、脑源性神经营养因子、胶质细胞系神经营养因子和神经营养素[6-8],能够促进损伤后轴突的去分化和增殖,去除髓鞘和轴突碎片,其再生能力已被用于修复中枢神经系统内的损伤[9]。外泌体首先是在20世纪80年代被发现,并被描述为网状细胞分泌的内体衍生的小囊泡(30~150 nm),包含复杂的RNA和蛋白质,直径为40~100 nm的盘状囊泡[10-11]。外泌体能够充当信号传导体并将生物活性分子传递至特定的受体细胞以进行细胞间通讯[12]。研究表明,外泌体参与中枢神经系统(central nerve system,CNS)的许多生物学过程,如突触可塑性、髓鞘膜生物发生的调节以及将蛋白质或者核酸局部转运至高度极化的结构[13-14]。而雪旺细胞外泌体(schwann cell-derived exosomes,SCDEs)最近引起了越来越多实验团队的注意,已经有研究结果显示,SCDEs包含mRNA、miRNA和蛋白质,并能够在体内外增强轴突的再生[17-18]。因此,本研究的目的是研究小鼠脊髓损伤后SCDEs在功能修复的作用及其可能的机制。本研究的发现可能有助于开发治疗临床脊髓损伤的新型治疗策略。
1 材料与方法
1.1 雪旺细胞的原代提取和培养 由于雪旺细胞存在于外周神经,所以本研究选择大的外周神经坐骨神经来提取雪旺细胞。首先麻醉小鼠,然后使用颈椎脱臼法处死小鼠并用75%的乙醇全身消毒。将坐骨神经分离出来后汇集到装有无菌PBS的培养皿中,然后抽出PBS加入1 mL DMEM培养基(dulbecco′s modified eagle′s medium,DMEM) 和 300 μL 10 mg/mL 胶原酶孵育消化并分别用1 mL移液器吸头、18 G和21 G针头多次吸出和吹打组织,然后将细胞悬液通过70μm细胞过滤器滤入离心管中,500×g离心10 min后,丢弃上清液,用10 mL DMEM重叠细胞沉淀,轻轻摇动以均匀分布细胞,转入到5%CO2的37℃恒温箱中培养细胞1 d。第2天更换培养基。
1.2 SCDEs的提取 当雪旺细胞传至足够的皿数并具有一定细胞密度后,更换培养基为不含FBS的DMEM进行培养,并每3 d收集1次雪旺细胞培养基,将收集到的培养基通过多次超速离心获得SCDEs。第1次以1 000×g离心10 min,第2次以10 000×g离心30min。随后,第3次收集上清液,并在100000×g下超速离心1h以沉淀外泌体。用PBS洗涤SCDEs后,在100 000×g下超速离心最后1 h后得到SCDEs。
1.3 SCDEs鉴定 先使用醋酸戊酯浸没处理1 h,再用蒸馏水冲洗3次,然后浸没在无水乙醇中以去除铜网上的污物,在无菌容器中备有一定量的无菌水,然后加入2%的火棉胶醋酸戊酯溶液于液面中央来制备支持膜,通过控制无菌水水流流速将支持膜转移到载网上,然后制片后在透射电镜下观察。
1.4 SCI动物模型的建立和外泌体治疗 由中国人民解放军军事医学科学院实验动物中心获得6~8周龄雌性C57小鼠24只。给小鼠提供足够的标准食物和水,并在12 h/12 h的明暗周期下饲养。术前称重,并通过腹膜内注射3 mL/kg的4%水合氯醛对小鼠进行深度麻醉。使用显微剪对T10椎骨进行背侧椎板切除术以暴露脊髓,将微型止血钳横向钳夹暴露处整个脊髓5 s后松开,可观察到小鼠痉挛性摆尾,双下肢及躯体回缩扑动后双下肢瘫痪,以及硬脊膜充血水肿,从而造成脊髓挫伤模型。假手术组除了不进行脊髓钳夹,其他操作与上述操作一致。SCDEs治疗组和PBS组均通过尾静脉注射,每周2次,每次 3 μL/只。
1.5 免疫荧光染色 首先灌注取材,取出脊髓后4%多聚甲醛固定24 h,转入30%蔗糖溶液中脱水24 h,然后冰冻包埋后切片,厚度为10 μm,置于37℃烘箱中烘烤1 h,后使用PBS复水5 min,加入封闭液封闭1 h,然后孵育一抗,置于湿盒中4℃过夜,所用一抗为5-HT、β-Ⅲ-tublin和GFAP。第2天将湿盒取出常温复温1h后用TBST洗3次,每次10min,避光常温孵育二抗1 h。孵育完成后使用TBST洗3次,每次10 min,甘油封片后显微镜下观察。
1.6 统计学分析 所有数据均表示为x±s。通过GraphPadPrism7软件进行统计分析,并使用Student′st检验进行成对比较。使用带有Tukey事后检验的Two-way ANOVAs分析确定行为学分析中的显著差异,包括重复的数据。P<0.05为差异有统计学意义。
2 结果
2.1 SCDEs鉴定 本研究选用透射电子显微镜来观测外泌体双层囊膜超微结构。结果显示,SCDEs的直径范围为40~100 nm,证实已经分离出SCDEs(图 1)。
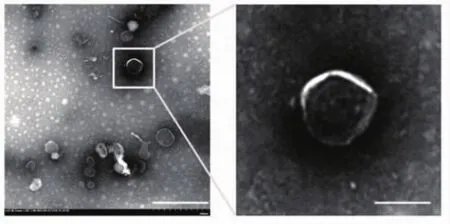
图1 SCDEs鉴定Fig 1 Identification of SCDEs
2.2 BMS评分 对于体内实验,本研究评估了SCI后使用 PBS 和使用 SCDEs治疗第 1、3、5、7、14、28、42及56天的小鼠的恢复情况。通过对小鼠后肢运动功能评价,本研究发现在SCDEs治疗组和PBS治疗组小鼠的BMS评分之间存在统计学上显著的时间依赖性变化,第28天P<0.05,第42天P<0.01,第56天P<0.001。该发现表明,SCDEs改善了SCI后运动功能的恢复(图2)。

图2 BMS评分Fig 2 BMS score
2.3 SCDEs促进SCI后的神经保护 为了研究SCDEs是否能够促进SCI后的神经保护,本研究在小鼠损伤部位检测了5-HT和β-Ⅲ-tublin的表达水平。免疫荧光的结果表明,SCI后,和PBS处理组相比,SCDEs治疗组的5-HT标记的神经递质向下传递增多,同时β-Ⅲ-tublin标记的神经在损伤区的分布密度增加而且损伤部位两侧正常神经结构的距离缩短(图3)。
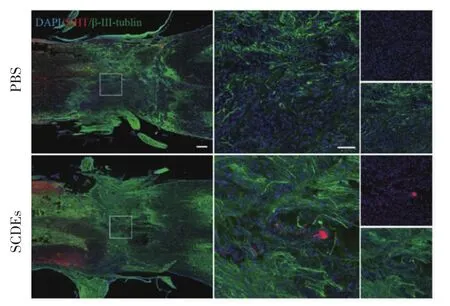
图3 SCDEs对SCI后神经保护的影响Fig 3 Effects of SCDEs on neuron protection after SCI
2.4 SCDEs促进SCI后神经保护的定量分析 定量分析的结果表明,和PBS处理组相比,SCDEs治疗组的5-HT和β-Ⅲ-tublin含量增高且差异具有统计学意义(图 4,P<0.01,P<0.05)。
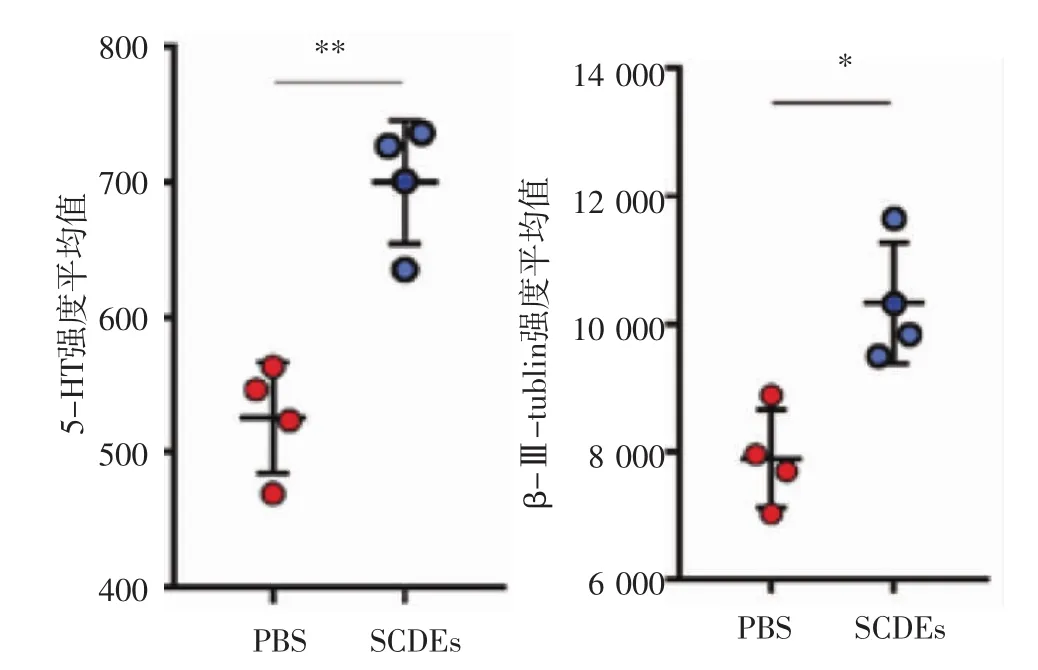
图4 SCDEs对SCI后神经保护的定量分析Fig 4 Quantitative data of SCDEs induced neuron protection after SCI
2.5 SCDEs治疗增加SCI后胶质瘢痕的形成 为探索SCDEs促进神经学功能恢复的机制,通过检测GFAP表达水平来观察胶质瘢痕的变化情况,免疫荧光的数据显示,与PBS组相比,SCDEs组胶质瘢痕表达增加,并且生长密度和延伸趋势明显(图5)。

图5 SCDEs对胶质瘢痕形成的影响Fig 5 Effects of SCDEs on glial scar formation
2.6 SCDEs治疗增加SCI后胶质瘢痕形成的定量分析 定量分析的结果表明,与PBS组相比,SCDEs组胶质瘢痕表达增加,差异具有统计学意义(图6)。

图6 SCDEs对胶质瘢痕形成影响的定量分析Fig 6 Quantitative data of SCDEs affected glial scar formation
3 讨论
本研究通过提取原代雪旺细胞并从其培养上清中超速离心出SCDEs,与PBS组相比,SCDEs组小鼠的行为学功能改善,神经学功能指标具有显著性改善,同时胶质瘢痕形成增加。以上结果表明,SCDEs可以通过影响胶质瘢痕的形成,从而增加神经元的存活和修复小鼠脊髓损伤。
在周围神经系统中,轴突在神经损伤后有效地再生,雪旺细胞在其中发挥重要作用[15],而在中枢神经系统中,由于神经元固有的局限性和限制再生的纤维瘢痕,再生能力差[16]。最近,有研究表明SCDEs包含mRNA、miRNA和蛋白质,并在体外和体内增强轴突再生[17-18]。此外,该研究还证明,p75NTR存在于SCDEs中,是一种前体再生的蛋白质。该蛋白在去分化的雪旺细胞中高表达,在病变区域丰富,并且p75NTR通过RhoA来调节生长锥状丝状伪足[14]。因此SCDEs的神经保护作用越来越受到关注。但是真正将SCDEs应用于中枢神经损伤治疗的研究屈指可数,本研究使用超速离心法分离出SCDEs进行小鼠脊髓损伤治疗,观察到SCDEs具有神经保护作用,并可恢复小鼠行为学功能,由于SCDEs获取相对比较困难,耗费时间长且成本投入高,所以如何更快更好的获取足量的SCDEs可能是临床转化中一个非常重要的限制因素。
近年来,对于胶质瘢痕的作用褒贬不一,之前很多学者认为胶质瘢痕在SCI后更多的扮演一个物理阻隔的作用,限制了轴突的再生和神经元的存活,而目前越来越多的研究显示,胶质瘢痕主要由星形胶质细胞、少突胶质细胞等构成,这些细胞本身就是构成轴突和支撑神经元的重要胶质细胞,所以它们的存在可以促进轴突的再生和神经元的存活[19-20]。本研究发现胶质瘢痕可以受到SCDEs的激活而表达增多,从而促进脊髓损伤后运动功能以及神经学功能的修复,但是SCDEs如何影响胶质瘢痕形成的机制还有待进一步研究。
——外泌体与老年慢性疾病相关性的研究进展

