甘青虎耳草乙酸乙酯提取物对小鼠肝癌细胞及原位移植瘤的抑制作用
崔玮,丁玲强,曾巧英
(1. 河西学院生命科学与工程学院,甘肃张掖 734000; 2. 河西学院实验动物中心,甘肃张掖 734000;3. 甘肃农业大学动物医学院, 兰州 730070)
甘青虎耳草(Saxifraga taugutica)是虎耳草科虎耳草属植物。 为常用藏药,藏药名松滴,其味苦、性凉,清热。 常用于治疗急性中耳炎、风热咳嗽、大泡性鼓膜炎、风疹瘙痒等[1]。 研究证实,甘青虎耳草中含有黄酮、多糖等生物活性物质,其中,乙酸乙酯提取物中槲皮素比较丰富[2],诸多研究表明,槲皮素通过调节抑癌基因表达、阻断细胞周期、诱导细胞凋亡、干扰细胞信号传导、抑制血管生成、阻滞肿瘤细胞侵袭及转移等多种机制来发挥抗肿瘤作用,对人前列腺癌、乳腺癌、肺癌、淋巴癌、卵巢癌等多种恶性肿瘤细胞均有抑制作用[3-6]。 肝癌是最常见的恶性肿瘤之一,死亡率高[7],目前有关甘青虎耳草对肝癌是否有影响的研究报道较少,甘青虎耳草乙酸乙酯提取物(EtOAc extract from Saxifraga taugutica,EST)对肝癌H22 细胞和其肝原位移植瘤的抑制鲜有研究。 为此,本试验研究了EST 对肝癌H22 细胞和其肝原位移植瘤生长的影响,旨在探讨甘青虎耳草在肝细胞癌治疗中的应用前景。
1 材料与方法
1.1 材料
1.1.1 细胞株
小鼠H22 肝癌细胞,购自中国典型培养物保藏中心。
1.1.2 实验动物
6 周龄 SPF 级 KM 小鼠,体重 18 ~ 22 g,来源于甘肃中医药大学科研实验动物中心【SCXK(甘)2015-0002】,在甘肃中医药大学科研实验动物中心进行实验【SYXK(甘)2015-0005】,所有操作均符合甘肃中医药大学动物实验伦理学要求(审批号:2018-310)。
1.1.3 试剂
细胞DNA 提取试剂盒(生工生物工程(上海)股份有限公司,批号:B511375);环磷酰胺(上海阿拉丁生化科技股份有限公司,批号:H58849);丫啶橙(AO) (上海生工生物工程有限公司,批号:140810);噻唑蓝(MTT)(上海源叶生物科技有限公司,批号:YY11351);多聚甲醛(Sigma 公司,批号:19J171120);苏木精(天津光复化学试剂有限公司,批号:090408);伊红(天津光复化学试剂有限公司,批号:75130319); RPMI-1640 培养基(Gibio 公司,批号:AE2446298);小牛血清(赛默飞世尔生物化学制品(北京)有限公司,批号:NYB0814)。
1.2 方法
1.2.1 EST 的制备
虎耳草→60℃ 烘干→粉碎→过筛(80 目)→石油醚浸泡(脱脂)→挥干→超声辅助乙醇回流提取(100 W)→合并粗提液→室温减压抽滤→滤液减压旋蒸→蒸馏水溶解→乙酸乙酯萃取→萃取液减压浓缩→冻干→蒸馏水溶解→AB-8 大孔树脂吸附→去离子水洗脱除杂→90% 乙醇洗脱→减压浓缩→异丙醇洗涤(2 次)→过滤→浓缩→甲醇除杂→冻干(棕黄色粉末)→甘青虎耳草提取物。
以芦丁作对照,硝酸铝法测得甘青虎耳草提取物中黄酮的纯度为82.07%。
1.2.2 EST 对H22 瘤细胞的体外抑制试验
(1)H22 细胞的形态学观察
将生长旺盛的H22 细胞以5 × 104细胞/孔接种于24 孔板,置37℃、5% CO2细胞培养箱培养24 h,PBS 清洗一次,加入含EST 的培养液,使其终浓度分别为 0 μg/mL、20 μg/mL、40 μg/mL、100 μg/mL、200 μg/mL、500 μg/mL,培养 48 h 后1000 r/min,离心10 min,弃上清,PBS 洗两次,收集细胞,加入100 μL PBS 重新悬浮细胞,与 4 μL AO/EB 荧光染液混合(AO、EB 各含 100 μg/mL),进行吖啶橙/溴化乙锭(AO/EB)双染色。 30 s 后在激光共聚焦显微镜下观察药物作用于细胞后细胞的形态变化及细胞的凋亡情况[8]。
(2)H22 细胞的基因组DNA 琼脂糖凝胶电泳分析
收集经 EST 0、20、40、100、200、500 μg/mL 处理的H22 细胞,用细胞DNA 提取试剂盒提取H22 细胞基因组DNA,1%琼脂糖凝胶电泳,凝胶成像仪拍照。 设 PBS 对照。
(3)细胞凋亡率的检测
收集经 EST 0 μg/mL 和 500 μg/mL 处理的两组H22 细胞,根据凋亡试剂盒的说明书用流式细胞仪检测分析。 每个处理 3 个重复,设 PBS 阴性对照。
1.2.3 EST 对H22 瘤细胞的体内抑制试验
(1)小鼠H22 肝癌细胞原位移植瘤模型的建立
依据参照文献[9]的方法略作改进,取对数生长期的H22 细胞,用生理盐水调整细胞密度(每毫升2× 106个),腹腔注射到雄性KM 小鼠体内,作为瘤源小鼠,取培养1 周的瘤源小鼠腹水,离心(1000 r/min、10 min)收集H22 细胞,生理盐水调整细胞密度(2 × 107/mL) 制成细胞悬液;选取健康昆明种小鼠(雌雄各半)、麻醉、腹部手术、暴露肝,向肝内注入10 μL H22 细胞悬液,棉签压迫止血、乙醇棉球擦拭,肝回纳腹腔,缝合伤口,小鼠肝癌细胞原位移植瘤模型建立完毕。 另外,肝接种生理盐水代替H22细胞实施假移植。
(2)动物的分组与处理
将肝癌原位移植瘤模型建立成功的小鼠随机分为:低剂量组、中剂量组、高剂量组、模型组和环磷酰胺组,每组10 只,雌雄各半,假移植小鼠作为对照组(10 只,雌雄各半)。 手术24 h 后开始给药,低、中、高剂量组分别灌胃 50、100、200 mg/kg 的EST 溶液,对照组、模型组灌胃生理盐水,环磷酰胺组按20 mg/kg 腹腔注射环磷酰胺,各组均连续处理14 d。
(3)抑瘤率及脏器指数的测定
末次给药12 h 后,脱颈处死小鼠,剖取肝、脾、胸腺,剥离肝肿瘤,计算抑瘤率和器官指数[10]。
抑瘤率(%)=[模型组平均瘤重(g)-给药组平均瘤重(g)]/模型组平均瘤重(g)×100%
器官指数=器官重(mg)/体重(g)
(4)T 淋巴细胞增殖功能的测定
试验动物的分组与处理同上,末次给药12 h后,脱颈处死小鼠,无菌取脾,制备脾细胞悬液,用含10%小牛血清的RPMI1640 培养液调整细胞密度为每毫升2 × 106。 每份脾细胞悬液在24 孔培养板中加2 孔,每孔1 mL,其中一孔加50 μL ConA 液,另一孔不加ConA 液作对照,细胞培养箱(37℃、5%CO2)培养44 h 时每孔弃去培养液0.7 mL,重新加入不含小牛血清的 RPMI1640 培养液0.7 mL,同时加入MTT(5 mg/mL),每孔50 μL,细胞培养箱中继续培养4 h 后每孔加入1 mL 酸性异丙醇,吹打多次,5 min 后用全波长酶标仪测定570 nm 下的OD值,以加ConA 的吸光度值减去不加ConA 的吸光度值表示T 淋巴细胞增殖情况[11]。
(5)肝组织学检测
用10%福尔马林固定肝组织24 h,常规石蜡包埋、切片、HE 染色,光学显微镜400 倍视野下观察肝组织形态学变化。
1.3 统计学分析
采用 SPSS 22.0 和 Excel 2016 进行统计学处理,用平均值± 标准差( ¯x ±s)表示,组间均值比较采用单因素方差分析,以P<0.05 为差异具有显著性,P<0.01 为差异极具有显著性。
2 结果
2.1 EST 处理后H22 细胞的形态学观察
如图1 所示,经AO/EB 细胞染色,阴性对照细胞形态规则均一,着色均匀,外形较圆,仅被AO 染色呈绿色;EST 处理细胞被 EB 染色,随浓度增加呈黄绿色直至橙红色,细胞膜皱缩、出芽、染色体固缩、边聚、碎裂等细胞凋亡特征,数量和程度与浓度正相关。
2.2 H22 细胞的基因组 DNA 琼脂糖凝胶电泳分析
如图2 所示,H22 细胞在不同浓度的EST 处理48 h 后,其 DNA 图谱在阴性对照(0 μg/mL)仅一条高分子质量条带;而其它浓度处理后均呈现典型的凋亡细胞特征性梯状条带,并随着EST 浓度增加细胞凋亡特征性梯状条带越明显,200 μg/mL 和500 μg/mL 处理组梯状条带最明显。
2.3 细胞凋亡率的检测
流式细胞仪分析表明,500 μg/mL EST 对H22细胞作用48 h,出现特征性的凋亡峰,即AP 峰,凋亡率为31%,而阴性对照(0 μg/mL)为 0.3%(图3),两组间差异极显著(P<0.01)。

注:a:正常细胞;b:细胞核碎裂;c:细胞核固缩;d:凋亡小体;e:坏死细胞。图1 EST 作用48 h 对H22 肝癌细胞形态的影响Note. a, Normal cell. b, Nuclear fragmentation. c, Nuclear shrinkage. d, Apoptotic body. e, Necrotic cells.Figure 1 Effect of EST on the morphology of H22 hepatoma cells after 48 h treatment

图2 EST 对H22 细胞作用的基因组DNA 片段电泳分析Figure 2 Electrophoretic analysis of genomic DNA fragments in H22 Cells by EST
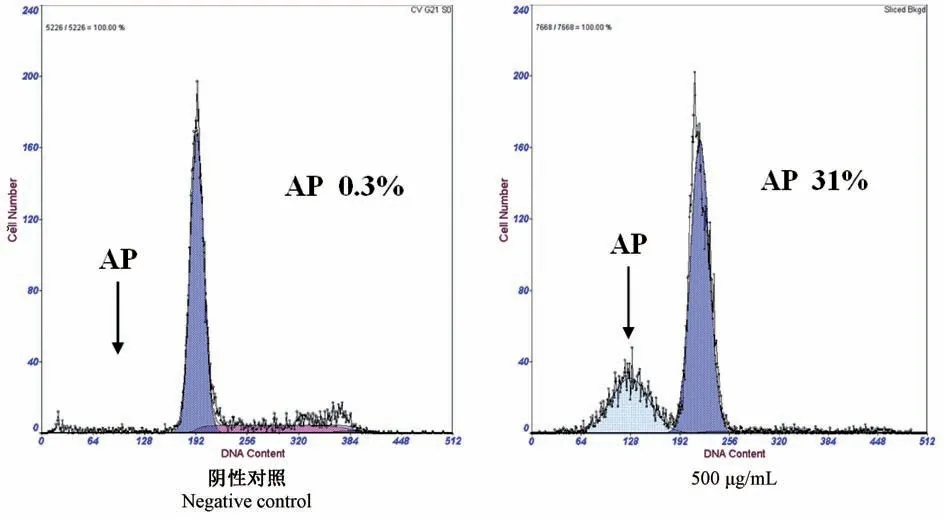
图3 EST 对H22 细胞作用的流式细胞分析图Figure 3 Flow cytometric analysis of the effect of EST on H22 cells
2.4 EST 对小鼠H22 肝瘤的抑瘤效果
由图4 可以看到,除对照组外,EST 各剂量组、模型组和环磷酰胺组小鼠的肝均有大小不同肿瘤,说明原位移植瘤模型的建立是成功的。
由表1 可知,给药组平均瘤重显著低于模型组(P<0.05),且呈现出了一定的量效关系。 高剂量组的抑瘤率为64.3%,接近环磷酰胺组的78.7%。而根据国家药监局新药特药评审规定,抑瘤率达30%以上,就算作有效,即可作为新药开发。 表明甘青虎耳草乙酸乙酯提取物在一定程度上能够明显抑制肝癌的生长。
2.5 EST 对小鼠免疫器官指数和T 淋巴细胞增殖能力影响
由表2 所示,与模型组比较,环磷酰胺组小鼠脾指数和胸腺指数显著下降(P<0.05),其与环磷酰胺强大的免疫抑制作用有关;与环磷酰胺组比较,EST 高剂量组小鼠的脾指数和胸腺指数均显著升高(P<0.05),提示该剂量甘青虎耳草乙酸乙酯提取物对小鼠免疫系统毒副作用较低。
由表2 也可看到,与空白对照组比较,模型组和环磷酰胺组小鼠 T 细胞增殖能力显著下降(P <0.05);与模型组比较, EST 各剂量组小鼠T 细胞增殖能力显著升高(P<0.05),且具有剂量依赖趋势,提示甘青虎耳草乙酸乙酯提取物能提升肝癌小鼠细胞免疫能力。
2.6 EST 对H22 肝癌小鼠肝组织形态的影响
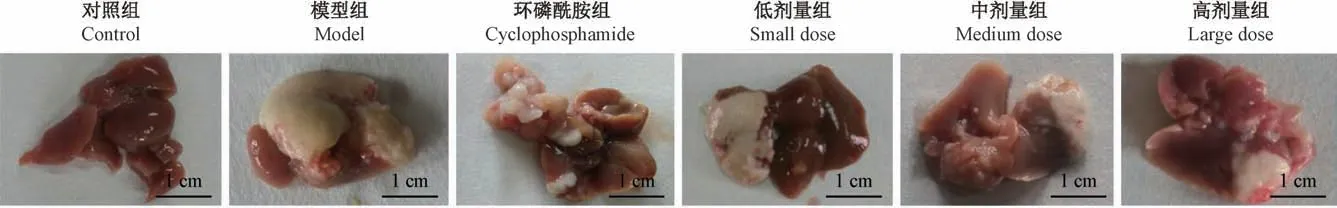
图4 小鼠肝癌细胞原位移植瘤生长情况Figure 4 Growth of orthotopic xenograft of mouse hepatoma cells
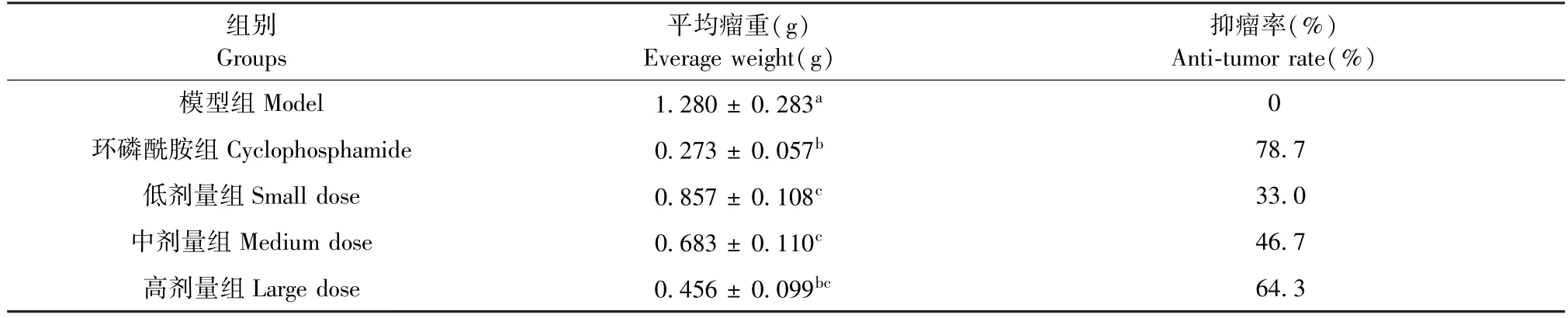
表1 EST 对小鼠H22 肝移植瘤的抑制作用( ¯x ±s,n=10)Table 1 Inhibition of EST on H22 liver xenograft in mice( ¯x ±s,n=10)
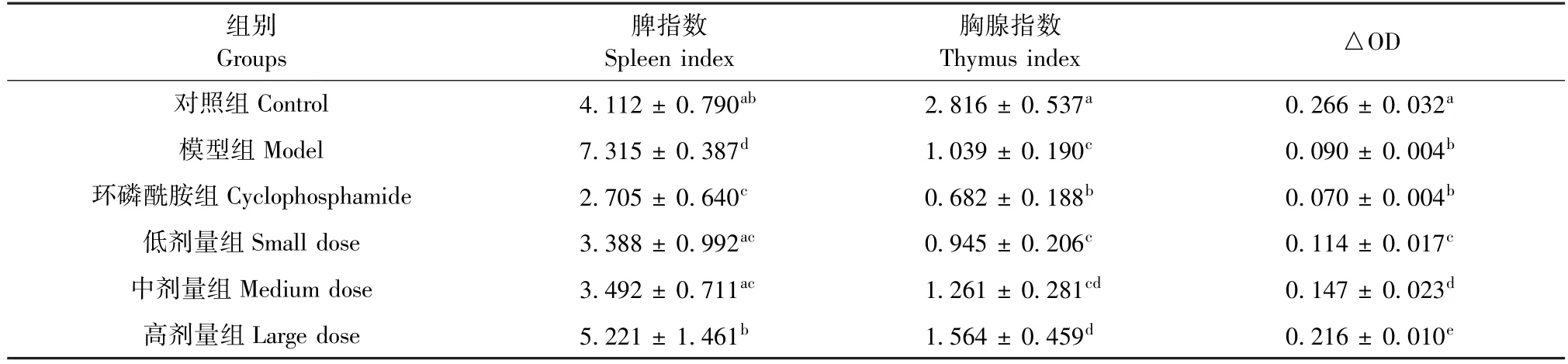
表2 EST 对小鼠器官指数和T 淋巴细胞增殖能力的影响( ¯x ±s,n=10)Table 2 Effects of EST on organ index and T lymphocyte proliferation in mice( ¯x ±s,n=10)
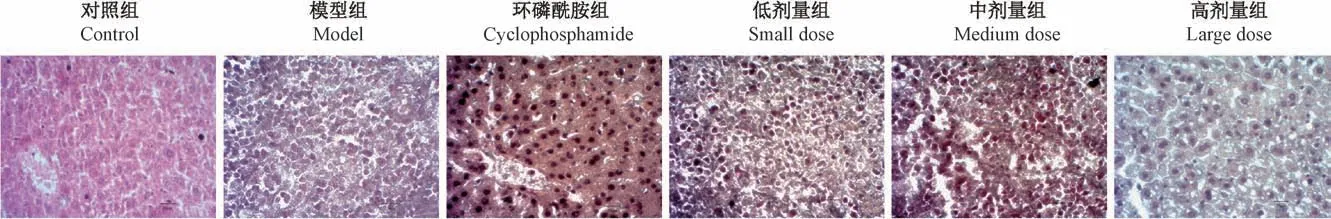
图5 肝癌小鼠肝组织HE 染色结果(× 400,标尺=20 μm)Figure 5 HE staining results of liver tissues of mice with liver cancer(× 400, Bar=20 μm)
如图5 所示,对照组小鼠肝小叶结构清晰,细胞排列整齐;模型组小鼠表现为组织结构紊乱、肝小叶消失、汇管区消失、细胞密度增加、细胞增生、细胞异型性明显,表现出炎性反应、癌变等特性;EST各治疗组癌细胞有不同程度的生长抑制,主要表现为癌细胞固缩,癌细胞向周围肝组织浸润减少。
3 讨论
肝癌是人类最常见的恶性肿瘤之一,具有治愈率低、致死率高等特点,对人类的生命健康构成严重威胁。 当前在对肿瘤患者实施临床治疗时,主要应用顺铂、环磷酞胺等化疗药物,虽然有很明显的抑制肿瘤作用,但是其毒副作用很大,表现为破坏机体免疫力、抗氧化能力和肝损伤等[12]。 近年来,研究发现很多传统中药在治疗恶性肿瘤方面具有毒副作用小,可以提高肿瘤患者的生存质量,在恶性肿瘤治疗方面有广阔的应用前景[13]。 甘青虎耳草是有抗炎、抗氧化作用的常用藏药。 近年研究发现,同属植物虎耳草具有抑制前列腺增生、提升Lewis 肺癌移植瘤小鼠抗氧化能力以及促进肿瘤细胞的凋亡,且显示出有效、低毒的优点[14]。 但甘青虎耳草及其活性成分在肿瘤治疗方面的研究未见报道,因此,我们课题组设计试验,用乙酸乙酯提取甘青虎耳草黄酮,研究其体外对小鼠H22 肝癌细胞的抑制作用以及体内对小鼠肝癌原位移植瘤的抑制作用。
结果显示, EST 在体外能够诱导H22 细胞的凋亡,且凋亡程度与EST 浓度相关,浓度越大,H22 细胞凋亡程度越大。
体内实验表明,EST 各剂量组在小鼠体内都能达到抑瘤的效果,其中高剂量(200 mg/kg)对小鼠H22 肝癌移植瘤的抑瘤率达到64.3%,具有显著的生长抑制作用;肿瘤组织病理学观察结果也显示,EST 使肝癌细胞生长受到抑制,癌细胞向肝组织浸润程度减轻,进一步表明EST 可以抑制肝癌生长。
肿瘤的发生、发展与机体的免疫功能有关,研究发现,肿瘤患者免疫功能明显低下,表现为胸腺严重萎缩,T、B 细胞增殖力下降,T 淋巴细胞总数、T淋巴细胞亚群CD3+、CD4+和 CD4+/CD8+比值均明显低低下,提示癌症患者机体免疫抑制是导致肿瘤无限制增长和免疫逃避的一个重要因素[15-16]。 本试验体内实验结果显示,EST 能提升肝癌小鼠T 细胞增殖能力和胸腺指数,对荷瘤小鼠免疫力低下有一定的改善作用,表明甘青虎耳草乙酸乙酯提取物可以有效增强肝癌小鼠的免疫功能,提高机体免疫力,从而发挥抗肿瘤的作用。
综上所述,甘青虎耳草乙酸乙酯提取物中主要的活性物质—黄酮类物质,具有明显的体内外抗肝肿瘤活性,其作用机制可能与其增强机体免疫力促进肝癌细胞凋亡有关。 但甘青虎耳草乙酸乙酯提取物是如何激活机体免疫调节还有待进一步研究。

