大鼠孤束核微量注射的定位初探
舒晴,邵雨薇,2,田峻,杨亚南
(1. 武汉大学中南医院康复医学科,武汉 430071; 2. 武汉大学第二临床学院,武汉 430071;3. 华润武钢总医院中医科,武汉 430080; 4. 武汉科技大学职业危害识别与控制湖北省重点实验室,武汉 430000)
作为神经科学的重要研究手段,应用光遗传学和化学遗传学进行神经环路的研究在近年来方兴未艾,越来越多的神经核团及相关神经元的功能被发现。 作为神经环路研究中最基础的一环,核团的定位注射的准确性直接关系到实验的成败。 但是,作为实验操作步骤的关键,一些复杂核团的注射参数往往在文献中只有简单的描述,其它学者进行相关后续研究时容易走弯路。 孤束核(nucleus of the solitary tract,NTS)位于延髓背侧、迷走神经背核的背外侧,为孤束的止点,在吻尾方向上形成Y 字形细胞柱,贯穿延髓全长[1]。 其在颅骨表面的投影已经超过了颅底,到达了第1、2 颈椎。 在现有文献报告中,孤束核的定位及注射参数出现了一定的差异性[2-5]。 笔者通过深入解读相关文献,并应用不同注射参数进行重复性注射,初步探索出大鼠孤束核定位注射的参数。
1 材料与方法
1.1 材料
1.1.1 实验动物6 ~12 周龄SPF 级雄性Wistar 大鼠15 只,体重200 ~400 g,由北京维通利华实验动物技术有限公司提供【SCXK(京)2019-0010】。 实验操作在武汉大学中南医院实验动物中心【SYXK(鄂)2015-0025】进行,自由进食饮水,12 h 明暗周期,动物房温度(22 ± 2)℃,相对湿度(50 ± 10)%,每天更换垫料、饮水、清洗大鼠饮水器。 动物处理及饲养条件按照实验动物使用3R 原则给予人道主义关怀,并遵照《中华人民共和国实验动物管理条例》和《实验动物质量管理办法》实施。 本实验经武汉大学实验动物中心经伦理审查后施行(AUP Number:2019025 号)。
1.1.2 试剂及仪器
小动物麻醉用异氟烷(分析纯,深圳市瑞沃德生命科技有限公司,批号:20160218),霍乱菌素亚单位B-488(Cholera Toxin Subunit B Alexa Fluor 488 Conjugate, CTB-488, No. C34775),霍乱菌素亚单位B-594(Cholera Toxin Subunit B Alexa Fluor 594 Conjugate, CTB-594, No. C34777),4%多聚甲醛(国药集团)。
数显脑立体定位仪(深圳瑞沃德),异氟烷小动物麻醉系统(深圳瑞沃德),微量注射泵(兰格Longer,TJ-4A/SL0107-1A),玻璃电极拉制仪(日本Narishige,PC-10),玻璃电极(美国SUTTER, No.BF120-60-10),微量进样器(上海高鸽,1 μL),脑定位仪专用大鼠麻醉面罩、定位针夹持器、麻醉诱导盒、颅钻(钻头直径0.5 mm);玻璃离子水门汀(上海新世纪齿科), 荧光显微镜(奥林巴斯,BX-53)。
1.2 方法
1.2.1 动物分组
根据实验流程的进度,最终所有大鼠被分为垂直注射组(n=2)、Bregma 定位组(n=5)和Lambda定位组(n = 8),但各组大鼠不在同一时间进行实验。
1.2.2 大鼠孤束核微量注射的方法
(1)微量注射器的制作
应用玻璃电极拉制仪,应用“一步法”拉制尖端直径约100 μm 的玻璃电极注射针,在电极内灌注石蜡油后与微量进样器连接并用热胶固定保持密封性。
(2)进针点及进针角度
将麻醉好的大鼠固定在大鼠脑立体定位仪上。备皮,用剪刀剪开皮肤、皮下组织,钝性分离骨膜,暴露颅骨显示人字缝和十字缝,用无菌干棉球擦干净局部。 前后左右调平颅骨,保持前、后囟和后囟左右2.5 mm 均在同一平面。 根据《The Rat Brain:in Stereotaxic Coordinates (6thedition)》[6]确定参照点,根据各组进针方法的不同确定进针点及进针角度,在进针点用颅钻钻取0.5 mm 圆孔。
(3)微量注射
微量注射泵吸取CTB-594 或CTB-488 0.3 mL后,根据各组定位参数的不同注射0.26 mL 于定位点,注射时间5 min,注射完成后保留5 min,拔针后用玻璃离子水门汀封闭进针点再缝合伤口。 术后所有大鼠连续3 d 肌肉注射庆大霉素,根据大鼠与人的剂量换算方法[7],大鼠注射剂量为成人临床给药剂量(mg/kg)的6.3 倍。 注射完成后大鼠正常进食进水。
1.2.3 大鼠取材、切片及成像
术后3 d 大鼠4%多聚甲醛心脏灌注后取全脑,全脑于4%多聚甲醛溶液中后固定72 h,固定完成后放入25%蔗糖溶液中脱水。 全脑组织脱水完成后,取大鼠孤束核所在冠状面行10 μm 冰冻切片。冰冻切片自然解冻后封片,在荧光显微镜下观察拍照。
1.2.4 孤束核注射位点的标准位置
根据脑定位图谱及相关文献确定大鼠孤束核的中后部,由第四脑室脉络丛(choroid plexus,chp)移行为中央水管(central canal,cc)后的切面为注射标准位置[8],对应图谱大鼠冠状切面图1A 中Figure 147(Bregma-13.68 mm) 至 图1B 中Figure 157(Bregma-15.00 mm),见红色标记位置。
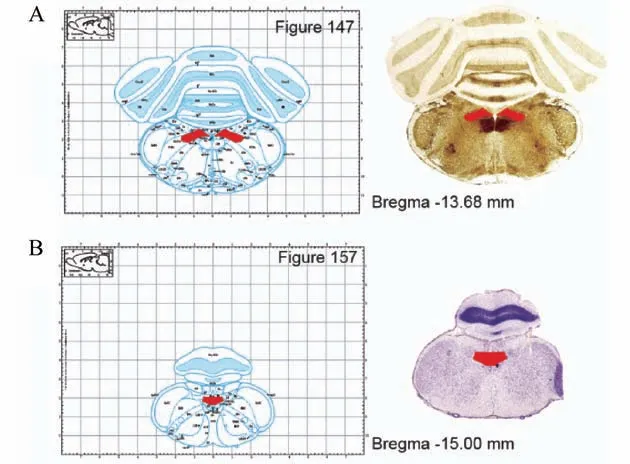
图1 孤束核注射的标准位置Figure 1 Standard localization of microinjection in solitary nucleus
2 结果
2.1 以Bregma 和颅底为基准点垂直于颅骨平面进针无法注射至孤束核标准点
根据《大鼠脑定位图谱》[6]以大鼠颅骨平面Bregma-13.5 mm 为进针点进针,分离大鼠颅骨平面外皮肤及皮下组织,发现Bregma-13.5 mm 所在位置已超过颅底,无法在大鼠颅骨上进行打孔注射等实验操作。 改用沿着颅底前缘0.5 mm 进针,进针深度7.5 mm,注射CTB-594 0.26 mL。 冰冻切片显示CTB 注射位点在脉络丛所在冠状切面约Bregma-13 mm 处(见图2),说明以Bregma 为基准垂直注射,即使以颅底前缘为进针点仍无法准确注射至孤束核的标准位置。
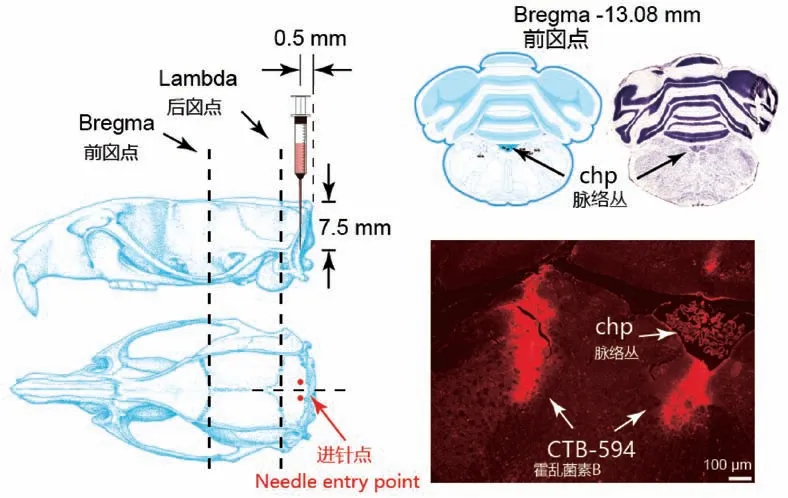
图2 以Bregma 和颅底为基准点垂直于颅骨平面进针示意图及注射位置荧光Figure 2 Schematic diagram of needle insertion perpendicular to the skull plane based on Bregma and skull as reference points and the injection position of fluorescence
2.2 以Bregma 为基准点以一定角度斜刺无法准确注射至孤束核标准点
在选取颅骨底部进针点直刺的情况下仍无法达到NTS 中后部,故改为斜刺。 通过三角函数的计算,以Bregma-14.5 mm 为垂直进针点(在颅底后方),垂直注射深度为7.86 mm,实际斜刺进针点为Bregma-11 mm,进针角度为24°,通过三角函数计算出进针深度为8.6 mm(图3A)。 注射后切片观察发现,同样的注射参数,荧光标记的位置仍有差异(图3),甚至在同一体重下,冠状切面的荧光标记位置也有差异(表1)。
2.3 以Lambda 为基准点以一定角度斜刺可以准确注射至400 g 左右的大鼠孤束核
结果提示,以Bregma 为基准点进行定位无法准确注射到大鼠孤束核。 故本实验以Lambda 为基准点进行定位。 以大鼠脑定位图谱中Interaural 点与Lambda 点的位置关系及Lambda 点后方能够进行打孔的颅骨平面最佳位置为依据,通过三角函数计算出进针点位于Lambda-3.2 mm、中线双侧旁开0.5~0.7 mm。 进针斜刺角度向后24°、斜刺深度9.6 mm 为注射点(图4C)。 将不同体重大鼠均以上述注射参数进行注射。 结果发现,体重为266、357 g的大鼠荧光信号的位置位于延髓背侧且未见到针痕,仅有少量强度很弱的荧光标记。 体重为395、450、382 g 的大鼠脑均看到明显的针痕及明亮的荧光,且至少一侧的荧光标记位于孤束核或孤束核稍上方位置。 说明以Lambda 为基准点以一定角度斜刺可以准确注射至400 g 左右的大鼠孤束核。 (见表2 及图4)
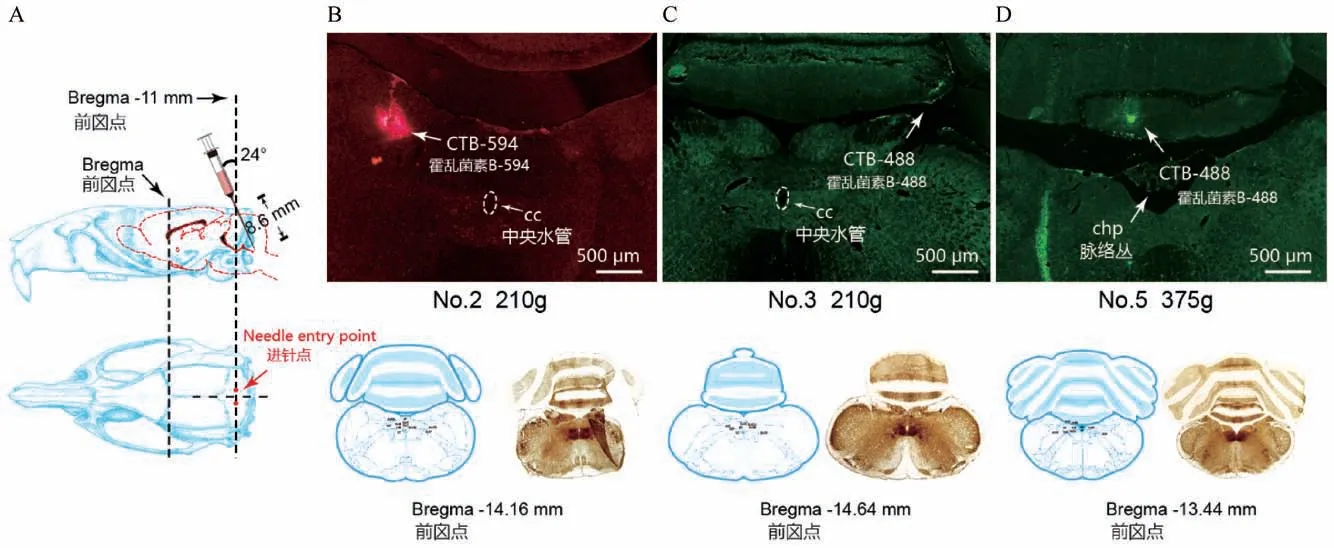
图3 以Bregma 为基准点以一定角度斜刺示意图(A)及荧光定位图(B, C, D)Figure 3 Schematic diagram of the oblique puncture at a certain angle with the Bregma as the reference point (A)and the injection position of fluorescence (B, C, D)

表1 大鼠以Bregma 为基准点以一定角度斜刺注射后荧光标记的位置Table 1 Position of the fluorescent marker after oblique injection at a certain angle with Bregma as the reference point
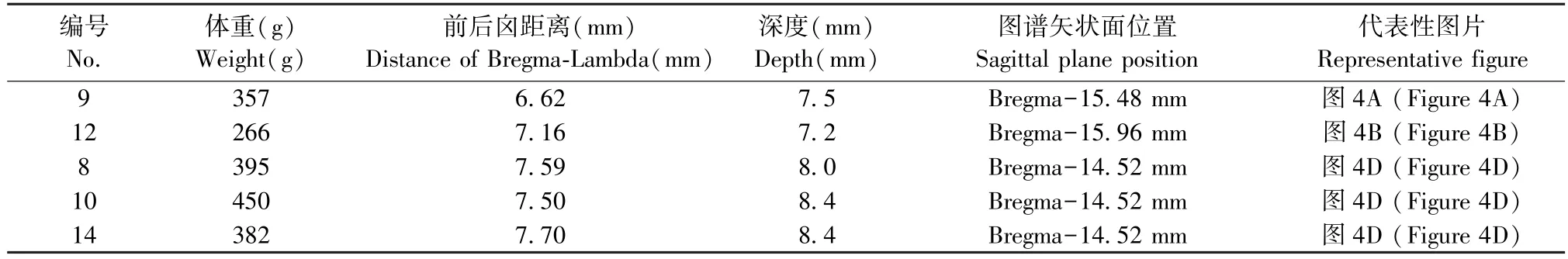
表2 以Lambda 为基准点斜刺大鼠注射后荧光标记的位置Table 2 Position of the fluorescent marker after oblique injection at a certain angle with Lambda as the reference point

图4 以Lambda 为基准点以一定角度斜刺的示意图(C)及荧光定位图(A,B,D)Figure 4 Schematic diagram of the oblique puncture at a certain angle with the Lambda as the reference point (C)and the the injection position of fluorescence (A, B, D)
3 讨论
孤束核因包绕孤束而得名,孤束由迷走神经、舌咽神经及面神经的内脏初级传入纤维组成, 最终止于孤束核[9]。 孤束核接受来自舌咽神经、舌下神经的味觉传入纤维[10],并将该信息传至臂旁核和延髓网状结构从而产生味觉[11]。 另外,孤束核还接收来自颈动脉体和主动脉弓中压力化学感受器的信息,通过传出副交感神经和交感神经复合体调节血压和心率[12]。 作为心肺传入输入的一级神经核团,孤束核接收包括血液pH、血氧水平、周围的化学感受器,压力感受器和肺拉伸受体等输入,进而调节呼吸[13]。 另外,孤束核还能够接收来自外周的饱腹信号并传递至下丘脑的食欲调控神经元,参与饱腹感的调节,最终发挥调控食欲的作用[14]。 以上这些研究均说明孤束核是中枢神经系统参与内脏调节的重要核团,具有深入研究价值。
早期孤束核的定位注射实验中脑立体定位仪的应用并不普遍,常常以写翮(calamus scriptorius,延髓背面作为第四脑室底的菱形窝的下端最狭窄部分)作为标志点[2,15],随后固定注射针后直接对着延髓进行注射。 注射前需要分离颈后部软组织并暴露延髓背面,这种注射方式的创伤性明显高于脑立体定位仪通过颅骨打孔后注射。 但近年来仍有研究在应用这种方法[3,16]。 另外,大部分文献对NTS 注射过程进行描述时,均只描述出脑立体定位仪的参数,参数均为Bregma 为基准点前后轴(anterior-posterior, AP)-12.5 ~ AP-14.5 mm 不等[4-5,17]。 但实际情况下,AP-13.00 mm 向后的打孔位置已经非常接近颅底区域,由于大鼠颅骨平面延伸到颅底后向颈椎方向有一定有角度的反折,所以AP-13.00 mm 以后的颅骨平面完全没有空间再进行垂直打孔注射的操作。 因此,要想利用脑定位仪在颅骨表面打孔进行注射,只能通过一定角度向后斜刺才能到达NTS。 实验结果也表明,沿着颅骨底部的前缘直刺,也只能将CTB 注射至第四脑室脉络丛所在的冠状切面,无法达到标准的 NTS 注射点。
早在上世纪70 年代,就有学者对大鼠前后囟的间距进行了统计,结果发现体重越大的大鼠前后囟间距越长[18]。 但由于当时研究的样本量不大,所以无法对相同体重区间的大鼠前后囟距离进行有效统计。 另外,Bregma 的不稳定性早有报道,特别是在Wistar 大鼠上表现明显[19]。 基于这种不稳定性,有学者提出用新的方法来确定其位置,可以提高定位注射或埋置电极的稳定性[20]。 如2.2 结果所示,由于孤束核处于后脑,且未成年大鼠的前后囟距离并不稳定,这也是导致注射位点偏浅的一个重要原因。 另外,Bregma 选择的误差可能也是注射位点过于远离中心点的原因之一。
在大鼠脑定位图谱第6 版[6]中,颅骨表面的定位点包括两个基准点:前囟点(Bregma)和内耳点(Interaural)。 Bregma 为大鼠颅顶冠状缝和矢状缝的相交点,呈现十字型,因为体表定位清楚,为最常用的基准点。 Interaural 为两耳道连线的中点,但无法在颅骨表面进行直接定位,故选择Lambda 点作为后脑区定位的基准点。 Lambda 点位于人字缝(lambdoid suture)和矢状缝的结合处后方,是人字缝最佳拟合曲线的中点。 另外,标准图谱的大鼠体重为290 g,而成年大鼠(平均436 g)的Interaural 点位于Lambda 点后方约0.3 ~0.9 mm。 有学者通过统计235 项应用了脑立体定位技术的研究,发现96%的实验中以Bregma 为基准点进行注射,而且这些研究中,有35%的注射点与 Lambda 或Interaural 的距离比Bregma 更近[21]。 该统计结果说明,虽然在实际实验操作中以更近Lambda 为基准点可能会让注射部位更加精准,但是可能由于习惯性思维,绝大部分研究还是选择Bregma 作为基准点。 在实验三中,改用Lambda 作为后脑注射的基准点以一定有角度斜刺。 结果发现,体重不到400 g 的大鼠注射后荧光位置均标记在延髓与小脑的间隙,可能由于CTB 注射至脑干和延髓之间的缝隙,仅感染了脑干背部表面的神经细胞,而400 g 左右的大鼠均可以准确注射至NTS。 说明即使应用Lambda 作为后脑区核团的注射点,也可能因为大鼠的体重差异出现注射点的偏差,这一偏差可能与大鼠及其大脑的脑发育有关。 但是目前大鼠脑形态的发育和年龄的关系尚未发现有系统研究。 由于大鼠在10 ~11 周龄进入性成熟期,体重在400 g 左右[22],我们推测以400 g 左右或以上的大鼠进入成熟期后,颅骨及大脑的发育趋向于稳定,更有利于注射的准确性。
本实验也存在一定的局限性。 首先,大鼠脑立体定位仪没有调节左右平衡的耳杆,操作过程中左右平面未调平会导致注射位点向一侧偏移。 所以在进行头部固定的时候需要更加精准的插入耳杆,以保持颅骨的左右水平。 其次,本次实验中所用大鼠总数量并不太多,但通过调整参数最终多次注射成功可以一定程度上说明本实验具有可重复性。第三,图4 中注射成功的代表性图片在实际操作中为双侧注射,400 g 以上大鼠至少能够保证一侧大鼠神经元能够被感染,并不会影响实验结果。 至于未成年大鼠的注射方法,则需要进一步探索。
有学者通过统计发现39%的研究并没有对注射位点进行准确性确认,也仅仅只有15%的研究指出在实验过程中有注射偏离正确位置的情况发生[21]。 我们通过挖掘文献及进行不同注射参数的反复试验,在400 g 左右的大鼠中,以Lambda 为基准点以一定角度斜刺可以准确注射至大鼠孤束核。本实验的成功既能够作为后续实验的准确性确认依据,也能够为其它需要进行NTS 注射的实验提供一些基础和线索。

