高脂血症易感(WSHc)大鼠自发性后肢瘫痪的病症特点研究
马全鑫,张利棕,郁晨,戎亦骊,徐松涛,蔡月琴,沈利叶,陈民利
(浙江中医药大学,动物实验研究中心/比较医学研究所,杭州 310053)
Wistar-SD 高脂血症易感 ( Wistar-SD hyperlipidemia,WSHc)大鼠是本动物实验研究中心发现并培育研究的一种特色实验动物品系。 该品系雌性大鼠经高脂诱导后,平均血清总胆固醇(total cholesterol,TC)水平可达 6.0 mmol/L 以上[1]。 经过筛选和繁育,目前本中心已形成了具有一定规模,遗传性状较稳定的封闭群。 日前,本课题组发现在封闭群中的一个繁殖家族的WSHc 大鼠中,有个别动物成年后会出现可遗传的自发性的后肢瘫痪,雌雄均可发病。 起初表现为步态不稳,进行性地发展为后肢完全丧失活动能力,但头部和前肢活动力不受影响,可长时间存活,类似于人类运动神经元疾病(motor neuron diseases,MND)的症状,但其病理特点和发病机制尚不清楚。
现有的研究发现,MND 的病理特点往往伴随自由基损伤、炎症反应、细胞凋亡等基因表达和细胞代谢的改变[2-3]。 而半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-1)是炎症性反应中的关键因子,触发其后一系列细胞、分子水平的反应,导致细胞程序性死亡,从而加重中枢神经损伤[4-5]。 基于此,本研究选取具有自发性后肢瘫痪症状的WSHc 大鼠,观察该病症与高脂血症易感的相关性,并通过影像学和病理组织学观察病变部位和病理特点,从炎症和细胞程序性死亡的角度初步探讨该病症可能的发病机制,为明确该模型发病的一般规律和病理特点提供实验依据,并分析其应用与科学价值。
1 材料与方法
1.1 材料
1.1.1 实验动物
本课题组自繁殖WSHc 大鼠16 只,雌雄各半,其中8 只为自发性后肢瘫痪,8 只无瘫痪症状。 饲养于浙江中医药大学动物实验研究中心屏障实验室【SYXK(浙)2018-0012】,环境温度20 ~ 24℃,相对湿度 50% ~ 70%,早 7 ∶00 至晚 19 ∶00 明暗交替光照,噪声 <50 dB;在 IVC 笼内饲养,自由饮食。浙江中医药大学实验动物保护和使用委员会(Institutional Animal Care and Use Committee,IACUC)审议通过,决议编号:IACUC-20191216-08。
1.1.2 试剂与仪器
TC、三酰甘油(triylglycerides,TG)均购自上海申能德赛诊断技术有限公司;HE 染色试剂盒(G1120-100),购自索莱宝生物技术有限公司;TUNEL 免疫组化染色试剂盒(12156792910),购自上海罗氏诊断产品有限公司;总RNA 提取试剂盒(9767)、反转录试剂盒(RR037A)、TB Green RTPCR 染料(RR430A)均购自大连宝生物有限公司;总蛋白提取试剂盒(KGM451),购自南京凯基生物科技发展有限公司;全自动微量蛋白定量分析测试板(12-230 kDa),购自上海普诺森生物科技公司;使用以下抗体:anti-Caspase-1 (Santa Cruz, SC-56036)、anti-IL-1β (Santa Cruz, SC-52012)、anti-GAPDH (Santa Cruz, SC-166545)。 普通基础饲料购自南京爱立默科技有限公司,辐照全营养颗粒饲料。 高脂饲料配方:胆固醇1%、猪油10%、蛋黄粉10%、3 号胆盐0.5%、基础饲料78.5%。
GE 3.0T 磁共振仪(美国,通用电气公司);7020全自动生化分析仪(日本,日立公司);RM2255 半自动石蜡切片机(德国,Leica 公司);Autostainer XL 全自动染色机(德国,Leica 公司); WES 全自动蛋白定量分析仪(美国,Protein Simple 公司); Step One Plus 实时荧光定量 PCR 仪(美国,Thermo Fisher 公司);全自动数字切片扫描设备(日本,滨松公司)。
1.2 方法
1.2.1 自发性后肢瘫痪大鼠的发生率、一般体征和血脂水平的观察
首次发现的一只后肢瘫痪雌性WSHc 大鼠种鼠作为F0 代,将其与同一胎出生的雄性非后肢瘫痪WSHc 大鼠进行近亲交配,繁殖2 胎,记录出生仔鼠和断奶鼠的数量,在12 周龄时观察大鼠运动形态,步态不稳的大鼠定义为发病大鼠。 随后,取两对步态不稳的雌雄大鼠(F1 代)进行近亲交配,繁殖1胎,记录出生仔鼠的数量、断奶鼠数量和发病的大鼠数量。 取8 只12 ~14 周自发性后肢瘫痪大鼠(F2 代)与8 只来自同一家族的同周龄无瘫痪症状的大鼠,均为雌雄各半。 随机分为4 组,即非后肢瘫痪WSHc 大鼠 + 普通饲料(NLP + SC)、非后肢瘫痪WSHc 大鼠 + 高脂饲料(NLP + HFD)、后肢瘫痪WSHc 大鼠 + 普通饲料(LP + SC)、瘫痪 WSHc 大鼠+ 高脂饲料(LP + HFD)。 分别饲喂不同饲料4 周后,检测空腹血脂。 自断奶开始,记录每周记录大鼠步态和体征。
1.2.2 大鼠脑磁共振成像
大鼠45 mg/kg 戊巴比妥钠麻醉后行俯卧位,采用磁共振扫描仪与大鼠颅脑部专用线圈,对正常饲料饲喂的大鼠大脑和小脑进行常规T2 冠状面扫描,MRI 序列如下:重复时间为2000 ms,视野范围为50 mm × 50 mm,层厚为5 mm,回波时间为36 ms,翻转角为 90°,矩阵 = 396 × 264,Bangwith 为432.1 Hz,序列扫描时间为13 min。
1.2.3 脑与脊髓组织病理学观察
大鼠45 mg/kg 戊巴比妥钠麻醉后,使用冷的生理盐水灌注5 min,冲净血液,再用4%多聚甲醛进行灌注20 min,小心地摘取大鼠小脑组织和脊髓(上、中、下三段),置于10%中性甲醛中固定。 一周后取材,经脱水包埋后制成蜡块,4 μm 切片,脱蜡、透明后,行常规HE 染色并封片,使用数字病理切片扫描分析仪扫片,观察各组大鼠小脑及各段脊髓的病理学变化。
1.2.4 脑与脊髓组织免疫组化观察
将小脑与脊髓组织的切片置于60℃烘箱内烤片2 h;脱蜡,使用高压锅热修复;3% H2O2浸泡15 min使过氧化物酶猝灭;蒸馏水冲洗,PBS 溶液洗三遍;制备后的切片按照TUNEL 试剂盒说明书步骤进行操作,染色完成后,封片,使用数字病理切片扫描分析仪扫片,利用NDP 软件进行阳性细胞比例分析。
1.2.5 荧光定量PCR 检测小脑和脊髓中IL-1β 和Caspase-1 基因的 mRNA 表达
使用总RNA 提取试剂盒分别提取正常饲料饲喂的大鼠小脑、脊髓组织RNA,反转录成cDNA 后待用,查找大鼠 IL-1β、Caspase-1 和 GAPDH mRNA 序列,设计各引物序列如下(5′-3′):IL-1β:F-GCCAACAA GTGGTATTCTCCA,R-CCGTCTTTCATCACACAGGA;Caspase-1:F-ACCGAGTGGTTCCCTCAAGT,R-GGCA AGACGTGTACGAGTGG ;GAPDH:F-ATGCTGGTGCC GAGTATGTTGTG,R-GCAGAAGGTGCGGAGATGATG AC。 使用Step One Plus 实时荧光定量PCR 仪进行RT-PCR 反应。 反应体系为 20 μL,包括 1 μg cDNA溶液8 μL,10 μL TB green 染料以及上下游引物各1 μL。 循环次数为40 次,反应条件按试剂盒说明书推荐条件进行。 GADPH 内参基因内标对照,并以非后肢瘫痪大鼠对应部位的表达量作为参照,目的基因转录水平通过公式2-△△CT计算。
1.2.6 Western Blot 检测 IL-1β 和 Caspase-1 的蛋白表达水平
取各组大鼠50 mg 脊髓下段组织,使用试剂盒提取总蛋白。 蛋白样本经变性并调整浓度后,在WES 仪器上检测 IL-1β 和 Caspase-1 的表达水平,以GAPDH 作为内参蛋白。 通过 ProteinSimple 软件(版本2.7.1)进行可视化分析,并计算蛋白质的相对表达量。
1.3 统计学分析
采用SPSS 22.0 软件进行单因素方差分析与t检测,所有数据使用平均值± 标准差( ¯x ±s)表示,P<0.05为差异具有显著性。
2 结果
2.1 自发性后肢瘫痪WSHc 大鼠的发生率和一般体征
首次发现的一只后肢瘫痪雌性WSHc 大鼠种鼠(F0 代)所生 25 个后代中(F1 代,14♀,11♂),有 7只出现步态不稳的(4♀,3♂),发病率为28%。 将两对步态不稳的雌雄大鼠进行近亲交配,所生的26 个后代(F2 代,15♀,11♂)中,有 18 只出现步态不稳(10♀,8♂),发病率为69.2%。 这18 只大鼠中雌雄各取4 只进行病理学研究,剩余动物用于继续繁殖。
步态不稳的大鼠均表现为进行性后肢瘫痪。7 ~10周龄时,大鼠出现后肢支撑力不足,行动速度下降,16 ~20 周时发展为后肢无力,仅可借助前肢爬行,前肢和头部活动良好,采食与饮水不受影响,可长时间存活,大体情况见图1。
如表1 所示,无论是否瘫痪,雌性WSHc 大鼠经高脂饲料诱导后,血清TC 含量均显著提高(P <0.01),而雄性WSHc 大鼠经高脂诱导后血清TC 含量有上升趋势,但差异不具有显著性(P>0.05)。与非后肢瘫痪WSHc 大鼠相比,后肢瘫痪WSHc 大鼠血脂差异不具有显著性(P>0.05)。
2.2 自发性后肢瘫痪WSHc 大鼠脑磁共振成像
非后肢瘫痪的大鼠与后肢瘫痪的大鼠颅脑的图像能均清楚区分大脑、中脑、桥脑、小脑和上段颈髓等解剖结构。 在T2WI 上,大鼠脑组织的灰质与白质之间具有一定的对比度,高度髓鞘化的白质表现为低信号(黑色),脑室和脑池表现为高信号(白色),大脑新皮质、丘脑、海马、基底节等灰质结构呈灰色,均未见显著形态学差异。 (见图2)

图1 非后肢瘫痪的大鼠与后肢瘫痪的大鼠大体观察Figure 1 Gross observation of rats without hindlimb paralysis (NLP) and rats with hindlimb paralysis (LP)

表1 各组大鼠不同饲料饲喂4 周后血清TC 的变化(mmol/L)Table 1 Changes of serum TC in rats fed with different diets for 4 weeks(mmol/L)

图2 非后肢瘫痪的大鼠与后肢瘫痪的大鼠脑磁共振成像Figure 2 Brain magnetic resonance imaging (MRI) of rats without hindlimb paralysis and rats with hindlimb paralysis
2.3 自发性后肢瘫痪WSHc 大鼠小脑与脊髓一般病理学变化
非后肢瘫痪大鼠小脑、脊髓上、中、下段以及后肢瘫痪大鼠的小脑、脊髓上段均未见炎症细胞细胞浸润,未见组织水肿、出血、坏死等异常状态。 后肢瘫痪大鼠脊髓中段和下段可见大量空泡形成;神经元细胞排列松散,形态改变,出现核固缩与核左移;可见大量炎症细胞浸润,尤其与脊髓下段更为严重。 (见图3)
2.4 自发性后肢瘫痪WSHc 大鼠小脑与脊髓细胞凋亡情况
非后肢瘫痪大鼠大鼠小脑、脊髓上、中、下段以及后肢瘫痪大鼠的小脑、脊髓上段褐色阳性着色较少,而瘫痪大鼠脊髓中段和下段可见大量阳性染色,神经元细胞大量凋亡,经定量分析后可见,瘫痪大鼠脊髓中段和下段细胞凋亡比例显著上升(P<0.05)。 (见图 4)
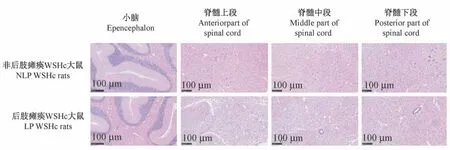
图3 非后肢瘫痪大鼠与后肢瘫痪大鼠小脑与脊髓HE 染色结果Figure 3 HE staining results of cerebellum and spinal cord of rats without hindlimb paralysis and rats with hindlimb paralysis
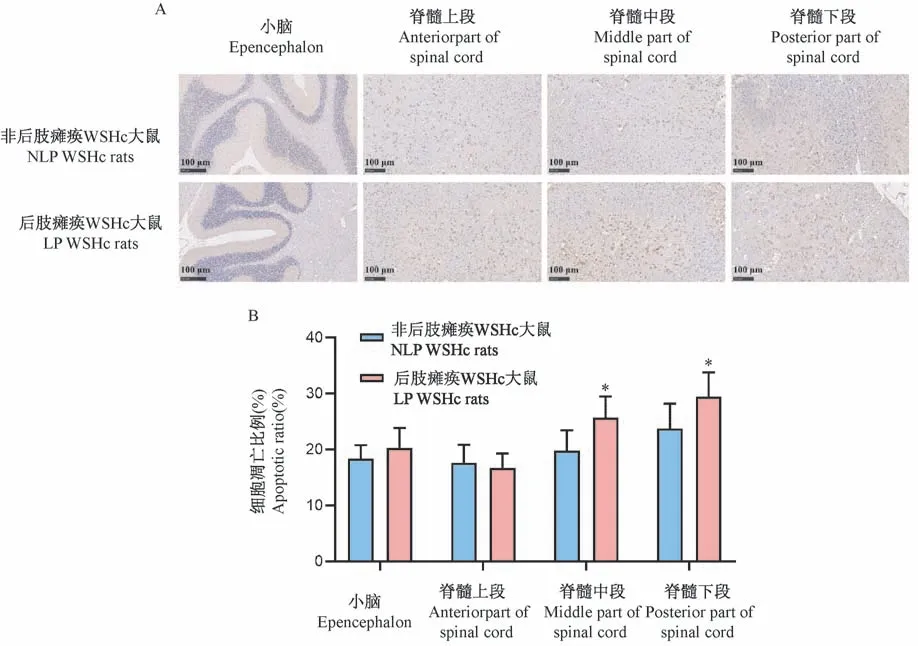
注:A:非后肢瘫痪大鼠与后肢瘫痪大鼠小脑与脊髓TUNEL 染色结果;B:大鼠不同部位细胞凋亡比例。 与非后肢瘫痪大鼠比较,*P <0.05。图4 非后肢瘫痪大鼠与后肢瘫痪大鼠小脑与脊髓细胞凋亡情况Note. A, TUNEL staining results of cerebellum and spinal cord of rats without hindlimb paralysis and rats with hindlimb paralysis. B, Proportion of apoptosis in different parts of rats. Compared with NLP WSHc rats, *P <0.05.Figure 4 Apoptosis of cerebellum and spinal cord of rats without hindlimb paralysis and rats with hindlimb paralysis
2.5 自发性后肢瘫痪 WSHc 大鼠小脑与脊髓Caspase-1 相关基因与蛋白的表达
对不同部位的中枢神经系统进行炎症相关基因表达差异进行研究。 RT-PCR 检测发现,与非后肢瘫痪的WSHc 大鼠比较,后肢瘫痪大鼠脊髓中、下段 Caspase-1 和 IL-1β 的 mRNA 水平显著升高(P < 0. 05,P < 0. 01),而 小 脑和脊髓上段Caspase-1 和 IL-1β 的 mRNA 水平差异不具有显著性(P>0. 05)。 进一步取脊髓后段组织进行蛋白水平的验证,发现Pro-Caspase-1 表达差异不具有显著性(P>0. 05),而后肢瘫痪大鼠脊髓后段的Cleaved-Caspase-1 蛋白表达显著上升(P <0. 05),且下游产物 IL-1β 表达亦显著上升(P <0. 05)。 (见图 5)
3 讨论
MND 是由额叶中央前回的上运动神经元和脊髓前角的下运动神经元功能障碍引起的自发性疾病。 通常情况下,自发性MND 会引起肌无力,一般无感觉障碍和括约肌障碍。 最常见的MND 是肌萎缩性脊髓侧索硬化症,占MND 的85%,其他运动神经元疾病包括遗传性痉挛性麻痹、脊髓灰质炎等[6]。 目前该疾病的病因不明,尚无有效的治疗手段,而疾病动物模型是研究疾病发病机制和药物治疗的关键环节,因此,寻找与人类疾病类似的动物模型至关重要。
目前用于研究MND 的疾病模型种类较多,包括神经元细胞、离体脊髓组织、线虫、果蝇和斑马鱼和啮齿目动物等,以大小鼠为最常用的动物模型。大小鼠MND 模型中又包括轴突断离术、毒性药物造模、转基因动物模型和自发性动物模型[7-8]。 轴突断离术和药物毒性的模型呈急性发病,病程短,且损伤不限于运动系统,与MND 的神经系统慢性进展性不符,因此在科学应用中有很大的限制[8]。国外有多个自发性MND 小鼠模型的报道,如MND小鼠、Wobble 小鼠及Wasted 小鼠等,这些小鼠的病理特点与人类MND 接近,但这些报道年代久远,且未见更多的深入机制研究和应用报道,国内也未见有学者利用,可能目前已无法获得[9-10]。 目前应用最多的则是转基因小鼠模型,如SOD1 基因突变小鼠、ALSIN 基因敲除小鼠等,但MND 病因复杂,单个基因的变异不能全面的反映病因。 因此,现有的动物模型均存在一定的局限性,需进一步研发新的疾病模型,从而更全面的解释病因和寻找治疗手段。

注:A:大鼠不同部位Caspase-1 mRNA 相对表达量;B:大鼠不同部位IL-1β mRNA 相对表达量。 C: 非后肢瘫痪大鼠与后肢瘫痪大鼠脊髓下段蛋白相对表达量;D:非后肢瘫痪大鼠与后肢瘫痪大鼠脊髓下段蛋白条带。 与非后肢瘫痪大鼠比较,*P <0.05,**P <0.01。图5 非后肢瘫痪大鼠与后肢瘫痪大鼠小脑与脊髓Caspase-1 相关基因的表达Note. A, Relative expression of Caspase-1 mRNA in different parts of rats. B, Relative expression of IL-1β mRNA in different parts of rats. C, Relative expression levels of proteins in the posterior spinal cord of non-paraplegic rats and paraplegic rats. D, Protein bands in posterior spinal cord of nonparaplegic rats and paraplegic rats. Compared with NLP WSHc rats,*P < 0.05,**P < 0.01.Figure 5 Expression of Caspase-1 related genes in cerebellum and spinal cord of rats without hindlimb paralysis and rats with hindlimb paralysis
WSHc 大鼠是本动物实验研究中心目前自主培育并研究的一个大鼠新品系,来源于本课题组偶然发现的一只Wistar 大鼠。 该大鼠经高脂饲料诱导后,血清TC 水平达20 mmol/L 以上,将该血脂异常的Wistar 大鼠与SD 大鼠杂交后进行保种传代,经过多年来不断筛选高脂血症易感的大鼠,目前已形成一定规模的封闭群,雌性大鼠经高脂诱导后,TC高于5.0 mmol/L 的占90%以上,并能长期保持高血脂状态[1]。 近来本实验中心发现有一个支系的WSHc 大鼠成年后会出现可遗传的自发性后肢瘫痪,雌雄均可发病。 起初表现为步态不稳,进行性地发展为后肢完全丧失活动能力,但头部和前肢活动力不受影响,可长时间存活。 这种自发性的后肢瘫痪症状与人类的MND 相似,但具体的病变部位尚不清楚,因此需要对不同节段的中枢神经进行观察,才能进一步确定该大鼠模型的病因和研究价值。 值得一提的是,本实验中,后肢瘫痪的WSHc 大鼠与非后肢瘫痪的WSHc 大鼠高脂血症的易感性一致,且无论是否给与高脂饲料诱导,均有一定的概率发生后肢瘫痪,提示该性状与高脂血症易感性状相对独立;WSHc 大鼠高脂血症性状为伴性遗传,目前仅在雌性大鼠中可见,而后肢瘫痪的性状雌雄均可发病,提示该性状可能为常染色体遗传,更确切的遗传模式需要更多的遗传学实验来揭示。
通过影像学与病理学研究发现,后肢瘫痪的WSHc 大鼠大脑、小脑和脊髓上段未见明显病变,而自脊髓中段开始至脊髓后段均出现较为严重的病变,如神经纤维空泡、神经元细胞核左移和核固缩,且伴随炎性细胞浸润,提示神经细胞的程序性死亡和脊髓的炎症反应参与了后肢瘫痪的WSHc 大鼠主要致病因素。 通过TUNEL 免疫组化试验我们发现,后肢瘫痪大鼠脊髓中段和和脊髓下段神经细胞凋亡程度显著升高,而小脑和脊髓上段未见明显改变,进一步证实了病变部位主要存在于脊髓中后段,并提示可能是脊髓中的炎症反应导致神经细胞凋亡。
目前MND 可能的发病机制有多种学说,主要有(1)RNA 结合蛋白核质转运已经RNA 代谢的改变;(2)细胞自噬减少导致蛋白酶系统稳态失衡;(3)线粒体功能障碍和氧化应激;(4)星形胶质细胞激活,产生有毒性的炎症因子等[11-14]。 该大鼠疾病模型目前观察到的病变特征主要为炎症细胞浸润和神经细胞空泡,因此作者推测,该大鼠可能是中后段的脊髓组织中免疫炎症细胞激活,产生的炎症因子进一步损伤神经原细胞和脊髓前角细胞。 文献报道可见,MND 疾病中常见炎症细胞的异常活化和 IL-1β 的释放,而 IL-1β 的释放与 Caspase-1 密切相关[15-16]。 Caspase-1 是炎症小体复合物中有一个重要的蛋白组件,平时以无活性的酶原形式(Pro-Caspase-1)存在,当受到刺激时 Pro-Caspase-1 发生水解,经过一系列的反应,最终形成有活性的裂解Caspase-1(Cleaved Caspase-1)[17]。 活化的Caspase-1能够对IL-1β 前体进行切割,形成具有活性的IL-1β并释放,从而引起机体的炎症反应[18]。 与此同时,Caspase-1 能直接作用于细胞生存相关的重要蛋白,具有促凋亡的作用[19-20]。 本实验研究发现,与非后肢瘫痪的大鼠比较,在后肢瘫痪大鼠小脑和脊髓前段Caspase-1 与IL-1β 基因表达水平未见显著变化,而瘫痪大鼠脊髓中后段,Caspase-1 与IL-1β 基因表达水平均显著升高,蛋白定量分析结果进一步显示,瘫痪大鼠脊髓后段中激活的Caspase-1 和成熟的IL-1β 蛋白水平也显著增高,这与病理组织学结果相一致,提示WSHc 大鼠后肢瘫痪的病理机制可能是由于脊髓中后段的神经元细胞Caspase-1 过度激活,引起机体炎症和细胞凋亡,从而形成自发性进行性后肢瘫痪。 该自发性后肢瘫痪大鼠模型的发病机制可能不仅限于此,而更确切的病因需要更进一步的实验加以验证。
综上所述,高脂血症易感WSHc 大鼠自发性后肢瘫痪为进行性病变,由早期的步态不稳发展到后期的后肢瘫痪,其发病部位位于脊髓中后段,病理特征为炎症细胞浸润和神经元细胞变性凋亡,其发病机制可能与Caspase-1 过度激活有关。

