小鼠及猕猴Graves 病动物模型的比较研究
王悦,张萌,赵凤仪,伍丽萍,施秉银
(西安交通大学第一附属医院内分泌代谢科,西安 710061)
Graves 病(Graves’disease,GD)是一种常见的器官特异性自身免疫性疾病,人群患病率0.5% ~2%[1]。 临床表现主要有甲状腺毒症、弥漫性甲状腺肿大,部分伴有突眼或胫前粘液性水肿。 严重时可导致病人发生重度心律失常、重度肝损害、重度肌萎缩及重度贫血等[2]。 在动物活体水平建立真实反应人类疾病的疾病模型,对疾病发病机制探讨、在体功能研究、药物新靶点发现和临床前药效学评价至关重要[3]。
近年来,国内外研究者对于GD 的疾病模型展开了诸多探索。 稳定表达促甲状腺素受体(TSHR)的细胞在免疫佐剂的帮助下,能诱导小鼠产生促甲状腺素受体抗体(TRAb)升高、甲状腺毒症及甲状腺病理等GD 相关表现,但其操作的可能性较差且诱导成功率不稳定[4]。 此后,研究者们更换了抗原的表达载体,发现表达TSHR 全长的重组腺病毒可以获得甲亢发生率为 30% ~ 50%的 BALB/c 小鼠[5]。 随着“TSHR A 亚单位可能是 GD 发生的主要抗原”这一发病机制的重大发现,研究者们利用表达TSHR A 亚单位的重组腺病毒将甲亢的发生率提高至60% ~80%[6-8]。 虽然近期有自发产生促甲状素受体刺激性抗体(TSAb)的TSHR/NOD.H2h4转基因小鼠动物模型的相关报道,但该小鼠甲状腺激素水平正常,没有甲状腺功能亢进症状,分析原因认为该抗体是针对人TSHR 的,因此与小鼠体内TSHR 结合比较微弱[9]。 因此,利用表达 TSHR A亚单位的腺病毒免疫诱导模型是目前最为广泛接受的GD 小鼠模型[4]。
但由于啮齿类动物与人类遗传背景、免疫学、病理学特征上存在较大差异,Graves 病的一些典型临床表现难以在小鼠模型中成功再现,且医药转化研究中,啮齿类动物模型也存在着不可忽视的局限性[10]。 为了突破啮齿类动物模型在免疫学研究中的局限性,非人灵长类动物在免疫学研究中发挥越来越重要的作用。 其中,猕猴模型作为最常见的非人灵长类动物模型,已经广泛应用于包括感染免疫,免疫应答,免疫衰老及自身免疫性疾病的研究领域中。 系统性红斑狼疮和类风湿性关节炎的相关模型已经被陆续报道,给构建猕猴的GD 动物模型提供了可能性和宝贵的经验[10]。
本研究旨在从GD 发病机制出发,通过比较我们既往研究中小鼠及猕猴GD 动物模型[11-12],一方面探讨不同动物GD 模型特点差异,另一方面基于不同动物模型的特点,为日后免疫治疗新方法提供研究工具。
1 材料与方法
1.1 材料
1.1.1 实验动物
16 只 6 周龄 SPF 级雌性 BALB/c 小鼠,体重约18 ~20 g,购自西安交通大学医学实验动物实验中心【SCXK(陕)2018-001】,饲养于西安交通大学医学实验动物中心【SYXK(陕)2015-002】,所有操作均符合西安交通大学医学部生物科研伦理要求(审批号:IACUC 2015036)。
12 只3 周岁普通级雌性猕猴,体重约3.8 ~4.0 kg,购于中国科学院昆明动物研究所【SCXK(滇)2017-0003】,饲养于空军医科大学实验动物中心【SYXK(陕)2019-001】。 单笼饲养,饲养室温度控制在24 ~26℃,相对湿度控制于40% ~60%,自由活动。 所有操作均符合陕西省林业厅生物科研伦理要求(审批号:IACUC 2011065)。 整体实验过程符合3R 原则。
1.1.2 试剂与仪器
表达TSHR A 亚单位的重组腺病毒(A-sub-Ad)(深圳市百恩维生物科技有限公司,S2AD1005-1),对照病毒(con-Ad)(深圳市百恩维生物科技有限公司,P8V0034-2),碘[125I]- 甲状腺素放射免疫分析药盒(天津市协和医药科技集团有限公司,RA10102),TRAb 滴度ELISA 法检测(德国Medipan GmbH,3505),Treg 细胞检测试剂盒(eBiosciences,A42925)。
正置光学显微镜(Olympus,BX53,日本),流式细胞仪(BD,FACSCalibur,美国)。
1.2 方法
1.2.1 动物分组及诱导GD 动物模型
小鼠随机分为造模组和对照组,采取国际公认的腺病毒造模方案[5-6],造模组用表达TSHR A 亚单位的重组腺病毒进行免疫(A-sub-Ad),对照组用对照病毒进行免疫(con-Ad)。 小鼠造模组用PBS稀释病毒原液,取50 μL 病毒稀释液经股四头肌肌肉注射。 每只小鼠每次注射剂量为1 × 108vp,每三周免疫1 次,共3 次,于末次免疫后四周安乐死小鼠。 猕猴随机分为造模组和对照组,造模组用PBS稀释病毒原液,取1 mL 病毒稀释液经两侧股四头肌肌肉注射,每侧500 μL。 猕猴组的病毒用量是基于小鼠剂量通过体重和体表面积换算出的,每三周注射1 次,共5 次,于末次免疫后四周安乐死猕猴。 取小鼠和猕猴的外周血、甲状腺、脾等组织测定T4、TRAb 及免疫学相关指标。
1.2.2 甲状腺激素、TRAb 测定
血清总甲状腺素TT4 水平由放射免疫法检测:含T4 的血清和125I 标记的T4 与相应的抗体反应后形成抗原抗体复合物。 加入二抗和聚乙二醇,使免疫复合物沉淀并离心,使用γ 计数器测定沉淀物放射性强度。 最后通过标准曲线得到血清中T4 最终浓度。
TRAb 滴度ELISA 法检测:含 TRAb 的血清加入包被着TSHR 蛋白的ELISA 板进行孵育,随后加入M22 单克隆抗体与TRAb 竞争性结合TSHR。 加入二抗和辣根过氧化物酶,用四甲基联苯胺进行显色,使用酶标仪测定其OD 值。 最后通过标准曲线得到血清中TRAb 最终浓度。
1.2.3 甲状腺病理
甲状腺组织用10%甲醛固定,石蜡包埋切片,HE 染色,光镜下观察其组织病理学改变。
1.2.4 流式细胞测定
使用流式染色缓冲液将脾或外周血单个核细胞重悬至每毫升5 × 106个。 Treg 细胞染色按照商品说明书进行,首先使用FITC 标记的CD4 和APC标记的CD25 进行表面染色,固定破膜后使用PE 标记的Foxp3 进行核内染色。 最后使用多通道流式细胞仪进行检测,Cell Quest 软件进行数据分析。
1.3 统计学分析
使用SPSS 24.0 软件进行统计学检验。 计量资料数据形式为平均值± 标准误( ¯x ± s¯x)。 两组间比较采用独立样本t 检验,检验标准以P<0.05 表示差异具有显著性。
2 结果
2.1 GD 小鼠及GD 猕猴体重变化
对照组和造模组小鼠体重平均值分别从(20.9± 0.7)g 和(19.7 ± 0.6)g,增长为(26.5 ± 0.9)g和(26.6 ± 0.4)g,至整个实验结束,两组体重差异无显著性(图1A)。 而在整个实验过程中,对照组猕猴体重由(3.9 ± 0.2)kg 增长至(4.0 ± 0.3)kg。而造模组中甲亢猕猴(3/6)体重从(3.9 ± 0.05)kg下降至(3.6 ± 0.2)kg(P < 0.05)。 与 GD 小鼠体重前后无统计学差异不同,GD 猕猴体重显著下降,这说明GD 猕猴出现了消瘦的临床表现(图1B)。从图1C 可以看出,GD 小鼠至造模结束时,单位摄食量下的体重增加显著低于对照组[(1.1 ± 0.01)vs(1.5 ± 0.05),P < 0.05],该结果说明与对照小鼠相比,造模组小鼠摄入相同重量饲料,但其体重增长显著低于对照小鼠。 这可能是由于小鼠自身体重过轻,摄食量可以显著影响体重的变化。 图1D所示,对照组猕猴静息心率维持在190 次/分左右,未出现明显的波动。 而造模组中甲亢猕猴(3/6)静息心率由(192 ± 11)次/分上升至(255 ± 14)次/分(P <0.05),说明GD 猕猴出现类似GD 患者心动过速的表现。
2.2 GD 小鼠及GD 猕猴TT4
造模结束时,对照组和造模组小鼠TT4 平均值分别为(57.1 ± 2.9)μg/dL 和(96.7 ± 13.8)μg/dL,差异具有显著性(P<0.05)。 以对照小鼠TT4平均值 + 2 倍标准差为正常 TT4 上限(63.1 μg/dL),超过该上限判定甲亢。 造模组小鼠甲亢发生率为75%(图2A)。 以对照猕猴血清TT4 平均值 +2 倍标准差为正常上限(5.72 μg/dL),超过该值视为甲亢。 在第3 次免疫结束联周后,造模组6 只猕猴中有1 只猕猴出现了TT4 升高。 而在5 次免疫结束后两周,造模组共3 只猕猴出现了TT4 升高,即甲亢发生率为50%(图2B)。
2.3 GD 小鼠及GD 猕猴TRAb
造模结束时,对照组和造模组小鼠血清TRAb平均值分别为(8.1 ± 0.6)IU/I 和(423.1 ± 61.4)IU/I,差异具有显著性(P < 0.05)。 以对照小鼠TRAb 平均值 + 2 倍标准差为正常TRAb 上限(9.3 IU/I),造模组小鼠TRAb 阳性率达100%(图3A)。以对照猕猴血清TRAb 的平均值 + 2 倍标准差为正常上限,ELISA 法大于0.06 IU/L 为阳性,5 次免疫结束后,造模组6 只猕猴TRAb 100%阳性(图3B)。
2.4 GD 小鼠及GD 猕猴甲状腺病理
光镜下,对照小鼠或猕猴甲状腺滤泡上皮细胞呈低立方或者扁平状,滤泡中中胶质丰富。 造模组中6/8 只小鼠,3/6 只猕猴出现明显的滤泡上皮增生呈立方状或高柱状,部分视野下还可观察到由于增生导致的乳头状结构凸入滤泡腔。 但小鼠及猕猴均未观察到淋巴细胞浸润。 (图4)
2.5 GD 小鼠及 GD 猕猴 Treg 细胞比例
与对照组小鼠相比(12.2 ± 0.5)%,造模组小鼠脾中CD4+CD25+Foxp3+Treg 细胞在CD4+T 淋巴细胞中的比例显著降低(10.3 ± 0.6)%(图5A,P<0.05)。 在外周血和脾,造模组猕猴 CD4+CD25+FOXP 3+Treg 细胞在CD4+细胞中的比例分别是(0.9 ± 0.3)% 和(0.6 ± 0.2)%,显著低于对照组的(1.3 ± 0.1)% 和 (2.3 ± 0.5)%(图 5B,P <0.05)。 但CD4+IL-17+ Th17 细胞在造模猕猴和对照猕猴中差异无显著性(图5B,P>0.05)。

图1 GD 小鼠及GD 猕猴的体重变化Figure 1 Body weight changes in GD mice and GD rhesus monkeys
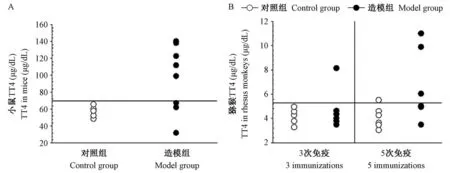
图2 GD 小鼠及GD 猕猴TT4Figure 2 TT4 levels of GD mice and GD rhesus monkeys

图3 GD 小鼠及GD 猕猴TRAbFigure 3 TRAb levels of GD mice and GD rhesus monkeys
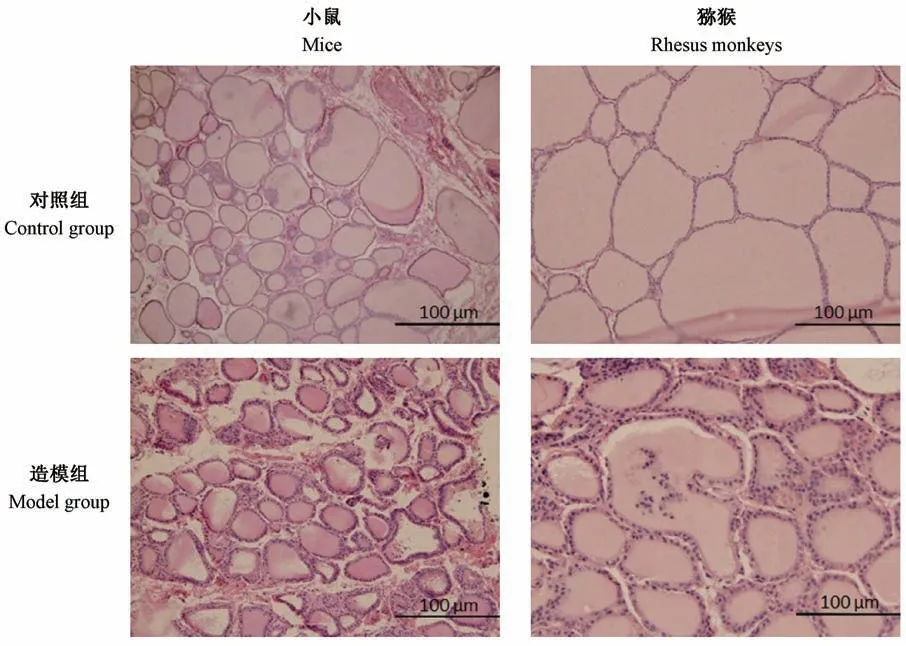
图4 GD 小鼠及GD 猕猴甲状腺病理切片Figure 4 Pathological sections of thyroid gland of GD mice and GD rhesus monkeys
2.6 GD 小鼠及GD 猕猴肝病理
GD 小鼠和猕猴身体机能处于稳定状态。 造模组与对照组小鼠、猕猴的肝在光镜下未发现炎症或其他病理学改变,包括细胞水肿或坏死等。 (图6)
3 讨论
理想的GD 动物模型有以下特点:(1)自发模型优于诱导的模型。 但目前唯一的自发模型TSHR/NOD.H2h4 转基因小鼠产生TSAb 周期较长,花费较高,因此不方便广泛推广使用。 (2)可复制性。 表达TSHR 的质粒诱导的GD 模型目前在世界多个实验室可重复性较低[5]。 (3)GD 发病率高,便于观察病因及协助新治疗。 (4)在多品系小鼠中可诱导GD 发生。 Shimojo 和M12 模型都只能在易感品系诱导GD。 综合以上四点,表达TSHR A 亚单位的腺病毒诱导GD 模型是目前被广泛认可,且重复性最好的模型[13]。
3.1 小鼠及猕猴GD 模型的成功构建
本研究中,通过注射表达TSHR A 亚单位的重组腺病毒,猕猴造模组(注射5 次)和小鼠造模组(注射3 次)均出现了TRAb 阳性,甲状腺激素水平升高和甲状腺组织显著增生等表现。 此外,猕猴造模组还出现了体重下降和静息心率增高等典型GD的临床症状,小鼠造模组也出现了单位摄食量下的体重增加显著下降。

图5 GD 小鼠及GD 猕猴Treg 细胞比例Figure 5 Proportion of Treg cells in GD mice and GD rhesus monkeys

图6 GD 小鼠及GD 猕猴肝病理切片Figure 6 Liver pathological sections of GD mice and GD rhesus monkeys
值得注意的是,猕猴造模组的GD 发生率是随着注射次数等增加逐渐增高的,在第3 次免疫结束时,猕猴造模组的TT4 升高率仅为16.7%,但是在第5 次免疫结束时,猕猴造模组的TT4 升高率达到了50%。 我们未公布的数据显示,继续免疫下去,TT4 升高率会继续增高。 这一结果间接证明了TSHR 是诱发GD 最有力的抗原也说明在建立猕猴GD 模型时,为了获得更高的GD 发病率,可能需要延长免疫时间和增加免疫次数。
3.2 GD 模型与Treg 细胞的关系
Treg 细胞是一类以免疫抑制功能为特点的T淋巴细胞亚群[14]。 作为重要的免疫调节细胞,其在自身免疫性疾病的发病过程中起着核心的作用[15]。叉头盒蛋白3(fork head box P3,Foxp3)是Treg 细胞发育和功能的重要调节因子[16]。 本研究中,小鼠GD 模型与猕猴 GD 模型均展现了 CD4+CD25+Foxp3+的Treg 细胞比例的显著降低,这一结果与之前报道的GD 临床实验结果一致[17-19]。 这一现象再次佐证了Treg 细胞可能与GD 发病有关,而这两个动物模型都是未来研究Treg 细胞与GD 的发病关系和针对Treg 细胞免疫疗法的良好工具。
3.3 小鼠及猕猴GD 模型的比较
造模结束时,猕猴造模组的6 只小鼠中有3 只出现了以上的现象(50%),而小鼠造模组的8 只小鼠中有6 只小鼠出现了以上的现象(75%),与报道的数据相符合[6-7]。 因此,小鼠造模组的GD 发病率略高于猕猴组,但没有显著的统计学差异。 但在相同注射次数(三次注射)下,猕猴造模组的GD 发病率(16.7%)是显著低于小鼠造模组的(P<0.05)。这说明在相同的免疫时间和次数的情况下,小鼠GD 模型的发病率更高。
与小鼠GD 模型相比,猕猴GD 模型会出现显著的与人类GD 患者类似的临床表现,包括体重显著降低和静息心率的增加[20-21]。 另外,对比小鼠及猕猴的TT4、TRAb 水平的数据可以看出,小鼠TT4、TRAb 水平均显著高于猕猴,这也可能是因为种属不同而造成的生化差异,其中猕猴与人类的数据更为接近[22-24]。
本研究中,在小鼠和猕猴模型造模时使用均为表达人TSHRA 的腺病毒。 事实上,在氨基酸水平上,人类和小鼠TSHRs 的同源性约为87%,而人类与猕猴TSHRs 的同源性高达97%。 有研究证实,在流式细胞术检测小鼠TSHR 时,人a 亚基免疫诱导的抗体的交叉反应性较差[25]。 从造模机制的层面,GD 及并发症尤其是甲状腺功能亢进性心脏病(甲亢心),其发病机制是靶器官分布的TSHR 受体与自身抗体的结合启动下游的反应导致,我们有理由推测,猕猴GD 模型在复制人类GD 及其并发症中更具备说服力。
从模型的应用来看,小鼠GD 模型具备造模时间教短、场地要求不高及实验成本较低的优势,但对于更加深入的研究GD 的发病机制、尤其是并发症的发病机制等还是有着不小的限制性。 而猕猴GD 模型从发病机制、临床表现、并发症层面及与人类GD 患者更加相似,尤其为GD 的并发症的研究提供了切实可行的有效途径及方案,随着大动物价格昂贵、饲养成本高、难以进行规模化等问题的逐渐被解决,其研究前景和应用前景将极为广阔[10]。
综上所述,小鼠模型的GD 发生率略高于猕猴模型,但是经过对基础生理生化指标和免疫相关指标的检测,GD 猕猴显示出更多的与人类GD 患者类似的表现及机制。 因此,我们应当根据实验需求及经费安排,选择适当的动物模型,从而更合理的完成预期目标。

