清肺透邪汤介导NLRP3 炎性小体抑制NF-κB 信号通路改善肺炎支原体小鼠炎性反应
王子,王雪峰,吴振起
(1. 辽宁中医药大学研究生学院,沈阳 110847; 2. 辽宁中医药大学附属医院,沈阳 110032)
肺炎支原体(mycoplasma pneumoniae,MP)是一种常见的可以引发儿童及青少年肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)的病原体,该病多在秋冬季节流行,患儿除具有肺部病征外,重者还可出现多器官损害,严重影响了儿童的健康。 目前MPP 发病机制尚不完全清楚,但普遍认为与机体免疫功能异常有关[1]。 核苷酸结合寡聚化结构域样受体3(NLRP3)炎性小体和核转录因子-κB(NF-κB)信号通路是诱发炎症反应的重要通路。 有研究表明,肺炎支原体可被NLRP3 识别,触发机体固有免疫应答,诱发炎症反应,从而参与MPP 的发生与发展[2]。
近年来,MPP 发病率不断升高,同时肺炎支原体对大环内酯类抗生素耐药性的不断扩大导致了难治性MPP 的比例也逐渐升高。 随着中医药的不断发展,传统中医药治疗儿童肺炎支原体肺炎的优势逐步显现,有研究表明,应用中药方剂可以明显减轻临床症状并增强机体免疫力,以防复发,其即使长期服用中药制剂也无明显不良反应[3]。 清肺透邪汤是临床治疗肺炎支原体肺炎及病毒性肺炎的常用中药制剂,由炙桑白皮、黄芩、石膏、麻黄、麦冬、虎杖、苏子、杏仁、桔梗组成,具有清热化痰止咳之功效[4]。 本实验室前期研究表明清肺透邪汤可以明显抑制MPP 小鼠的炎症反应,但是其作用机制尚未报道[5]。 因此,本研究旨在通过建立MPP 小鼠模型,观察清肺透邪汤对其治疗作用,并且从NLRP3 炎性小体和NF-κB 信号通路方面探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
8 周龄雄性 SPF 级 BALB/c 小鼠 40 只,体重(20 ± 2)g,购于辽宁长生生物有限公司【SCXK(辽)2015-0001】,实验在辽宁中医药大学实验动物中心屏障系统内进行【SYXK(辽)2019-0004】。 所有本研究中使用的实验方案由辽宁中医药大学动物管理委员会及动物福利伦理委员会批准,严格按照3R 原则进行动物饲养及实验, 项目批准号: 201711。
1.1.2 菌株
MP 标准株FH 来自辽宁中医药大学附属医院病毒实验室,由辽宁中医药大学附属医院儿科吴振起教授惠赠。 将冻存的MP 接种至液体培养基中,在37℃含5%CO2饱和氮的厌氧培养箱中孵育。 当培养液由红变黄时进行连续传代,取第3 代MP 菌液备用。 以培养基由红色转变为黄色时的最高稀释浓度作为颜色改变单位(color change unite,CCU),采用 CCU/mL 方法测定 MP 浓度,取 MP 菌液浓度 1×107CCU/mL 备用。
1.1.3 清肺透邪汤
清肺透邪汤由炙桑白皮9 g、黄芩9 g、石膏12 g、麻黄 6 g、麦冬 9 g、虎杖 9 g、苏子 9 g、杏仁 6 g、桔梗9 g 组成,中药由辽宁中医药大学附属医院门诊中草药局提供,经辽宁中医药大学中药分析教研室李峰教授鉴定为正品,辽宁中医药大学附属医院制剂室加工制成含生药2 g/mL 的浓缩液,用于后续实验。
1.1.4 试剂与仪器
IL-1β (批 号: 19010847 M)、 TNF-α ( 批 号:19010880 M)、IL-6(批号:19010890 M)、IL-18(批号:19010896 M)ELISA 试剂盒购自上海酶联生物科技有限公司;HiScriptQ RT SuperMix for qPCR(批号:7E272CB) 和 HieffTMqPCR SYBR® Green Master Mix(批号:7E380A9)购自诺唯赞生物科技有限公司;NLRP3、MyD88、NF-κB 和 β-actin 引物由上海生工生物有限公司合成;NLRP3(19771 - 1-AP)、MyD88(23230-1-AP)、p-NF-κB(14220-1-AP)和 βactin(66009-1-AP)抗体购自武汉三鹰生物技术有限公司。
倒置荧光生物显微镜(NIB-100F,宁波永新光学股份有限公司), qPCR 仪(QuantStudioTM3,Thermo scientific 公司),酶标仪(Mr-96 A,深圳迈瑞生物医疗电子股份有限公司),Western Blot 电泳槽与转膜仪(美国Bio-rad 公司),凝胶成像系统(Gene Genius,UVP,上海天能科技有限公司)。
1.2 方法
1.2.1 肺炎支原体感染小鼠模型的建立及分组
按文献报道的方法建立肺炎支原体感染小鼠模型[6],用乙醚将40 只小鼠进行轻度麻醉,用1 mL 注射器缓慢向每只小鼠的鼻腔中滴入0. 1 mL 的 MP 菌液(滴度为 1×107CCU/mL),接种后将小鼠呈45°静置 30 s,以利于 MP 菌液的充分吸入并防止小鼠窒息,连续滴鼻 3 d,另取8 只小鼠在同等条件下滴入等量生理盐水作为对照组。接种后观察记录各组小鼠的体重、进食、大便、活动度等情况的变化。 随后将模型制备成功的小鼠随机分为模型组(MPP)、清肺透邪汤低剂量(200 mg/kg)组(QFTXTL)、中剂量组(400 mg/kg) ( QFTXTM)、 高 剂 量 ( 800 mg/kg) 组(QFTXTH),每组8 只。 治疗组的小鼠按照剂量连续灌胃给药2 周,每天1 次,对照组(sham)及模型组给予等体积的蒸馏水。
1.2.2 样本的采集
处死各组小鼠,打开胸腔,用预冷的PBS 对右肺进行支气管肺泡灌洗,回收肺泡灌洗液(BALF)3000 r/min 离心15 min,吸取上清。 随后取出肺组织一部分立即放入4%的多聚甲醛溶液中固定用于制备肺组织切片,另一部分置于液氮中冻存,用于qPCR 及 Western Blot 检测。
1.2.3 MPP 小鼠肺指数计算
处死各组小鼠前称取每只小鼠的体重,处死后冰上快速取出各组小鼠的肺组织,滤纸吸去表面水分后称取肺组织重量。 按下面公式计算肺指数:肺指数 = 肺重/体重 × 100%,得到各组小鼠的肺指数。
1.2.4 HE 染色检测各组小鼠肺组织病理变化
首先将各组小鼠肺切片放入苏木精液中染色5~10 min;蒸馏水洗去染色液,1%盐酸乙醇1 ~3 s,蒸馏水快速洗涤,伊红染色液染色1 ~2 min,依次浸入70%、80%、90%、100%乙醇中10 s,浸入二甲苯中透明5 min 后中性树胶进行封片,显微镜下观察并拍照[7-8]。
1.2.5 TUNEL 法检测各组小鼠肺组织中细胞凋亡情况
各组小鼠肺组织中细胞凋亡的检测严格按照TUNEL 试剂盒说明书进行操作。 将切片置于倒置荧光显微镜下观察,并利用Image J 软件进行计数分析。
1.2.6 ELISA 检测各组小鼠肺泡灌洗液中IL-1β、TNF-α、IL-6、IL-18 的含量
取肺泡灌洗液样品用酶联免疫吸附剂测定法(enzyme-linked immunosorbent assay, ELISA)检测样品中 IL-1β、TNF-α、IL-6、IL-18 水平,严格按照试剂盒说明书进行操作。 于酶标仪在450 nm 波长下检测吸光度值,根据不同浓度标准品的OD 值绘制标准曲线,得到回归方程,根据回归方程计算样品中IL-1β、TNF-α、IL-6 及 IL-18 水平。
1.2.7 qPCR 法检测各组小鼠肺组织中NLRP3、MyD88、NF-κB 的 mRNA 水平
按TRIzol 法提取各组小鼠肺组织RNA,用分光光度计检测各组总RNA 的纯度及纯度;按HiScript II Q Select RT SuperMix for qPCR (+gDNA wiper)所示比例将mRNA 反转录成cDNA,按HiScript II One Step qRT-PCR SYBR Green Kit 所示比例构建qPCR反应,相关引物序列如表1。 反应条件:预变性95℃5 min,变性95℃ 10 s,退火55℃ 30 s,扩增40 个循环。 以 U6 为内参,得到的结果用 2-△△CT表示。

表1 qPCR 引物列表Table 1 qPCR primers
1.2.8 Western Blot 检测
提取各组小鼠肺组织蛋白,12 000 r/min 离心15 min,使用BCA 蛋白定量试剂盒对蛋白进行定量分析,100℃加热10 min 对蛋白进行变性,随后进行SDS-聚丙烯酸胺凝胶电泳,使用PVDF 膜转膜,5%脱脂奶粉封闭液封闭,TBST 洗膜,分别加入β-actin、兔抗 NLRP3、MyD88、p-NF-κB 及 β-actin 一抗(1 ∶1000),4℃孵育过夜,TBST 洗膜,加入相应HRP 标记二抗稀释浓度为 1 ∶1000,室温避光孵育 1 h。TBST 洗膜,ECL 发光试剂盒发光,凝胶成像系统成像,Image J 软件计算灰度值,统计分析目的条带与内参蛋白条带光密度的比值。
1.3 统计学分析
数据采用SPSS 17.0 软件进行分析处理,作图采用Graphpad 5.0 处理。 数据表示为平均值 ± 标准差(),多组间均数的比较采用单因素方差分析,其中两两比较采用LSD-t 法,以P<0.05 作为差异有统计学意义。
2 结果
2.1 清肺透邪汤对MPP 小鼠外观表现及肺指数的影响
对照组小鼠观察期内精神状态良好,皮毛光泽,活动、呼吸及进食情况正常,体质量逐渐增加;而模型组小鼠精神状态变差,皮毛无光泽,活动减少,进食量减少,体质量增长速度减缓;清肺透邪汤治疗后,小鼠精神状态改善,活动量增多,进食量增加,体质量增长速度增加。
对照组小鼠取出的肺组织表面呈淡红色,无病理性瘀斑;模型组小鼠肺组织呈暗红色,表面可见大量的肺实变病灶,看见大量瘀点;而各个剂量清肺透邪汤治疗后的小鼠肺组织的肺实变病灶明显减少。 各组的小鼠肺指数的结果如图1 所示,与对照组相比,模型组小鼠肺指数显著升高(P<0.05);经过不同剂量清肺透邪汤治疗后,MPP 小鼠肺指数显著降低(P<0.05)。
2.2 清肺透邪汤改善MPP 小鼠肺组织病理改变
HE 染色结果如图2 所示,对照组小鼠肺泡结构较为均匀与清晰,肺泡内无渗出,支气管和血管周围及肺泡间隔中偶见淋巴细胞和巨噬细胞浸润。模型小鼠肺组织中可见间质性炎症改变,肺泡内有渗出肺泡间隔增宽,在支气管和血管周围及肺泡间隔有大量的淋巴细胞和巨噬细胞浸润。 而给予不同剂量清肺透邪汤治疗后的MPP 小鼠肺组织炎症反应开始减轻,间质性炎症呈现轻度改变,肺泡间隔稍有增宽,淋巴细胞和巨噬细胞浸润在支气管和血管周围及肺泡间隔的浸润减少。
2.3 清肺透邪汤减少MPP 小鼠肺组织细胞凋亡
如图3 所示,与对照组相比,模型组小鼠肺处细胞凋亡数显著增多(P<0.05);与模型组相比,不同剂量清肺透邪汤治疗组小鼠肺处细胞的凋亡数显著减少(P<0.05),说明清肺透邪汤可以抑制MPP小鼠肺组织中细胞凋亡。
2.4 清肺透邪汤减少MPP 小鼠肺泡灌洗液中IL-1β、TNF-α、IL-6、IL-18 的含量
如图4 所示,与对照组相比,模型组肺泡灌洗液中 IL-1β、TNF-α、IL-6 及 IL-18 含量显著升高(P <0.05);给予清肺透邪汤治疗后的MPP 小鼠肺泡灌洗液中 IL-1β、TNF-α、IL-6 及 IL-18 含量显著降低(P<0.05),说明清肺透邪汤能改善MPP 小鼠肺组织中的炎症反应。

注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。 (下图同)图1 清肺透邪汤对MPP 小鼠肺指数影响Note. Compared with control group,*P<0.05. Compared with MPP group,#P<0.05.(The same in the following Figures)Figure 1 Effects of Qingfei Touxie decoction on lung index in MPP mice

图2 清肺透邪汤对MPP 小鼠肺组织病理改变(HE 染色)Figure 2 Effects of Qingfei Touxie decoction on pathological changes of lung tissue in MPP mice (HE staining)
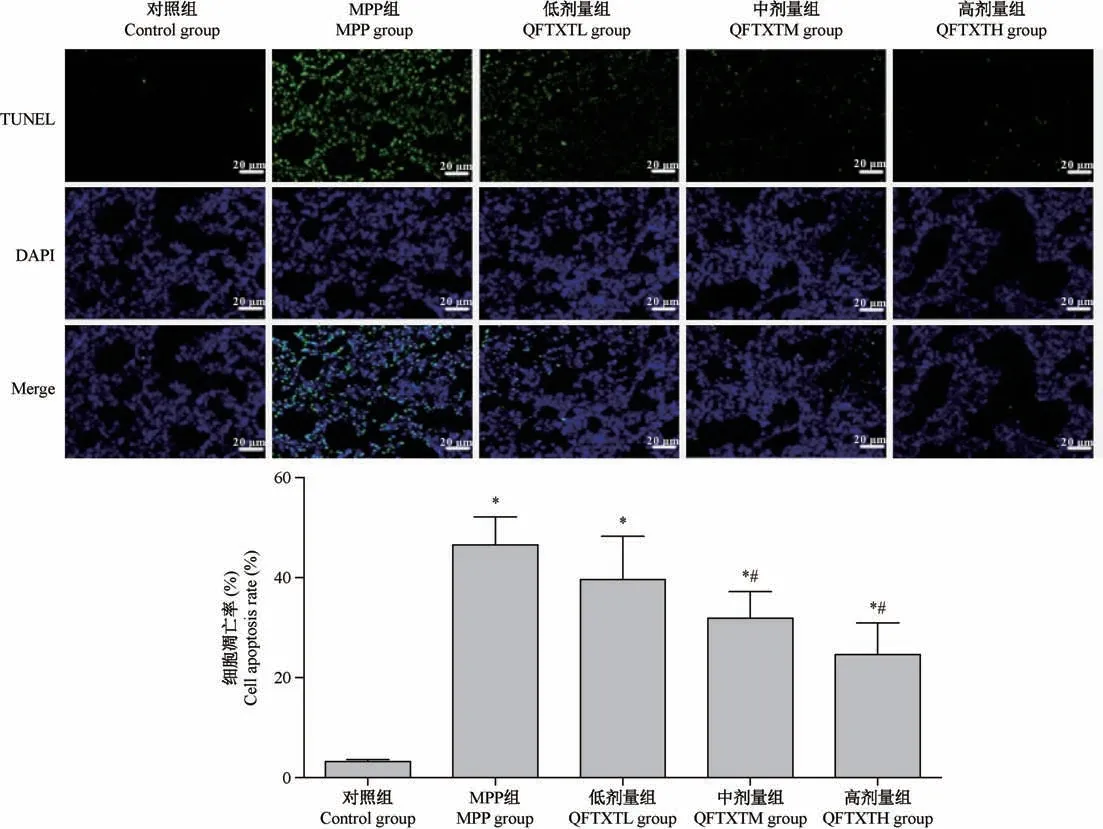
图3 清肺透邪汤减少MPP 小鼠肺组织细胞凋亡影响(TUNEL 染色)Figure 3 Effects of Qingfei Touxie decoction on apoptosis of lung tissue in MPP mice (TUNEL staining)

图4 清肺透邪汤减少MPP 小鼠肺泡灌洗液中炎性因子IL-1β、TNF-α、IL-6、IL-18 的含量Figure 4 Qingfei Touxie decoction reduced the content of inflammatory cytokines IL-1β, TNF-α, IL-6,and IL-18 in bronchoalveolar lavage fluid of MPP mice
2.5 清肺透邪汤减少MPP 小鼠肺组织中NLRP3、MyD88 及 NF-κB 的 mRNA 的表达
为了探讨清肺透邪汤对MPP 小鼠抗炎作用的机制,我们采用了 qPCR 法检测了 NLRP3、MyD88及 NF-κB mRNA 的表达。 结果如图 5 所示,与对照组相比,MPP 小鼠肺组织中 NLRP3、MyD88 及 NF-κB mRNA 水平均显著升高(P<0.05);而经清肺透邪汤治疗后,MPP 小鼠肺组织中 NLRP3、MyD88 及NF-κB mRNA 水平明显降低(P< 0.05)。
2.6 清肺透邪汤减少MPP 小鼠肺组织中NLRP3、MyD88 及 NF-κB 蛋白的表达
如图6 显示,与对照组相比,模型组肺组织中NLRP3、MyD88 及 NF-κB 蛋白的表达显著升高(P<0.05);清肺透邪汤治疗后,肺组织中 NLRP3、MyD88 及NF-κB 蛋白的表达显著降低(P< 0.05),以上结果提示清肺透邪汤对MPP 小鼠的治疗作用可能与抑制NLRP3 炎症小体从而抑制炎症反应有关。
3 讨论
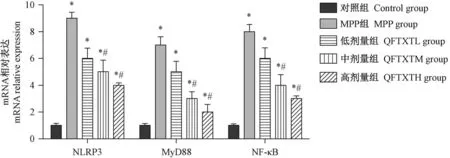
图5 qRT-PCR 检测清肺透邪汤减少MPP 小鼠肺组织NLRP3,MyD88 及NF-κB mRNA 含量Figure 5 Qingfei Touxie decoction reduced NLRP3, MyD88 and NF-κB mRNA content in lung tissue of MPP mice as measured by qRT-PCR

图6 Western Blot 检测清肺透邪汤减少MPP 小鼠肺组织NLRP3,MyD88 及NF-κB 蛋白含量Figure 6 Qingfei Touxie decoction reduced NLRP3, MyD88 and NF-κB mRNA content in lung tissue of MPP mice as measured by Western Blot
MPP 属于中医学“肺炎喘嗽”、“咳嗽”等范畴,归属于温病范畴。 中医药由于其独特的优势在治疗MPP 方面发挥了重要的作用。 本实验室前期已经证实清燥救肺汤可明显抑制肺炎支原体感染小鼠肺部炎症因子的表达及凋亡相关蛋白BcL-2、Bax及Caspase-3的表达[7-8]。传统中医学认为该病由于风温之邪侵袭肺卫,邪气蕴结于内而见邪热蕴肺证;其病机为风温之邪闭阻于肺,则肺失宣肃,肺络受损。 因此提出“风温伏肺”理论,确立清肺透邪之法治疗小儿MPP[9]。 清肺透邪汤具有清肺透邪、宣肺止咳之功效,组方以桑白皮、黄芩、石膏、麻黄为君药,桑白皮泻肺平喘,黄芩清热泻火解毒,石膏配麻黄清热宣肺;麦冬、虎杖为臣药,麦冬润肺止咳,虎杖解毒化痰止咳;杏仁、苏子止咳平喘,为佐药;桔梗宣肺去谈,引诸药上行于肺,为使药。 本研究显示,我们利用鼻腔滴注MP 菌液的方法建立MPP小鼠模型,发现模型组小鼠精神状态不佳,反应迟钝,呼吸频率加快,皮毛无光泽,自主活动减少,进食量减少,体质量增长速度减缓且肺部结构存在明显的病理学改变,表明MP 感染可导致小鼠肺组织结构和功能损伤,说明MPP 小鼠模型制备成功,可用于后续实验。 而且给予不同剂量清肺透邪汤治疗后小鼠肺组织病理损伤明显减轻,肺指数降低,炎症细胞浸润及坏死程度减轻,且细胞凋亡数量明显减少,提示清肺透邪汤能够减轻MP 诱导的肺组织损伤。
致病源过度激活免疫系统,诱导机体释放多种炎症因子,从而造成炎症反应,是MPP 的发病机制之一。 有研究表明,MPP 可诱导炎症因子 IL-1β、TNF-α、IL-6 及 IL-18 等的释放[10]。 先前研究证明了 IL-1β、TNF-α、IL-6 及 IL-18 等炎症因子的表达水平与MPP 的严重程度呈正比,则MPP 越重,炎症因子的水平越高[11]。 本研究结果显示,模型组小鼠BALF 中 IL-1β、TNF-α、IL-6 及 IL-18 含量显著高于对照组,提示MP 菌液可激活机体免疫炎症系统,诱导肺内炎症因子的大量表达并释放,而不同剂量清肺透邪汤治疗后小鼠 BALF 中 IL-1β、TNF-α、IL-6及IL-18 含量显著下降,说明清肺透邪汤能够抑制MP 菌液诱导的炎症因子大量释放,抑制炎症反应。
NLRP3 炎性小体与MPP 等多种病原体引起的呼吸系统感染有关,其激活的方式可能主要与溶酶体破裂方式、半通道方式及活性氧方式激活[12]。 活化的NLRP3 通过其 N 端的热蛋白结构域(pyrin domain,PYD)与ASC 的PYD 域相连,进而诱导ASC的胱天蛋白酶募集结构域(caspase recruitment domain,CARD)招募 Caspase-1 形成 NLRP3 炎症复合体,可以使无活性的pro-IL-1β 加工成为有活性的IL-1β,并分泌到细胞外参与MMP 的炎症反应[13]。此外,有研究表明,在MPP 模型中,MP 可以与组织细胞表面的Toll 样受体(TLRs)结合,激活NF-κB 信号通路引发炎症反应。 TLR4 在免疫炎症反应中发挥关键作用,是机体固有免疫反应中的上游关键因子,MyD88 是TLRs 的接头蛋白,是TLR4 的下游因子,在信号转导过程中发挥重要作用[14]。 TLR4 被激活后与MyD88 相互作用,使其活化,并将信号传递给下游,后经激酶磷酸化激活NF-κB 通路,诱导炎症因子TNF-α、IL-6 等释放,从而参与MMP 炎症反应[15-16]。 Segovia 等[2]首次证实了 NLRP3 是 MP感染过程中炎症和先天免疫细胞反应的重要调节因子。 Chen 等[17]证明了桑色素可通过抑制NF-κB信号通路减轻支原体肺炎。 Liu 等[18]也证实了金丝桃苷可通过抑制显著NF-κB 信号通路降低MP 诱导的IL-8 和TNF-α 的表达,从而改善MPP,以上研究说明NLRP3 炎性小体与 NF-κB 信号通路是调控MPP 病理进程的潜在的有效靶点。 因此本研究利用Western Blot 检测肺组织中NLRP3 炎性小体与NF-κB 信号通路相关蛋白的表达,结果显示,鼻腔滴注 MP 菌液后小鼠肺组织中 NLRP3、MyD88、NF-κB基因和 NLRP3、MyD88、NF-κB 蛋白表达含量显著增加,说明 NLRP3 炎性小体和 NF-κB 信号通路参与了MPP 的炎症反应,与文献报道一致[2-3,17-18]。 而给予清肺透邪汤可显著降低小鼠肺组织中NLRP3、MyD88、NF-κB 基因和 NLRP3、MyD88、NF-κB 蛋白表达含量,说明清肺透邪汤抑制炎症因子释放,减轻炎症反应与抑制NLRP3 炎性小体和NF-κB 信号通路有关。
综上所述,清肺透邪汤改善MPP 小鼠的肺损伤,减轻炎症反应的机制可能与抑制NLRP3 炎症小体和NF-κB 信号通路有关,为清肺透邪汤抗MPP作用机制的研究提供了理论和实验依据。 本研究只是初步探讨了清肺透邪汤治疗MPP 的可能机制,具体有效成分及具体分子作用机制仍需要进一步研究。

