子宫内膜异位症纤维化小鼠模型构建方法及其应用
毕艳丽,倪喆鑫,李溪,俞超芹*
(1. 上海中医药大学,上海 201203; 2. 海军军医大学附属长海医院,上海 200433)
子宫内膜异位症(endometriosis,EM)是子宫内膜腺体和间质种植于子宫以外的一种慢性、雌激素依赖性疾病,在育龄期女性中发病率为10% ~15%[1-2]。 EM 虽是一种良性疾病,却具有发病范围广、症状多样、易转移、易复发的恶性行为,至今其病因及发病机制仍不清楚。 目前EM 的治疗手段主要包括手术和激素类药物,但疗效均不理想。 因此,子宫内膜异位症是妇科学研究的热点和难点之一。
子宫内膜异位症的病理学基础为异位内膜在体内激素的作用下周期性剥脱出血,这种周期性出血长期反复出现引起盆腔粘连、甚至纤维化。 研究显示,80% 以上的EM 患者在初次手术时发现粘连形成,而术后 3 个月再粘连的发生率又可达50%[3-4]。 随着疾病的进展,盆腔粘连逐渐加重,由轻度EM 的亚临床腹膜炎或轻度盆腔粘连,发展至重度EM 的严重而广泛的粘连,形成盆腔纤维化,甚至冰冻盆腔,导致患者不孕、慢性盆腔痛,严重影响女性的身心健康。 然而,目前EM 盆腔纤维化的形成机制尚不清楚[5-6]。
构建一种高效的子宫内膜异位症动物模型将有助于对本病发病机制的认识和新药的开发, 同时可以为探索子宫内膜异位症纤维化发病机制提供理想模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
90 只 SPF 级 6 周龄性成熟 BALB/c 雌小鼠,体重18 ~20 g,购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,饲养于上海长海医院临床实验中心动物实验室【SCXK(沪)2017-0005】,温度22 ~25℃,湿度55% ~60%,12 h光照和12 h黑暗交替,实验前适应性饲养1 周。 所有实验操作均严格遵照动物伦理相关规定执行并通过长海医院伦理委员会审查,批准号:CHEC2019-127。
1.1.2 试剂与仪器
苯甲酸β-雌二醇(Sigma,E2758),实验用芝麻油(Acros organics,241002500),伊红-苏木精染色剂、小鼠转化生长因子 β1(TGF-β1)ELISA 检测试剂盒(武汉博士德),兔抗鼠E-cadherin 抗体(CST,3195S),兔抗鼠Collagen I 抗体(Abcam,AB34710),兔抗鼠 α-SMA 抗体(Abcam,AB5694),兔抗鼠SMMHC-II 抗体(Abcam,AB53219)。
两套眼科常规手术器械(剪刀、镊子、止血钳)、注射用生理盐水、1 mL 注射器、20 mL 注射器、细胞培养皿(Corning,USA),RPMI-1640 培养基(Gibco,USA),低温离心机、组织包埋机、石蜡切片机、光学显微镜(Olympus,Japan)等。
1.2 方法
1.2.1 药物配制
称取1.5 mg 苯甲酸β-雌二醇粉末以50 mL 实验用芝麻油溶解,配成浓度为30 μg/mL 的苯甲酸β-雌二醇溶液置4℃冰箱避光保存备用。
1.2.2 实验分组
造模前,每日定时对所有小鼠进行阴道脱落细胞涂片(美蓝染色法),连续观察两个动情周期,选取动情周期规律的小鼠用于实验。 90 只实验小鼠中48 只用于子宫内膜异位症模型建立,32 只作为假手术组,另外10 只作为空白对照,用于模型对比鉴定。 用于模型建立的48 只小鼠按照1 ∶2的比例随机分为供体鼠16 只和受体鼠32 只。 32 只受体小鼠随机分为4 组,每组8 只,分别为种植后1 周组、种植后2 周组、种植后4 周组和种植后6 周组。
1.2.3 建模方法
所述模型的建立方法,按如下步骤操作:
(1)注射雌激素:所有实验小鼠(包括供体鼠和受体鼠)颈背部皮下注射苯甲酸雌二醇溶液150 μg/kg,每4 天注射1 次,共注射两次。
(2)从注射雌激素开始至腹腔种植当日,每日定时对供体鼠和受体鼠进行阴道脱落细胞涂片检查,观察小鼠动情周期。 动情周期判断依据如下:动情前期:圆形或椭圆形的有核上皮细胞为主,夹有少量角化细胞和白细胞;动情期:几乎全是无核的角化细胞;动情后期:角化细胞减少,出现有核上皮细胞和白细胞;动情间期:细胞少而皱缩,白细胞为主。
(3)种植前标本准备:供体小鼠的子宫取出用预冷的生理盐水清洗血液和粘液,将子宫一分为二分别放入盛有0.5 mL 预冷的RPMI1640 培养基的培养皿中,用眼科剪将子宫纵向剖开,剥离子宫内膜层并迅速将其剪成体积≤1 mm3的内膜碎片制成悬浮液备用。
(4)腹腔注射内膜:受体小鼠腹部皮肤消毒后,以1 mL 注射器针筒接20 mL 注射器针头,以小鼠下腹部正中尿道口上方0.5 cm 处为进针点,将子宫内膜碎片注射入受体小鼠腹腔,针孔处涂抹适量青霉素软膏预防感染,供体鼠与受体鼠数量比为1 ∶2。从取出供体小鼠子宫到注射子宫内膜碎片入受体小鼠所有操作应在5 min 内连续完成,全程保持无菌。 假手术组注射雌激素的方法与模型组相同,不同的是,假手术组腹腔注射的是等体积的供体小鼠的腹腔脂肪组织。
(5)种植后处理:腹腔种植内膜当日开始对受体小鼠颈背部皮下注射苯甲酸β-雌二醇溶液150 μg/kg,每4 天注射1 次,共注射两次,之后待内膜自然生长。
1.2.4 观察指标和检测方法
分别于造模后第1 周末、第2 周末、第4 周末、第6 周末脱颈法随机处死模型组小鼠和假手术组小鼠各8 只,经75%乙醇消毒后以2 mL 预冷的生理盐水注入小鼠腹腔,腹部充分按摩后收集腹腔灌洗液,取出腹腔种植物,从以下方面观察和检测相应指标。
(1)观察种植物形态:开腹后观察小鼠腹腔种植物的生长部位、形态、颜色、体积等。 之后放入4%多聚甲醛溶液,室温固定24 h 后常规石蜡包埋切片做HE 染色,观察种植物病理组织形态学特征。
(2)测量种植物体积:种植物取出后用游标卡尺测量其长度、宽度与高度,按公式V=Π/6×长×宽×高[7],计算种植物体积。
(3)腹腔粘连评分:采用Blauer 粘连评分系统对小鼠腹腔粘连程度进行评分[8-9]。 评分标准:0分,无粘连;1 分,盆腔轻微的膜状粘连;2 分,粘连致密,通常宫角与肠管和膀胱均有粘连;3 分,粘连更致密,范围更广,双侧宫角均与肠管和膀胱粘连,子宫尚有一定活动度;4 分,严重的粘连,双侧宫角均与肠管和膀胱粘连,子宫固定不动。 粘连评分由两位实验人员独立进行,取两位实验人员所评分数的平均值作为最终粘连评分。
(4)TGF-β1 表达水平:2 mL 离心管收集模型组小鼠腹腔灌洗液,4℃,2000 rpm,离心15 min,留取上清,-80℃冰箱保存。 ELISA 试剂盒检测小鼠腹腔灌洗液TGF-β1 表达水平。
(5)Masson 染色:常规石蜡包埋、切片、脱蜡,Masson 三色染色液浸泡15 ~20 min;常规梯度乙醇脱水、二甲苯透明、中性树胶封片。 显微镜下观察种植物胶原纤维沉积情况,评估种植物胶原沉积程度。
(6)免疫组化:常规石蜡包埋、切片、脱蜡,抗体孵育、封片。 纤维化相关蛋白抗体 E-cadherin(1 ∶400)、Collagen I(1 ∶200)、α-SMA(1 ∶200)、SMMHCII(1 ∶300)的表达情况,评估种植物纤维化情况。 显微镜下观察免疫组化染色切片,染色区域内显示为黄棕色或黄褐色为阳性表达,每张切片高倍镜下拍摄三个不同视野,将采集的所有图像应用Image pro Plus 6.0 图像分析软件进行分析,计算每张图像上阳性表达区域的累积光密度(sum IOD),再测量对应阳性表达区域的面积(area of interest,AOI),以平均光密度(mean IOD)值作为该图像阳性表达的定量标准,反映图像上免疫反应物的表达强度。 平均光密度(mean IOD)= 累积光密度(sum IOD)/阳性区域面积(AOI)。 每个样品拍摄的三张图像分析的平均光密度(mean IOD)再作一次平均,作为这个样品的平均光密度(mean IOD)。 针对每个样本的平均光密度(mean IOD)值,用t 检验或单因素方差分析比较各组蛋白表达量的统计学差异。
1.3 统计学分析
采用SPSS 20.0 软件进行统计学分析,计量资料比较,满足方差分析条件者,采用单因素方差分析(One-way ANOVA),两两比较用SNK 法;若不满足方差分析条件者,采用多个独立样本的非参数检验(Kruskal-Wallis H Test)。 实验数据以平均值±标准差( ¯x ± s)表示,以P<0.05 为差异具有统计学意义,使用GraphPad Prism 5.0 对数据处理作图。
2 结果
2.1 小鼠阴道脱落细胞学观察
小鼠动情周期为4 ~5 d,具有规律的性周期,动情前期:圆形或椭圆形的有核上皮细胞为主,夹有少量角化细胞和白细胞;动情期:几乎全是无核的角化细胞;动情后期:角化细胞减少,出现有核上皮细胞和白细胞;动情间期:细胞少而皱缩,白细胞为主。 如图1 所示,不同动情周期小鼠阴道脱落细胞涂片(美蓝染色)。 在内膜种植当日小鼠动情周期较一致,处于动情前期。
2.2 种植物形态学观察
小鼠腹腔子宫内膜异位灶大多数生长在肠系膜上,其次为脾下、腹壁、子宫附近,与周围组织轻中度粘连。 异位灶为囊性不规则形态,有的呈半透明色,有的呈暗红色,囊内含淡黄色或半透明液体,囊壁表面有细小血管形成,囊壁边缘有少量结缔组织,病灶直径范围1 ~10 mm 不等(图2),造模后1 周即见典型的子宫内膜异位灶,造模成功率为100%。 组织病理学观察种植物可见生长良好的腺体和间质,腺体数目较正常在位子宫内膜明显减少,囊腔内可见炎性细胞。(图2)

图1 小鼠阴道脱落细胞染色(美蓝染色,× 100)Figure 1 Methylene blue staining of mouse vaginal exfoliated cells(× 100)
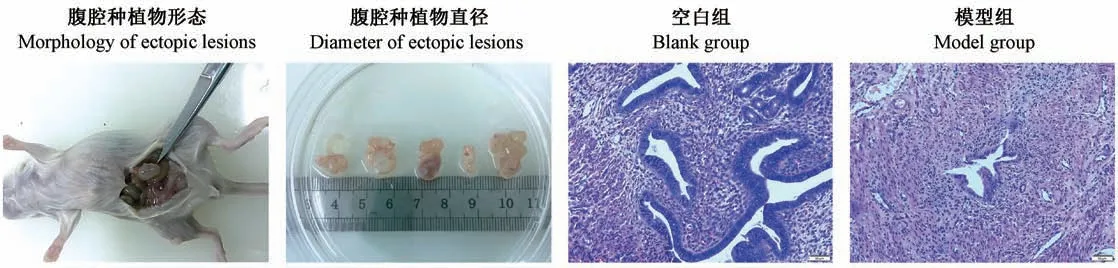
图2 种植物形态和小鼠子宫内膜HE 染色Figure 2 Morphology and diameter of ectopic lesions and HE staining of endometrium
2.3 种植物体积比较
如图3 所示,随着造模时间的延长,EM 模型小鼠腹腔种植物数量无明显变化,但体积呈先增大后缩小再增大的趋势,其中造模后2 周较造模后1 周体积显著缩小,差异具有显著性(P<0.05);造模后4 周、造模后6 周种植物体积与造模后2 周比较再次增大,造模后4 周与造模后1 周种植物体积比较,差异不具有显著性(P>0.05);造模后6 周与造模后1 周种植物体积比较,差异具有显著性(P <0.05)。 假手术组小鼠腹腔脂肪组织稍有增多,均未见明显腹腔种植物。
2.4 腹腔粘连评分
随着造模时间的延长,假手术组(对照组)不同时间点的小鼠腹腔粘连评分比较,差异不具有显著性。 模型组小鼠腹腔粘连程度有逐渐加重趋势,与造模1 周的小鼠腹腔粘连评分相比,造模后2 周、4 周、6 周的小鼠腹腔粘连评分均有显著性增加(P<0.05,P<0.001,P<0.001),造模后6 周的小鼠腹腔粘连评分最高。 (图4)
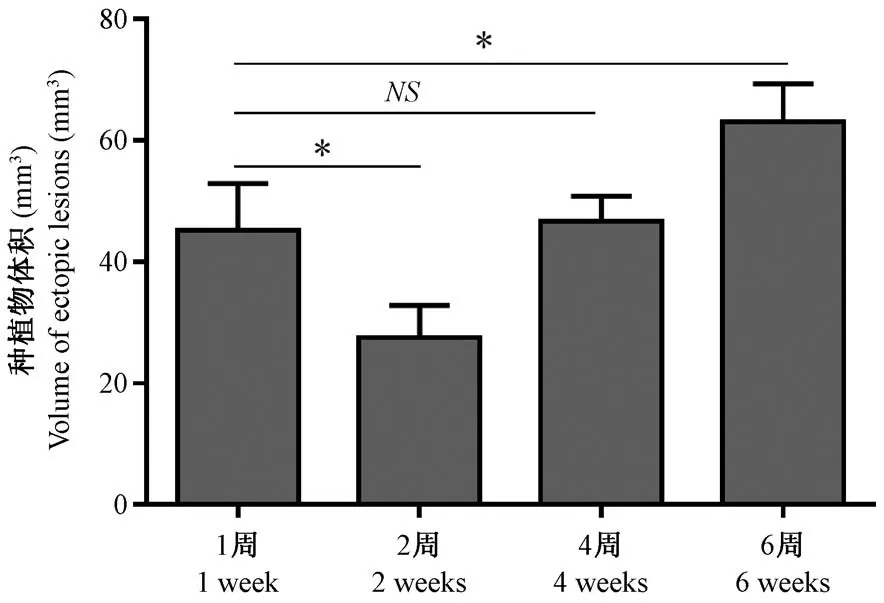
注:与造模后1 周比较,*P<0.05。图3 小鼠腹腔种植物体积Note. Compared with 1 week after modeling,*P<0.05.Figure 3 Volume of ectopic lesions in mice
2.5 腹腔灌洗液 TGF-β1 表达
ELISA 检测结果显示(图5),假手术组(对照组)小鼠腹腔灌洗液TGF-β1 表达水平在腹腔注射后不同时间变化不显著(P >0.05)。 模型组小鼠腹腔灌洗液TGF-β1 表达水平在造模后呈先升高后降低再升高的趋势,其中造模后1 周较造模当日TGF-β1 表达水平显著升高(P <0.05),造模后2 周较造模后1 周TGF-β1 表达水平有轻度降低,造模后4周到6 周TGF-β1 表达水平再次显著性升高(P <0.05)。
2.6 种植物Masson 染色
Masson 染色后肌纤维呈红色,胶原纤维呈蓝色,细胞核呈黑褐色,显微镜下观察种植物胶原纤维沉积明显,随着造模时间的延长,胶原纤维沉积有增多趋势。 (图6)

注:与造模后1 周比较,*P<0.05,***P<0.001。图4 小鼠腹腔粘连评分Note. Compared with 1 week after modeling,*P<0.05,***P<0.001.Figure 4 Score of pelvic adhesion in mice
2.7 免疫组化
免疫组化染色结果显示,纤维化相关蛋白E-cadherin、Collagen I、α-SMA、smooth muscle myosin heavy chain 11(SMMHC-II)于在位内膜和异位内膜均有阳性表达(图7)。 在位内膜,E-cadherin 主要表达于子宫腺体上皮细胞的细胞膜,呈强阳性表达且分布均匀,Collagen I 主要表达于子宫上皮细胞和间质细胞的细胞外基质,α-SMA 和SMMHC-II 主要表达于子宫内膜肌层的平滑肌细胞和成纤维细胞,子宫间质部分几乎不表达。 异位内膜,E-cadherin 在上皮细胞膜表达弱阳性,Collagen I 表达在上皮细胞和间质细胞的细胞外基质但分布无明显规律,α-SMA 和SMMHC-II 在整个异位组织中可见广泛阳性表达,分布无明显规律(图7)。 应用Image pro Plus 6.0 图像分析软件分析染色切片的平均光密度,结果见表1。
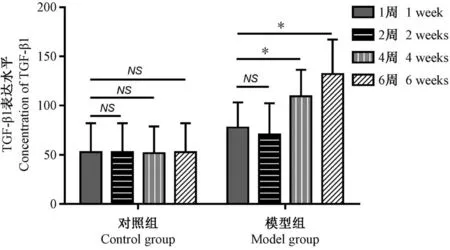
注:与造模后1 周比较,*P<0.05。图5 小鼠腹腔灌洗液TGF-β1 表达水平Note. Compared with 1 week after modeling,*P<0.05.Figure 5 Concentration of TGF-β1 in peritoneal lavage fluid

图6 造模后腹腔种植物Masson 染色结果(× 200)Figure 6 Masson staining results of peritoneal plants after modeling(× 200)
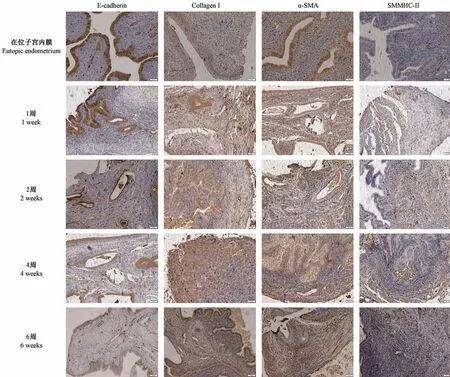
图7 在位子宫内膜和造模后异位种植物免疫组化染色结果(× 200)Figure 7 Immunohistochemical staining results of eutopic endometrium and ectopic plants after modeling(× 200)
表1 正常子宫和异位种植物免疫组化染色图像的平均光密度( , n=8)Table 1 Mean IOD of immunohistochemical staining images of normal uterus and ectopic plants ( , n=8)
注:与正常在位子宫内膜相比,△P < 0.05,△△P < 0.01。 与造模后 1 周种植物相比,*P < 0.05,**P < 0.01。Note. Compared with normal uterus endometrium,△P < 0.05,△△P < 0.01. Compared with ectopic plants,*P < 0.05,**P< 0.01.
images/BZ_30_236_2262_2240_2311.png正常 Control 0.3366 ± 0.0188 0.0579 ± 0.0144 0.1389 ± 0.0254 0.0361 ± 0.0119 1 周 1 week 0.3159 ± 0.0181△ 0.0509 ± 0.0088△ 0.1623 ± 0.0200△ 0.0382 ± 0.0062△△2 周 2 weeks 0.2604 ± 0.0172** 0.1283 ± 0.0167* 0.2536 ± 0.0253** 0.0651 ± 0.0116*4 周 4 weeks 0.1228 ± 0.0245** 0.2600 ± 0.0160** 0.3674 ± 0.0019** 0.1662 ± 0.0199**6 周 6 weeks 0.0628 ± 0.0121** 0.3592 ± 0.0161** 0.4882 ± 0.0259** 0.2025 ± 0.0148**
3 讨论
目前除人类外,只有灵长类动物可以自发形成子宫内膜异位症,但由于代价昂贵、造模成功率低等原因,应用受限。 啮齿类动物由于经济实用、动情周期短、成模率高等优点被广泛使用。 常用的啮齿类动物子宫内膜异位症造模方法主要有同源内膜腹膜缝合法、同源内膜腹腔注射法、同源内膜皮下注射法等,但以上方法均有不足之处。 腹膜缝合法需要开腹手术,操作繁琐,动物感染几率大、死亡风险高。 另外,更重要的是,腹膜缝合法不能避免手术因素对疾病模型的影响,不适于子宫内膜异位症这种自发性疾病的研究。 单纯的子宫内膜皮下注射法虽操作简单,但造模部位不符合临床子宫内膜异位症的好发部位。 单纯的腹腔注射法虽比较符合临床子宫内膜异位症的好发部位,但是不能很好地模拟子宫内膜异位症雌激素依赖的临床特征,且造模成功率较低。 另外,还有用人子宫内膜种植的方法,虽能够观察人子宫内膜异位症的发病特征,但是为避免异体排斥反应,模型需使用裸鼠,而裸鼠免疫功能缺陷,不能模拟正常免疫状态下的疾病情况。 本模型所采用的BALB/c 小鼠基因与人高度相似,遗传背景明确,重复性好,价格经济,饲养方便,多用于肿瘤学、免疫学等的研究。 本模型具有以下优势:采用皮下注射雌激素的方法人为地将小鼠的动情周期同步化,之后在动情前期注射子宫内膜,使异位内膜在小鼠体内生长同步化;腹腔注射法种植子宫内膜,以小鼠下腹部正中尿道口上方0.5 cm 处为进针点,该处对应的腹腔内容物主要为脂肪组织,进针容易,出血概率低,降低了小鼠死亡风险;本发明内膜种植后按照小鼠动情周期规律皮下注射雌激素,促进异位内膜的生长,模拟了子宫内膜异位症雌激素依赖的发病特征;本发明腹腔注射法避免了开腹手术对模型的影响,最大程度地降低了手术创伤造成小鼠盆腔纤维化的可能性,为探索正常免疫状态下子宫内膜异位症盆腔纤维化的发病机制提供了基础。
Blauer 粘连评分系统是一种公认的腹腔粘连评分方法,广泛用于EM 模型腹腔内粘连的分级和评价,该方法使用简便,应用性强。 本研究使用Blauer粘连评分系统发现EM 模型小鼠腹腔粘连程度随造模时间的推移有加重趋势,造模4 ~6 周粘连明显,可作为EM 动物模型腹腔粘连和纤维化研究的时间参考。
TGF-β1 是目前发现的强促纤维化因子[10-12],能够活化多种细胞,促使细胞分泌大量细胞外基质并促进组织中胶原纤维沉积,最终导致组织纤维化。 本研究显示EM 模型小鼠腹腔灌洗液TGF-β1水平随造模时间逐渐升高,提示TGF-β1升高可作为EM 模型盆腔纤维化的重要评价指标之一。 本研究结果显示造模第2 周的种植物体积有轻度缩小且腹腔灌洗液TGF-β1 水平较造模1 周相比有下降趋势,其原因可能是异位内膜种植在小鼠腹腔后激发的局部炎性反应,促炎因子和抑炎因子均反应性升高,激活体内免疫调节机制,短时间内抑制了异位内膜的生长,后期TGF-β1 再次升高可能是异位内膜在多种细胞因子和免疫细胞交互调节后继续侵袭和生长的结果。 研究显示TGF-β1 在子宫内膜异位症的发生发展中起重要作用,TGF-β1可能影响T辅助细胞(Th)的分化,产生更多IL-17和IL-10,可能会间接影响腹腔炎症反应,与更高的IL-1β 和IL-6水平相关,子宫内膜异位症患者腹腔液中TGF-β1可能促进异位病灶的形成[13-14]。
Masson 染色是组织纤维染色中最经典的一种方法,可以显示组织中胶原纤维的沉积情况,是纤维化相关研究常用的一种染色方法[15-16]。 本研究发现,EM 模型小鼠腹腔种植物胶原纤维沉积明显,且随时间推移胶原沉积有逐渐增多趋势,提示Masson 染色可作为EM 模型腹腔异位灶纤维化的一种评价方法。
E-cadherin 即e-钙粘蛋白,是上皮细胞的标记蛋白,正常上皮细胞表达强阳性,主要定位在细胞膜和细胞间质,分布均匀,可维持细胞间紧密连接,具有抑制细胞活动,阻止细胞侵袭和转移的功能,在发生纤维化的组织中E-cadherin 在上皮细胞的表达明显减弱[17-18]。 本研究发现与在位内膜相比,异位内膜上皮细胞的 E-cadherin 表达明显减弱。Collagen I 即I 型胶原蛋白,广泛分布在细胞外基质,是组织纤维化过程细胞分泌的一种重要的蛋白,其过度沉积造成不可逆的组织纤维化[19-21]。α-SMA即α-平滑肌肌动蛋白,目前被认为是肌成纤维细胞的标志,SMMHC-II 即平滑肌肌动蛋白重链II,广泛表达于平滑肌细胞,若过度表达则提示组织处于纤维化的病理状态,二者常应用于纤维化疾病的研究[22-23]。 本研究中由于异位内膜的上皮、间质、肌层结构紊乱,平滑肌细胞和成纤维细胞错杂分布,界限模糊,α-SMA 和SMMHC-II 呈广泛强阳性表达。 本研究结果显示,子宫内膜异位症小鼠模型的腹腔种植物免疫组化染色E-cadherin、Collagen I、α-SMA、SMMHC-II 均呈阳性表达,其中 E-cadherin随着时间的延长,表达逐渐减弱,Collagen I、α-SMA、SMMHC-II 随着时间的延长,表达有逐渐增强趋势,以造模后 4 ~6 周的表达最显著。 故 E-cadherin、Collagen I、α-SMA、SMMHC-II 均可应用于子宫内膜异位症纤维化的实验研究,且造模4 ~6 周纤维化表现较明显。
综上所述,本模型的建立方法具有操作简便、造模周期短、成功率高的特点。 造模后移植的内膜仍保持子宫间质和腺体的组织形态,增殖活性好,模型稳定,能够广泛应用于子宫内膜异位症的动物实验研究,对子宫内膜异位症纤维化机制研究、新药开发等方面具有重要的应用价值。

