化放疗模式下早期弥漫大B细胞淋巴瘤缩小放疗野对生存预后的影响
邓 俊 袁 媛 罗 璇 谭惜颜 于恩浩 刘 科 吴 崢 周菊梅 朱苏雨
2018年全球约有509 590人诊断为非霍奇金淋巴瘤(Non-Hodgkin′s Lymphoma,NHL),预计死亡人数为248 724人[1]。弥漫大B细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)是最常见、并高度异质性和侵袭性的NHL,约占NHL的23.1%[2]。1980年以来化疗联合受累野放疗(IFRT)被认为是早期侵袭性NHL的推荐治疗方案[3-4]。18F-FDG PET/CT被推荐作为淋巴瘤靶区勾画、疗效评估、临床分期、预后判断的最佳功能影像[5-7],伴随精准放疗理念的进步,放射治疗仍被推荐用于治疗早期侵袭性NHL(DLBCL)、大肿块HL(高危因素)、低度恶性、惰性、早期且部分对化疗抗拒的淋巴瘤。然而,对于一线免疫化疗后(CT和/或PET/CT)疗效评估达CR的无高危因素的早期患者,给予进一步化疗后巩固放疗是否必要仍有很多争议[8]。其主要争论热点集中在巩固放疗后的生存获益与产生的毒副反应之间的利弊权衡。在目前IFRT与ISRT观念转型期,放疗医师在临床实际靶区勾画中,受制于客观条件及临床经验等因素限制,具体CTV外扩范围的大小仍存在较大差异[9]。因此,在缺乏高级别证据及权威参考文献指导的情况下探讨如何设置放疗照射野范围并提出真实世界临床实践中具体的靶区勾画建议是有必要的。
1 资料和方法
1.1 病例选择及一般临床资料
回顾性分析我院2011年1月1日—2015年12月30日淋巴瘤数据库,排除单纯放疗、无放疗计划图或单纯化疗,非CR/PR,以及无PET/CT病例,共入组57例。平均完成6周期化疗;CR/PR(39/18);其中Ⅰ期20例(35.1%),Ⅱ期37例(64.9%),年龄23~73岁,男性27例(47.4%),女性30例(52.6%)。
1.2 靶区CTV上、下界边径测量
3DCRT/IMRT计划边界数值测量:由有经验的放疗科医师逐层勾画并确认GTV/GTVpet,标记GTV最高点及最低点,利用计划系统在Y轴方向上测量冠状位、矢状位GTV最高点至CTV最高点、GTV最低点至CTV最低点的垂直距离,经冠状位数据验证,最终以矢状位测量值为CTV靶区上、下界数值分析。
2D计划边界数值测量:由有经验放疗科医师在PET或CT指导下逐层确认GTV/GTVpet,寻找明确的骨性标志,在治疗前影像上,测量骨性标志至肿瘤最高、最低点之间的垂直距离及在计划系统上测量骨性标志至靶区最高点、最低点之间的垂直距离,等比例标尺换算后两者相减得到靶区上、下界数值。
1.3 分组
本研究通过ROC曲线计算得出CTV上界的Cutoff值为4.74 cm,下界Cutoff值为8.5 cm。上界分组为:CTV≤4.74 cm(28例,49%),CTV>4.74 cm(29例,51%)。下界分组为:CTV≤8.5 cm(37例,65%),CTV>8.5 cm(20例,35%)。单独选取CR或PR患者以靶区大小进一步做亚组分析。
1.4 放疗
放疗技术有二维放疗(2D)12例(21.1%),三维适形放疗(3DCRT)10例(17.5%),调强适形放疗(IMRT)35例(61.4%)。不同照射野范围分别有IFRT、ISRT及INRT≤5 cm等。靶区计划系统包括17例Pinnaco,14例Oncentra,4例CMS,6例Monaco,16例2D计划;3D/IMRT计划以CTV 95%等剂量线为处方剂量,2D计划以等中心剂量点剂量计算,中位处方剂量:37.8 Gy(26~60 Gy,1.8~2.47 Gy/f,5 f/w)。
1.5 随访
末次随访时间为2017年9月30日,总失访率7%,中位随访时间31.1个月(9.36~74.22个月)。主要终点目标:无进展生存期(PFS),总生存期(OS),次要终点目标:无远处转移生存期(DMFS),毒副反应,复发模式。野内复发定义为:复发于放疗照射野内;远处复发定义为:复发超出照射野边界5 cm之外;边境复发定义为复发于前两者之间的照射野[10]。
1.6 统计学方法
使用SPSS 19.0软件进行统计学分析,GraphPad 6绘制生存曲线。不同靶区分组间临床病理参数的比较采用卡方检验、连续性校正卡方检验和Fisher精确检验。通过Kaplan-Meier法计算OS,PFS及DMFS,并使用Log-rank检验以及多因素Cox比例风险模型分析生存资料,P<0.05为差异具有统计学意义。
2 结果
2.1 靶区上下界与临床病理参数的关系
DLBCL患者放疗模式与靶区下界有关(P<0.05);化疗后CR/PR状态与靶区上界有关(P=0.029)(表1)。
2.2 单因素生存分析结果
中位随访时间31.1个月,57例患者的2年、3年和5年总生存率、无进展生存率和无远处转移生存率分别为:92.8%、87.3%、89.1%;90.1%、84.8%、86.6%;85.1%、74.8%、81.1%,上界分组的5年总生存率为:96.3%vs. 77.1%(P=0.135),5年无进展生存率为96.3%vs. 59.5%(P=0.013),5年无远处转移生存率为96.3%vs. 69.3%(P=0.038)(表2)。
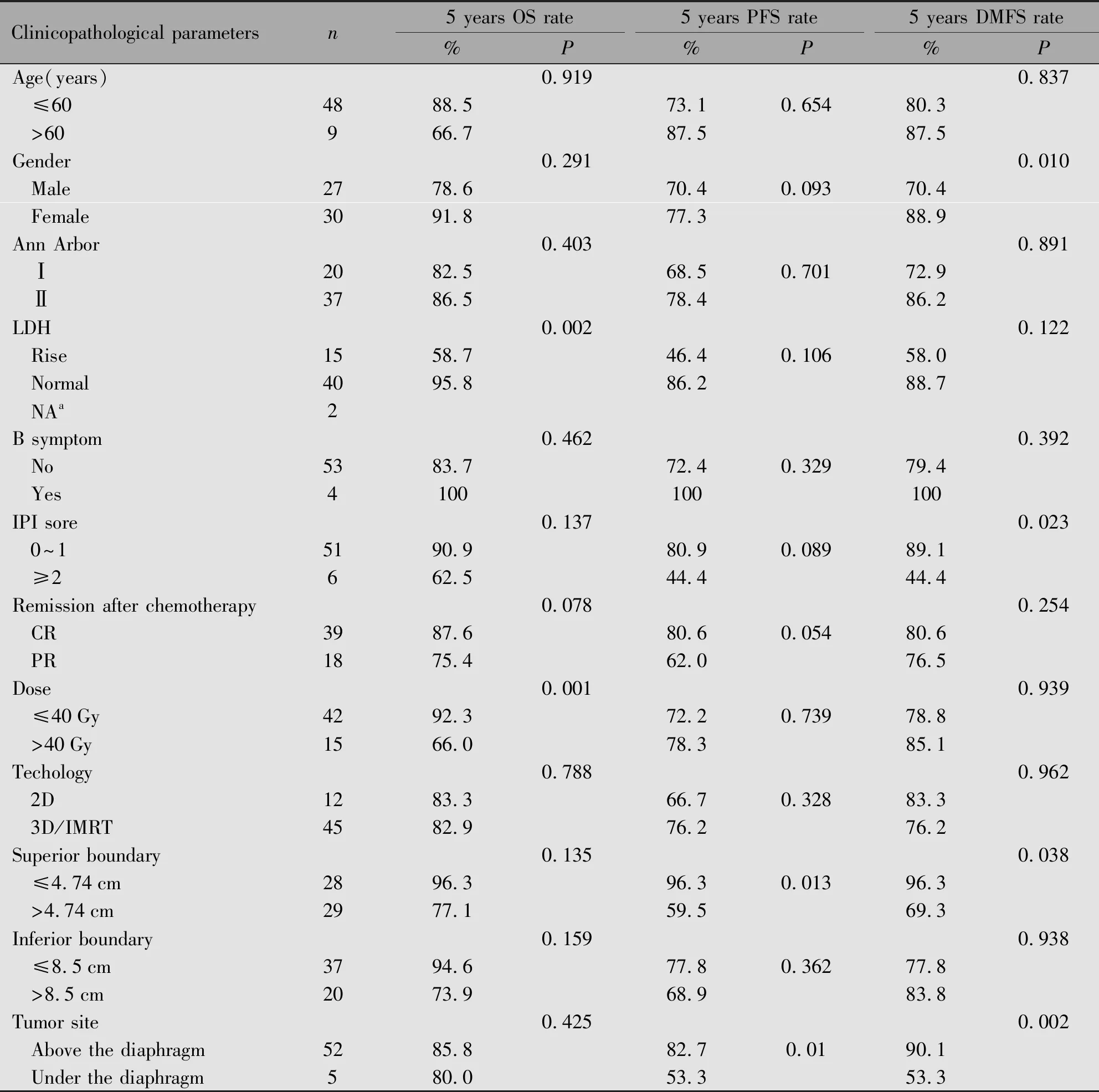
表2 临床病理参数与总生存率、无进展生存率和无远处转移生存率的关系
2.3 多因素预后生存分析
将单因素分析有统计学意义的变量纳入多因素Cox回归分析,结果显示靶区上界≤4.74 cm(P=0.039)为PFS的独立保护因素。LDH升高(P=0.028)是OS的独立危险因素;IPI评分<2(P=0.025)是DMFS的独立保护因素(表3)。
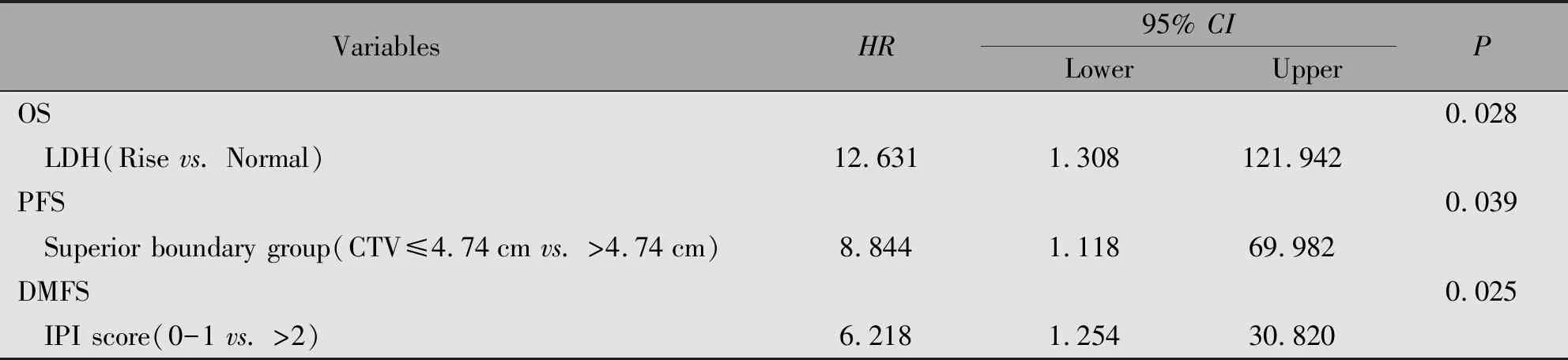
表3 57例患者多因素预后分析
2.4 放疗野大小分组的生存预后分析
靶区上界CTV≤4.74 cm组较CTV>4.74 cm组具有更好的PFS(P=0.013)、DMFS(P=0.038),而OS(P=0.135)则无统计学差异,靶区下界分组CTV≤8.5 cm与CTV>8.5 cm在OS(P=0.159),PFS(P=0.362),DMFS(P=0.938)上差异均无统计学意义(P>0.05)(图1)。
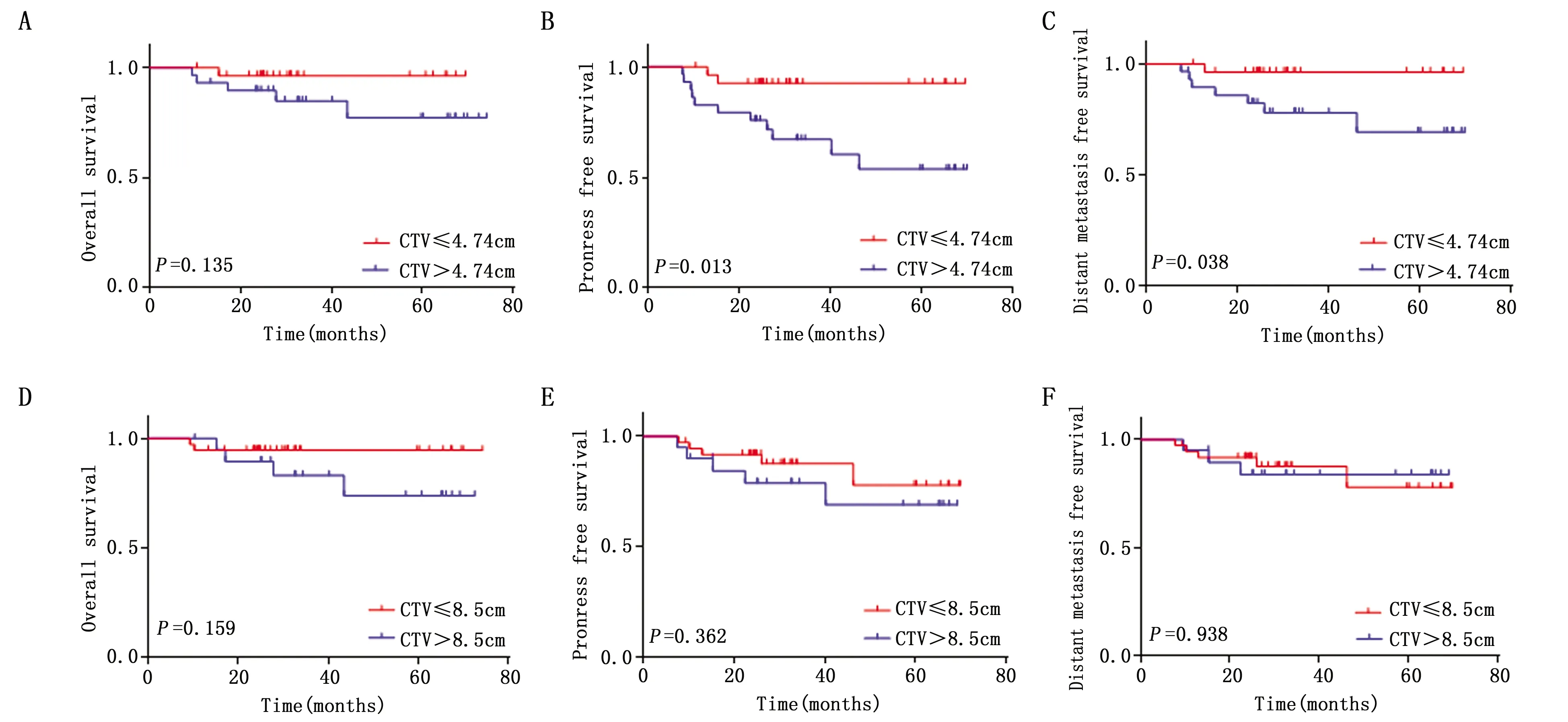
图1 57例患者放射野大小与OS,PFS,DMFS的生存曲线Figure 1 The survival curves of OS,PFS and DMFS with the targeted area of in 57 patientsNote:The curves of OS(A),PFS(B)and DMFS(C)with CTV≤4.74 cm and CTV>4.74 cm in the upper limit group;The curves of OS(D),PFS(E)and DMFS(F)with CTV≤8.5 cm and CTV>8.5 cm in the lower limit group.
2.5 CR/PR状态与靶区分组的亚组分析
在CR组中,靶区上界CTV≤4.74组的无进展生存率(95.5%vs. 59.7%,P=0.023)、无远处转移生存率(95.5%vs. 59.7%,P=0.023)明显高于CTV>4.74组(表4)。

表4 CR/PR患者放疗野大小与总生存率、无进展生存率和无远处转移生存率的关系
2.6 复发模式与毒副反应
共10例复发(局部野内复发2例,远处复发8例);死亡6例(心衰死亡1例,肿瘤复发死亡5例);近期毒副反应主要为:(1)骨髓抑制;(2)口腔黏膜反应;远期毒副反应主要为:(1)放射性口腔黏膜炎;(2)吞咽困难或张口受限;(3)放射性肺纤维化;(4)口干;(5)视力下降。≥3级的毒副反应均发生在靶区上界分组中的CTV>4.74 cm组(P=0.026)(表5)。

表5 放疗相关远期毒副反应与靶区分组间关系
3 讨论
Shahidi等[11]通过随访早期霍奇金淋巴瘤患者5年复发情况发现40%的复发人群中,83%的患者复发部位为最初受累的淋巴结。进而Girinsky等[12]提出INRT的概念,即理想状态下放射治疗野可仅包括化疗前经高质量功能影像确认受累的淋巴结,对于周围可能存在亚临床病灶的高危淋巴引流区的安全性保证完全寄托于化疗疗效控制。ISRT的CTV大小边界仍游离于IFRT与INRT之间[13],不同放疗中心靶区勾画无法形成统一共识,因此ISRT放疗野存在争议。靶区设置的不确定性导致既往关于NHL、HL、FL多种类型淋巴瘤的缩野研究仅局限在靶区(例如:EFvs. IF和IFvs. IN或IFvs. IS)间概念对比研究,并无确切的CTV外扩大小的对比。文献定义IFRT为CTV外扩≤10 cm[14-15]、INRT≤5 cm[10],ISRT外扩暂无统一定论。
本研究在靶区大小分组与临床病理参数的相互关系分析中,除放疗模式与靶区下界(CTV≤8.5 cm,CTV>8.5 cm)(P<0.001)、末次化疗后CR或PR状态与靶区上界分组(P=0.029)的关系有统计学意义外,其余无统计学意义(P>0.05)(表1)。且CR亚组分析中,针对这部分优势人群,适当缩小靶区上界大小,5年的无复发生存率会有一定获益(P=0.023)(表4)。可见末次化疗后经PET/CT疗效评估为CR/PR的病例,对放疗科医生的靶区勾画有一定的指导性作用,首先是肿瘤的良好退缩,一定程度上减轻肿瘤负荷,同时因个体差异可能为化放疗敏感优选人群,在化疗的良好生存保障前提下,在巩固放疗靶区勾画时更有条件缩小靶区范围,减少因危及器官限量而影响GTV处方剂量。再加上PET/CT功能影像对靶区勾画的指导,保证计划的适形性,周围组织毒副反应也会进一步降低,进一步验证了基于18F-FDG PET成像计划的靶体积减少是可行的精准放疗理念,尤其化疗达CR后给予巩固放疗适当缩小放疗靶区大小更可靠。
既往多个研究曾对不同类型淋巴瘤照射野进行对比研究,2008年Campbell等[10]对325例早期HL淋巴瘤三种不同照射野范围进行对比研究:EFRT、IFRT、INRT≤5 cm三组的OS差异均无统计学意义,即针对早期HL,放疗照射野缩小至INRT≤5 cm是可行的。2010年Campbell等[10]再次对早期滤泡淋巴瘤(FL)不同照射野范围(IFRTvs. INRT≤5 cm)进行分析研究认为缩小照射野至INRT≤5 cm并未影响复发率及远期生存率;2012年Campell[16],2013年Verhappen等[17]的研究结果同样证实缩小照射野患者的OS、PFS等均无明显变化,局控率也基本相同,但可减轻放疗相关2级及以上毒副反应。
综上,针对不同类型淋巴瘤,既往多数有关放疗野的研究结论优势均体现在复发模式及毒副反应上,总体生存差异均无统计学意义,本研究在以化疗疗效CR/PR为保障的综合治疗模式下,对比靶区上下界对早期DLBCL患者生存预后的影响,结论显示:CTV上界≤4.74 cm组较CTV>4.74 cm组有更好的DMFS(P=0.038)和PFS(P=0.013),OS(P=0.135)无统计学差异,多因素分析也支持靶区上界分组(CTV≤4.74 cm、CTV>4.74 cm)为PFS的独立预后因素,这与上述NHL研究结论相似,即缩小照射野在PFS和OS上仍可得到长期生存获益[16-17]。尽管目前缩小照射野治疗早期DLBCL仍然缺乏大样本随机对照研究的证据,但已有多个证据支持缩小照射野后不影响远期生存,且可减少危及器官照射所致的放疗远期/近期毒副反应及放疗所诱发的第二原发癌的发生[16,18]。
本研究的复发模式为:6例发生远处复发,2例野内复发,无边境复发,8例发生远处转移,其中7例发生于CTV上界>4.74 cm组(P=0.064),局部复发的2例均发生在CTV>4.74 cm组(P=0.491),这与Campbell等[10]的复发模式研究中结论基本一致。本研究结论中,在毒副反应发生类别分析上,虽各毒副反应类型间、近期毒副反应与靶区大小分组间差异均无统计学意义,但≥3级远期放疗相关反应在靶区上界CTV<4.74 cm组发生率显著降低(P=0.010),同样在Verhappen等[17]的研究中也进一步证实了这一点,可见化放疗综合治疗模式下,对于CR/PR患者缩小靶区照射野范围是切实可行的,并未增加总体远处复发生存率,反而可在减轻>2级远期毒副反应上看到优势。
综上所述,本研究显示,对于化疗后疗效评估为CR或PR的早期DLBCL患者,在保证长期生存获益的同时,适当地减小放疗靶区域可减少远期放疗副反应发生率,且不增加局部复发及远处转移。但本研究是一项回顾性研究,且病例数较少,可能会产生一些偏差,因此,未来需要更多大型的前瞻性研究来证实这一结论。

