BRAFV600E基因突变检测在甲状腺乳头状癌诊断中的应用价值
彭大颖
(辽宁省盘锦辽油宝石花医院 病理科, 辽宁 盘锦, 124000)
近年来, 甲状腺癌的发病率逐年升高,其中甲状腺乳头状癌(PTC)是临床上最为常见的类型,占全部甲状腺癌病例的85%~90%[1]。绝大多数PTC患者可通过有效的治疗获得较好的预后,总体病死率较低。统计数据[2]显示,晚期甲状腺癌的发病率和死亡率仍呈上升的趋势。研究[3]发现,少数PTC患者会出现失分化现象,发展为失去摄碘能力的难治性PTC, 还有部分病灶直径小于1 cm的甲状腺微小乳头状癌(PTMC)可表现为早期淋巴结转移,增大了治疗的难度,对患者预后产生不良影响。因此,根据术前诊断结果制订合理的治疗方案是改善患者预后的关键。
目前临床上对于PTC的筛查主要依靠甲状腺超声检查,而进一步的确诊一般需要在超声引导下行细针穿刺细胞学检查(FNA)。尽管FNA的诊断特异性较好,但仍有40%的FNA结果不能做出明确的诊断[4]。研究[5]发现,鼠类肉瘤滤过性毒素菌致癌同源体B1(BRAF)、RAS、转染中重排(RET)、端粒酶逆转录酶(TERT)、p53等多种基因结构和功能的变化均与PTC密切相关,并可用于辅助诊断,但目前这些癌基因的检测和诊断手段仍然存在许多不足,检测结果的稳定性也无法满足临床需求。BRAF基因V600E(BRAFV600E)突变是PTC最常见的基因突变类型,一般认为约45%的PTC患者存在BRAFV600E基因突变,但临床病理研究[6]报道中的突变率要远远高于这一数值,因而BRAFV600E基因常被作为一种特异性基因用于PTC的诊断和预后评估。然而,对术前穿刺活检的BRAFV600E基因突变检测能否作为PTC的可靠诊断方法仍具有较大争议。基于上述现状,本研究分析BRAFV600E基因突变检测在PTC诊断中的应用价值,现报告如下。
1 资料与方法
1.1 临床资料
选择2017年12月—2019 年10月盘锦辽油宝石花医院收治的82例PTC患者作为研究组,选取同期80例甲状腺良性结节患者作为对照组。2组患者均签署知情同意书,自愿参与本研究。纳入标准: ① 患者择期行甲状腺切除术,均经术后病理检查确诊; ② PTC及甲状腺良性结节的诊断符合中华医学会内分泌学会制定的《甲状腺结节和分化型甲状腺癌诊治指南》中的相关诊断标准[7]; ③ 患者年龄均大于18岁,临床资料完整; ④ 患者术前均在超声引导下行FNA检查。排除标准: ① 合并其他部位恶性肿瘤、肝肾功能不全、心脑血管意外、免疫缺陷病、血液疾病的患者; ② 复发或术前已接受过抗肿瘤治疗的患者; ③ 孕妇或乳母。
1.2 观察指标
1.2.1 甲状腺病灶组织BRAFV600E基因突变检测: 收集FNA检测所得活检组织,采用DNA提取试剂盒提取DNA, 采用微量紫外分光光度计检测DNA浓度,将符合要求的DNA稀释至100 ng/μL, 置于-20 ℃冰箱中保存待测。采用7500型实时荧光定量聚合酶链式反应(qRT-PCR)仪(美国ABI公司)进行qRT-PCR扩增,引物序列采用BRAFV600E基因第 15 号外显子引物。引物序列: 正向引物为5′-TCATAATGCTTGCTCTGATAGGA-3′, 反向引物为5′-GGCCAAAAATTTAATCAGTGGA-3′, 反应体系为26 μL。反应程序: 预变性95 ℃下5 min, 变性95 ℃下30 s, 退火5 ℃下30 s, 延伸72 ℃下30 s, 长延伸72℃下8 min, 保存于4 ℃环境下,共反应35个循环。当待测样品反应管内荧光信号达到设定界值时所经历的循环阈值(Ct)≥28时,判定为BRAFV600E基因野生型(阴性); 若待测样品Ct<28, 判定为BRAFV600E基因突变型(阳性)。
1.2.2 PTC患者的临床病理特征调查:通过查阅病历的方式对研究组患者的年龄、性别、是否为PTMC、病灶数、甲状腺外浸润、淋巴结转移、TNM分期等临床病理特征进行调查。
1.3 统计学方法
采用SPSS 22.0软件进行统计学分析,计数资料采用[n(%)]表示,样本率和构成比的比较采用χ2检验或Fisher确切概率法, BRAFV600E基因突变诊断PTC的价值采用受试者工作特征(ROC)曲线进行分析,将曲线下面积(AUC)作为诊断价值衡量指标,以P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者术前穿刺活检组织BRAFV600E基因突变情况比较
研究组和对照组分别有57例和4例患者的活检组织中检出BRAFV600E基因突变,阳性率分别为69.51%和5.00%, 差异有统计学意义(P<0.01)。
2.2 研究组不同临床病理特征PTC患者术前穿刺活检组织BRAFV600E基因突变情况比较
研究组中, BRAFV600E基因突变阳性患者PTMC比率、出现N3淋巴结转移比率、TNMⅡ~Ⅳ期比率高于BRAFV600E基因突变阴性患者,差异均有统计学意义(P<0.05)。见表1。

表1 研究组不同临床病理特征PTC患者术前穿刺活检组织BRAFV600E基因突变比较[n(%)]
2.3 术前穿刺活检组织BRAFV600E基因突变检测在PTC诊断中的价值
术前穿刺活检组织BRAFV600E基因突变检测在PTC与良性结节的鉴别诊断、PTMC诊断及PTC临床分期诊断中的AUC分别为0.823、0.797、0.759, 差异均有统计学意义(P<0.05), 而在N3淋巴结转移诊断中的AUC差异无统计学意义(P>0.05)。见表2。
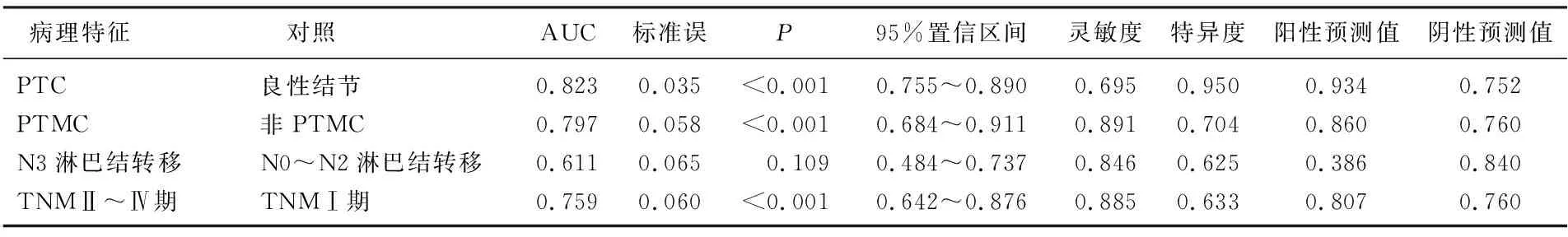
表2 术前穿刺活检组织BRAFV600E基因突变检测在PTC诊断中的价值
3 讨 论
近年来,学术界对甲状腺结节FNA样本BRAFV600E基因突变检测进行了多项研究,但结果差异性较大。研究[8-9]结果显示, BRAFV600E基团突变检测可提高甲状腺结节的鉴别诊断准确率,并与甲状腺被膜外侵犯相关,有助于高危病例的术前筛选,但与肿瘤大小、淋巴结转移、临床分期等临床病理特征无关。针对合并慢性淋巴细胞性甲状腺炎PTC患者的研究[10]结果显示,不同BRAFV600E基因突变状态患者的肿瘤大小、癌灶形态、癌灶数量存在差异,但癌灶数量及中央区淋巴结转移与BRAFV600E基因突变无显著相关性,提示BRAFV600E基因突变状态对PTC临床病理特征的影响并不明确。还有研究[11-12]结果显示, BRAFV600E基因突变可提示PTC肿瘤组织分化差和高侵袭性病理亚型的出现,也可反映患者死亡风险的升高,PTC的超声图像特征中的病灶数目、接触被膜、微钙化、血流情况均与BRAFV600E基因突变存在相关性。
针对PTMC患者的研究[13]显示,BRAFV600E基因突变与肿瘤大小、淋巴结转移呈正相关,能够反映肿瘤的侵袭性生物学行为,可为手术方式选择和预后判断提供参考。本研究结果支持BRAFV600E基因突变检测与PTC的病情和病理类型相关的结论,提示BRAFV600E基因突变作为一种促癌机制,可能反映了PTC的发生和进展程度。BRAFV600E是BRAF基因第15外显子1 799位点T-A转换,即密码子600位的缬氨酸被谷氨酸替代。作为PTC最常见的基因变异,BRAFV600E基因突变已被证实与PTC的发生、发展、复发和不良预后有关[14-15],并与肿瘤组织中促甲状腺激素受体表达下调等机制密切相关[16]。因此,临床医生可考虑将术前穿刺活检组织的BRAFV600E基因检测作为诊断的辅助依据。
本研究结果显示,采用超声引导下穿刺活检法检测病灶组织中的BRAFV600E基因突变情况,发现PTC患者具有较高的BRAFV600E基因突变阳性率,且与肿瘤的进展、转移和病理类型有关,这种检测方法在PTC的鉴别诊断、临床分期评价、病理诊断方面均具有价值,提示了这种检测方法能够用于辅助PTC的诊断和病情评价。本研究结果提示不同BRAFV600E基因突变情况的PTC患者淋巴结转移程度具有差异,但ROC曲线分析未支持BRAFV600E基因检测对于N3淋巴结转移有辅助诊断价值的结论。近年来相关研究[17-18]结果显示,PTC患者易出现中央区淋巴结转移(CLNM),BRAFV600E基因突变虽然与肿瘤的超声影像学表现缺乏相关性,但一项针对35篇文献的Meta分析[19]结果显示,BRAFV600E基因突变与PTC的淋巴结转移呈正相关,可提高PTC患者的淋巴结转移风险,这与本研究结果存在一定差异,其原因可能是本研究将N0~N2淋巴结转移者作为对照,而将N3淋巴结转移者作为病例,而非以N0作为对照。本研究PTC病例中, N0~N2淋巴结转移的病例较多,而N3淋巴结转移的病例较少,抽样差异导致了诊断价值不明显。CLNM对PTC预后的影响仍有待于进一步明确[20]。一般来说,对于N0患者可应用预防性中央区淋巴结清扫,但在临床实际情况中,此类患者的数量较少,不宜作为对照病例。因此,针对术前检测BRAFV600E基因突变阳性且肿瘤直径较大的患者,应重视对中央区淋巴结的清扫。
综上所述,PTC组织具有较高的BRAFV600E基因突变阳性率,术前通过穿刺活检对病灶组织中BRAFV600E基因突变进行检测,在PTC的鉴别诊断、临床分期诊断、病理诊断等方面具有一定的应用价值,可用于PTC的辅助诊断和病情评价。

