生物电阻抗法在血液透析患者营养状况评估中的应用
孙 琦, 陶 静, 华建武, 孙 伟
(南京中医药大学附属医院/江苏省中医院, 江苏 南京, 210029)
蛋白质-能量消耗(PEW)在维持性血液透析(MHD)患者中比较常见(患病率为30%~50%[1]), 已被证实是MHD患者高病死率的独立危险因素之一[2-3]。美国肾脏疾病数据系统(USRDS)的数据显示,伴蛋白质-能量营养不良的血液透析患者每年的病死率近20%[4]。生物电阻抗法(BIA)作为评估患者身体成分的非侵入性技术,已被证实在血液透析患者营养状况评估中具有可靠性[5]。本研究采用BIA评估本院血液净化中心MHD患者的营养状况,并结合实验室指标和人体测量指标分析相关影响因素,现报告如下。
1 对象与方法
1.1 研究对象
选择2018年12月—2019年7月在本院行MHD治疗的54例患者作为研究对象,患者均采用德国费森尤斯4008B型透析机治疗,透析器为尼普洛空心纤维透析器SUREFLUX-150G, 每次透析时间3.5~4.0 h, 血流量 200~250 mL/min, 血管通路均采用成熟内瘘,并采用低分子肝素抗凝。纳入标准: 年龄>18岁,透析龄3个月以上,无严重心、肺、脑并发症,以及愿意参加本研究者。排除标准: 合并恶性肿瘤者、胸腹腔积液伴明显水肿者以及体内放置金属支架或起搏器者。54例患者中,男35例,女19例; 年龄31~84岁,平均(58.20±13.47)岁; 原发病为慢性肾小球肾炎19例,糖尿病肾病6例,高血压肾病13例,系统性红斑狼疮1例,多囊肾4例,其他11例。
1.2 方法
1.2.1 人体测量指标: 在透析结束后20 min内完成患者人体测量指标的测量,包括身高、上臂围(MAC)、上臂肌围(MAMC), 并计算体质量指数(BMI), 测量方法及评价标准参照中国医师协会编著的《临床技术操作规范(临床营养科分册)》。BMI正常值范围为18.5~23.9 kg/m2; MAC正常参考值为男性27.4 cm, 女性25.8 cm; MAMC正常参考值为男性 25.3 cm, 女性 23.2 cm。
1.2.2 实验室检查指标: 检验科工作人员统一采集患者血液透析前空腹静脉血,采用全自动生化分析仪检测血清白蛋白(ALB)、血红蛋白(Hb)、前白蛋白(PAB)、血清转铁蛋白(TRF)、尿素氮(BUN)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、尿酸(UA)和血清磷、血清钙、血清甲状旁腺激素(PTH)水平。ALB正常值范围38~55 g/L, 患者靶目标≥40 g/L; Hb正常值范围110~130 g/L, 患者靶目标110~120 g/L; PAB正常值范围125~400 g/L; TRF正常值范围2.6~4.3 g/L; BUN正常值范围1.7~8.3 mmol/L; TG正常值<1.7 mmol/L; TC正常值范围2.8~5.7 mmol/L; HDL正常值范围0.9~1.9 mmol/L; LDL正常值范围2.07~3.10 mmol/L; UA正常值范围140~340 μmol/L; 血清磷正常值0.87~1.45 mmol/L, 患者靶目标1.13~1.78 mmol/L; 血清钙正常值范围2.13~2.50 mol/L; PTH正常值范围150~300 ng/L。
1.2.3 BIA检测: 采用韩国Biospace有限公司生产的InBody720人体成分分析仪在透析结束后20 min内对MHD患者进行人体成分分析,测量指标包括蛋白质、体脂肪量(BFM)、骨骼肌、体脂肪百分比(PBF)、腰臀比(WHR)、身体细胞量(BCM)、骨矿物质含量(BMC)、基础代谢(BM)、无机盐(IS)等,检测方法及营养不良评价标准均严格遵守仪器使用手册相关要求[6]。
1.3 统计学分析
2 结 果
2.1 实验室指标检查结果
实验室指标检查结果显示,以PAB、ALB为评估指标,营养不良检出率分别为3.70%、53.70%; 37.04%患者TG水平偏高,存在脂代谢异常; 68.52%患者存在高磷血症。见表1。
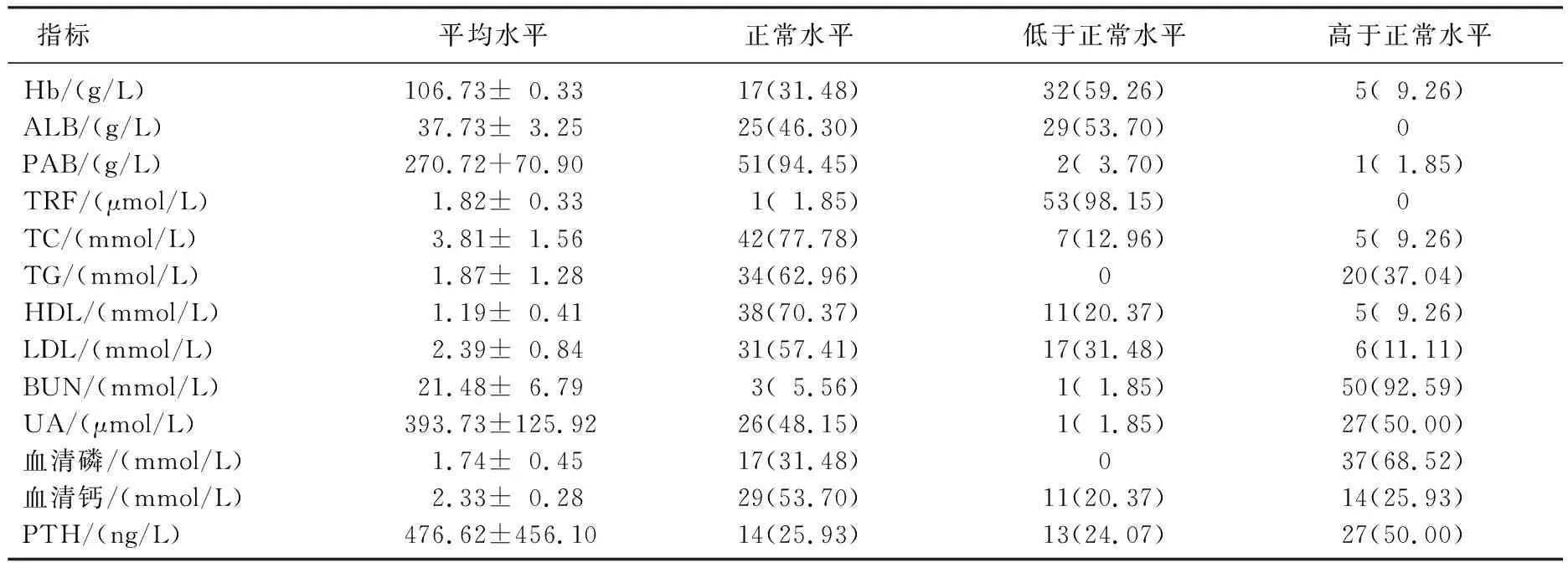
表1 54例MHD患者实验室指标检查结果[n(%)]
2.2 BIA人体成分与人体测量指标检测结果
BIA检测结果显示, 40.74%患者存在骨骼肌不足情况, 33.33%患者存在蛋白质减少情况, MAMC指标提示40.74%患者存在肌肉消耗情况, PBF指标提示61.11%患者存在体脂肪量超标情况, WHR指标提示62.96%患者存在腹型肥胖。人体测量指标结果显示,以BMI为评估指标,本组患者营养不良的发生率为5.56%。见表2。

表2 54例MHD患者BIA人体成分指标与人体测量指标检测结果分布情况[n(%)]
2.3 MHD患者骨骼肌与各营养指标的Pearson相关性分析结果
Pearson相关性分析结果显示, BCM、BMC、BM、MAMC、MAC、PBF、蛋白质、IS、BMI、HDL、TRF、血清磷均与患者骨骼肌含量具有显著相关性(P<0.05), 骨骼肌含量与ALB、PAB等其他营养指标无显著相关性(P>0.05)。血清磷与骨骼肌呈显著正相关(r=0.272,P<0.05), 而蛋白质与骨骼肌的相关性最强(r=1.000,P<0.05), 见图1、2。
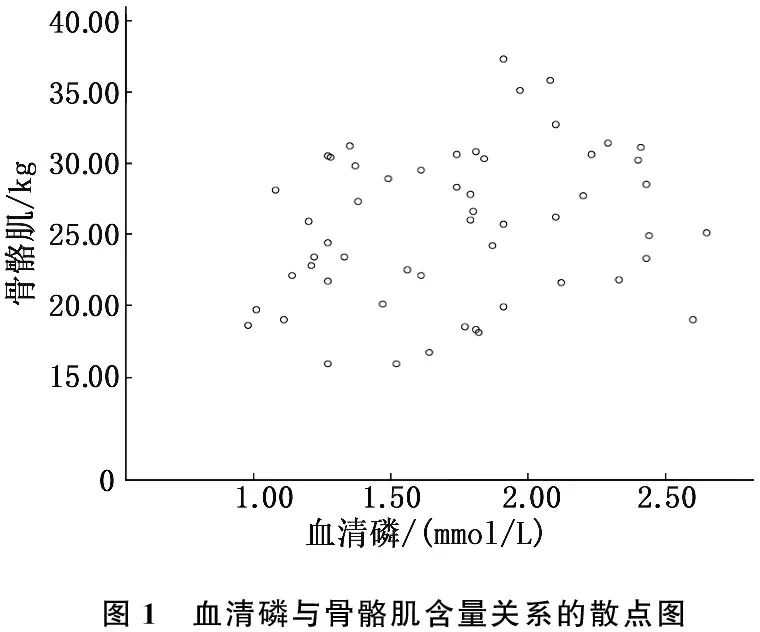
图1 血清磷与骨骼肌含量关系的散点图

图2 蛋白质与骨骼肌含量关系的散点图
2.4 MHD患者骨骼肌的多元线性回归分析
以骨骼肌为因变量,以PBF、BCM、BMC、BM、血清磷、HDL、TRF、BMI、MAMC、MAC、蛋白质、IS为自变量,进行多元线性回归分析,结果显示,蛋白质(β=1.091,P<0.001)、血清磷(β=-0.009,P=0.016)是MHD患者骨骼肌含量的影响因素。由于变量之间的交互作用对系数产生的影响,经过多元线性回归分析后,血清磷与骨骼肌的相关性变为负相关(β=-0.009)。见表3。

表3 MHD患者骨骼肌的多元线性回归分析结果
3 讨 论
近年来,慢性肾脏病(CKD)已成为全球范围内危害人类健康、加重社会经济负担的公共卫生问题。美国一项针对20岁以上人群健康营养状况的调查[7]结果显示, CKD的患病率高达17%。相关流行病学调查[8]显示,中国成人CKD患病率为10.8%。随着CKD发病率的升高,终末期肾脏病的发病率也在逐年升高[9]。血液透析作为常见的肾脏替代疗法,是治疗终末期肾脏病的有效手段之一,可提高患者的生存质量,延长生存时间。然而CKD会引起患者厌食、消化能力减退、胰岛素抵抗或缺乏、微炎症状态和其他高分解代谢性疾病,加之血液透析过程中营养丢失或患者饮食结构不合理等诸多因素导致蛋白质摄入不足, MHD患者普遍存在蛋白质-能量营养不良,且营养不良与较差的预后密切相关[10]。因此,准确评估并早期干预营养不良对于提高MHD患者生活质量和降低病死率具有重要意义。
PEW即在营养不良发生发展过程中,肌肉蛋白质合成率降低、分解速率加快,引起骨骼肌进行性消耗,而骨骼肌含量是反映患者营养状况的重要指标[11]。BIA可精准测得骨骼肌的含量[12], 本研究中患者骨骼肌不足的发生率为40.74%, 提示近半数患者存在肌肉不足情况,表明本院血液净化中心血液透析患者营养不良且肌肉不足的问题较为突出。随着尿毒症病情的进展,血液透析患者可能会出现肌力降低、肌肉结构选择性改变和明显的肌肉萎缩[13-14]。既往研究[15]表明, MHD患者骨骼肌减少症的发病原因可能与蛋白摄入不足、促炎细胞因子增多、胰岛素抵抗等多种因素有关,但具体机制尚未明确。本组患者体脂肪超标率(53.70%)及WHR超标率(62.96%)较高,即大部分患者存在肥胖且多属于腹型肥胖类型,故本中心患者出现骨骼肌减少的原因还可能与患者缺乏运动有关。
本研究中,多元线性回归分析显示,骨骼肌含量随着血清磷水平的升高而减少。磷酸盐诱导的肌肉萎缩的分子机制研究[16]表明,血清磷酸盐毒性可加速肌肉消耗过程,而采用不同浓度的磷酸盐刺激大鼠L6细胞的动物实验[17]证明,血清磷酸盐超载即高磷血症会直接影响骨骼肌细胞,对骨骼肌自噬具有刺激作用,提供了高磷血症导致慢性肾病患者骨骼肌萎缩的证据。从人体磷来源方面分析原因,日常饮食是摄取磷的主要来源,饮食结构对磷摄入影响较大,蛋白摄入应与磷摄入相平衡,由于透析早期不必严格执行低蛋白饮食,部分存在骨骼肌减少的患者为了改善营养状况,常盲目饮食,导致磷含量增高。2017年KDIGO组织在慢性肾脏病矿物质和骨代谢紊乱(CKD-MBD)指南[18]中建议,临床可通过限制磷的饮食摄入并联用其他降磷方法来治疗高磷血症。因此,在降磷治疗时,临床医生应加强对患者饮食结构的管理,鼓励并教育患者阅读食品成分表,建议患者根据食物的磷蛋白比(每含1 g蛋白质所含磷的量)选择合适食物,帮助患者减少磷的摄入,延缓骨骼肌萎缩进程。高磷血症是慢性肾功能不全以及血液透析患者常见并发症,本研究中有68.52%(37/54)患者存在高磷血症(血清磷水平>1.45 mmol/L), 其中72.97%(27/37)患者未达到控制目标(血清磷水平>1.78mmol/L), 提示临床医生在改善患者营养状况时应充分考虑患者血清磷水平。
蛋白质是人体一切细胞、组织的重要组成成分,本研究发现蛋白质亦为骨骼肌的影响因素,与既往研究[19]结果相符。PAB是反映蛋白质储存情况的传统营养指标,本研究根据PAB得出的营养不良检出率为3.70%(2/54), 相较BIA测得的骨骼肌不足的检出率显著较低,分析PAB正常患者的BIA测量数据,仍有35.29%(18/51)患者存在骨骼肌不足情况,且PAB与骨骼肌无显著相关性(P>0.05), 原因可能与血清蛋白质易受感染、炎症、水肿、酸中毒等非营养因素影响有关。血清ALB水平控制达标(靶目标)的患者中,有50.00%(8/16)患者存在骨骼肌减少,研究[20]表明, ALB水平对病死率产生影响可能是因为炎症而不是营养摄入不足,因此采用PAB、ALB指标来评估营养状况时会受到一定限制。临床评估营养状况时,应采用实验室指标联合BIA检测或其他营养评估方法进行综合评估,弥补单一指标的局限性,提供更准确的营养状况评估结果。
综上所述, MHD患者营养不良发生率较高,骨骼肌减少问题突出,血清磷、蛋白质水平是MHD患者骨骼肌含量的影响因素,临床应加强对患者血清磷水平的控制,以减缓骨骼肌萎缩进程。BIA是一种简单、廉价、快速、无创、可重复的人体成分评估技术,建议将其联合实验室指标检测用于MHD患者营养状况的综合评估与定期随访中。

