中性鞘磷脂酶2对缺氧预处理间充质干细胞来源的外泌体生物学特性的影响
卢凯 王香云 罗玉寅
313000 湖州市第一人民医院心内科(卢凯、罗玉寅),神经内科(王香云)
研究发现,干细胞治疗可改善心肌梗死后心功能,可能通过促进梗死周边血管再生、减少心肌细胞死亡来发挥作用[1]。其中,骨髓来源的间充质干细胞(mesenchymal stem cells,MSCs)因其易于获得,免疫排斥较弱,已被广泛用于研究[2]。但干细胞移植后存在凋亡快、归巢率低等弊端,影响其疗效。近年研究发现,干细胞可以分泌外泌体(exosome),它是一种有膜的纳米囊泡,直径30~100 nm左右。外泌体的分泌及其对受体细胞的生物学作用可能在MSCs的旁分泌中扮演重要角色,其可能成为替代干细胞用于治疗心肌梗死的新型生物制剂。外泌体可以减轻组织损伤、提高组织修复[3-4],这可能与它的内含物有关。有报道显示,外泌体包含如细胞因子、蛋白、脂质、mRNA、微小RNA(microRNA,miR)等多种细胞成分[5-8]。外泌体中有益成分越多其生物学作用可能越好,但其内容物的分泌方式目前尚未明确。中性鞘磷脂酶2(neutral sphingomyelinase 2,nSMase2)参与外泌体的分泌过程,但缺氧条件下其对外泌体的影响尚未见报道,为此本研究首次探讨缺氧条件下外泌体内容物分泌的机制。
1 材料与方法
1.1 主要实验仪器与试剂
低温超速离心机(美国,贝克曼);荧光定量PCR仪(美国,ABI);DMEM/F12培养基(Corning);胎牛血清(普飞生物);Matri-gel(BD);RNA提取:TRIzol(Life Technology);GW4869(美国,Sigma-Aldrich)。
1.2 骨髓MSCs的培养和鉴定
取6周龄C57BL/6小鼠下肢长骨骨髓,采用全骨髓培养,传代至第3~4代的小鼠MSCs,采用流式细胞术鉴定细胞表型,包括CD31、CD29、CD34和CD44。
1.3 骨髓MSCs的缺氧预处理
以第3~4代小鼠MSCs作为缺氧预处理对象,分为缺氧预处理组和常氧组,计数相同数量的细胞/培养皿,待细胞充分贴壁12 h后,观察细胞状态,确认细胞状态良好后去除细胞上清,更换为无血清培养基,将缺氧预处理组放置于缺氧培养箱(0.5% O2,5% CO2)48 h,常氧组置于常氧下(21% O2,5% CO2)48 h。抑制nSMase2采用在缺氧预处理组中加入浓度为10 μM GW4869的培养基。
1.4 骨髓MSCs来源的外泌体提取和鉴定
同时收集缺氧预处理组和常氧组培养48 h后条件培养基(细胞上清),通过超速离心法获得外泌体。具体步骤:细胞上清在4℃下多步骤离心:300 g离心10 min、2 000g离心10 min、12 000 g离心30 min,分别去除死细胞、细胞碎片和细胞微泡;收集上清后再使用100 kD超滤管浓缩细胞上清,4 000 g离心15 min;再次收集上清并在超速离心机上4℃ 100 000 g离心1 h,观察沉淀,轻轻弃去上清,用PBS重悬沉淀;之后继续以相同条件离心1 h;获得的最终沉淀用50~100 μl PBS重悬,冻存于-80℃待用及后续鉴定、实验。通过蛋白质印迹实验(Western Blot)检测外泌体表面标记,如CD63和Alix等。通过电镜观察外泌体的典型形态和粒径大小,并用Zetaszier Nano-S90仪器再次验证外泌体的粒径大小。
1.5 小鼠心肌梗死模型的建立和心功能的测定
参照文献[9],采用8周龄雄性C57BL/6小鼠,开胸后结扎冠状动脉左前降支,建立心肌梗死模型。实验分为4组:对照组(Sham组),缺氧预处理来源外泌体组(ExoH组),常氧来源外泌体组(ExoN组)和PBS组。每组实验小鼠20只,实验按双盲进行,结扎后即刻于周围心肌组织中注射外泌体(约收集自2×107MSCs),PBS组注射相同剂量的PBS,分3点注射,10 μl/每点。于心肌梗死术后当天(0 d)、3 d、7 d、14 d和28 d,采用二维M型超声心动图对各组小鼠的心功能进行评价。
1.6 组织学分析
实验按双盲进行,收集心肌梗死后28 d各组小鼠的心脏,用甲醛固定、石蜡包埋,用于后续病理切片。梗死面积评估:以结扎线以下500 μm,对后续的组织切片用Masson’s trichrome染色来显示心肌梗死面积,并用Image-pro Plus软件分析每个心脏切面的梗死区域及整个左心室面积,将梗死区域面积除以整个左心室面积即可得出心肌梗死百分比。
1.7 人脐静脉内皮细胞(human umbilical vascular endothelial cells,HUVECs)管腔形成实验
在铺有BD matrigel的96孔板上接种相同细胞数的HUVECSs,处理分为3组:ExoH组、ExoN组和DMEM/F12组。每隔1~2 h在相差显微镜下观察管腔形成的情况并拍照记录,最后统计管腔长度。
1.8 H9c2心肌细胞凋亡实验
H9c2凋亡实验(TUNEL实验)在6孔板上进行,将H9c2细胞以1×105/孔接种,根据实验分组处理24 h,根据TUNEL试剂盒染色,在荧光显微镜下观察凋亡细胞数,最后计算凋亡率。
1.9 统计学方法

2 结果
2.1 骨髓MSCs来源的外泌体鉴定
传代至第4代的小鼠MSCs通过流式细胞术鉴定,其结果为CD29、CD44阳性,CD31、CD34阴性。在电镜下观察到的外泌体形态类似杯状结构,直径约100 nm(图1A);Western Blot检测显示,外泌体表面相关标记物CD63、Alix均阳性(图1B);此外,通过动态光散射(DLS)分析外泌体的粒径大小,直径亦在100 nm左右,与电镜结果基本相同。
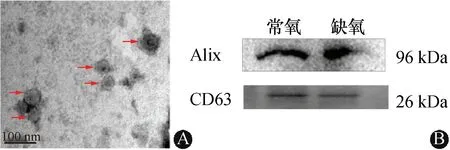
A:电镜下显示外泌体形态类似杯状结构(箭头所示);B:Western Blot检测结果
2.2 缺氧预处理的骨髓MSCs来源的外泌体可保护小鼠心肌梗死后心功能
在小鼠心肌梗死后7、14和28 d,ExoH组小鼠心功能较ExoN组、PBS组均有明显改善,其中28 d时ExoH组小鼠射血分数显著高于ExoN组(44.12%±8.12%比20.73±7.32%,n=20,t=11.95,P<0.05,图2A),并且28 d组织学分析表明ExoH能显著减少心肌梗死后瘢痕面积(各组梗死面积百分比:PBS组55.42%±4.32%,ExoN组44.62%±4.21%,ExoH组34.15%±5.32%,n=8,P<0.05,图2B)。

A:心肌梗死后各组小鼠心功能比较(n=20),与ExoN组比较,aP<0.05,与PBS组比较,bP<0.01;B:心脏组织Masson’s trichrome染色结果显示,ExoH能显著减少心肌梗死后瘢痕面积
2.3 缺氧增加nSMase2的表达可能是由缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)调控的
与常氧下比较,缺氧预处理后,MSCs中的nSMase2的表达明显升高,nSMase2蛋白水平升高约1.5倍,而mRNA水平升高约5.4倍,n=10,P<0.05(图3A)。我们已知Hif-1α可在缺氧状态下被激活并参与重要调控。为进一步研究nSMase2与Hif-1α的关系,我们采用DMOG,一种HIF-1α羟化酶抑制剂,避免Hif-1α在常氧下分解。研究发现,加入DMOG后的MSCs中nSMase2和HIF-1α表达一致性增加,nSMase2和HIF-1α分别升高2.1倍和2.5倍,n=8,P<0.05(图3B),因此考虑nSMase2可能是由HIF-1α调控的。

A:缺氧增加nSMase2的表达;B:DMOG增加HIF-1α和nSMase2的表达
2.4 nSMase2抑制剂GW4869削弱ExoH的促血管新生能力
为进一步明确nSMase2对ExoH的影响,研究引入了GW4869,一种nSMase2抑制剂,同时提取缺氧预处理下加入GW4869的外泌体(ExoH+GW)。研究发现,与ExoN比较,ExoH具有更好的促血管新生能力,但加入GW4869后其作用明显减弱(图4)。

A:HUVECs管腔形成试验显示,ExoH对管腔形成的作用显著;B:HUVECs管腔形成试验分析显示,aP<0.05,bP<0.05,cP<0.01(n=10)
2.5 nSMase2抑制剂GW4869削弱ExoH的心肌细胞保护能力
为进一步探讨nSMase2对ExoH心肌细胞抗凋亡能力的影响,我们对比了ExoN、ExoH和ExoH+GW在H2O2诱导的心肌细胞凋亡实验中的影响。研究发现,与ExoN比较,ExoH具有更好的心肌细胞抗凋亡作用,但ExoH+GW的抗凋亡作用有所减弱,各组凋亡细胞百分比:Medium组30.21%±10.25%,ExoN组19.56%±6.78%,ExoH组12.34%±4.32%,ExoH+GW组24.56%±9.78%,n=8,P<0.05(图5)。
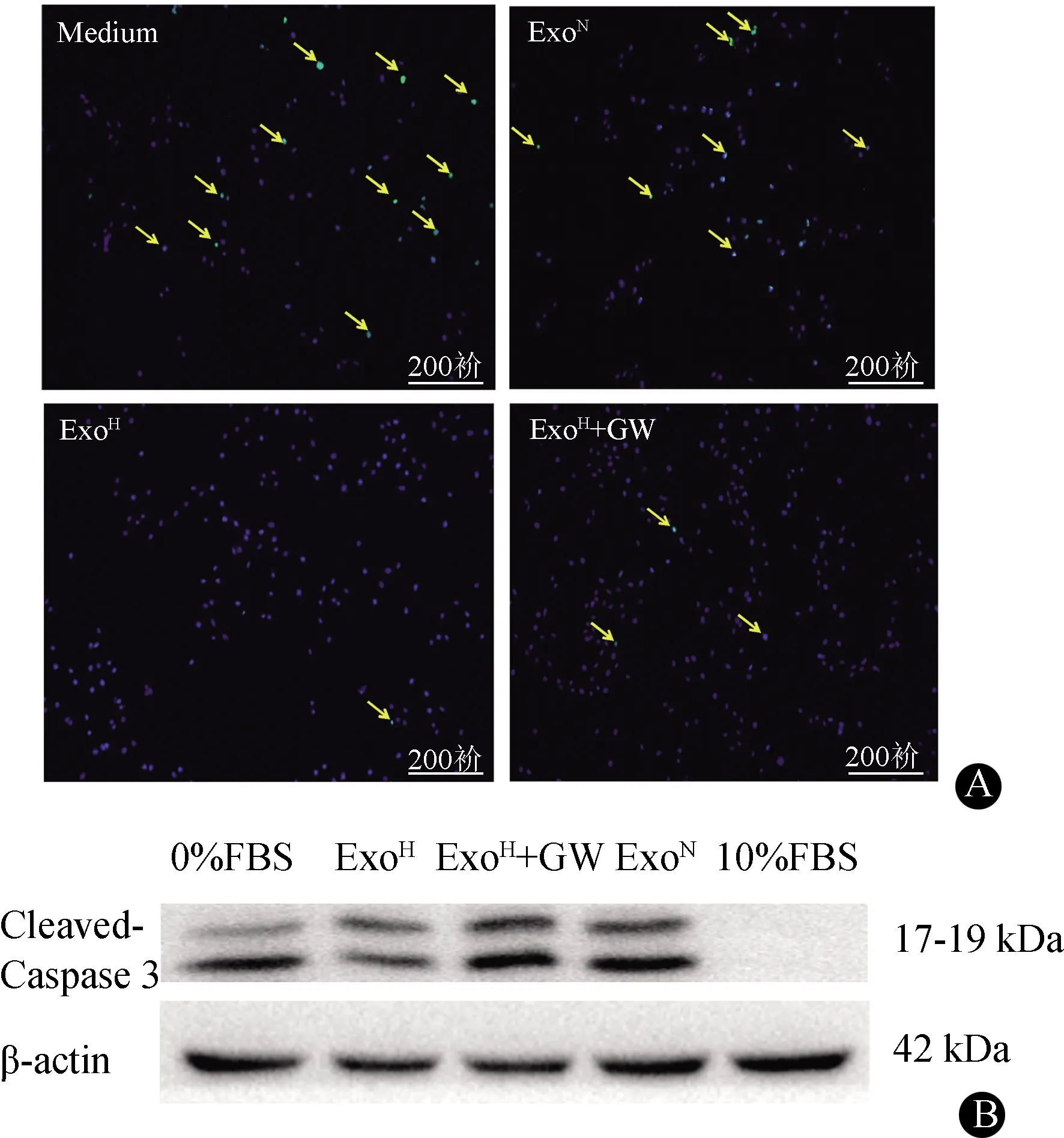
A:TUNNEL染色结果,黄色箭头所示即凋亡的心肌细胞;B:Cleaved-caspase 3蛋白印迹检测结果,ExoH组的凋亡明显减少
2.6 nSMase2可能参与调控ExoH中有益因子的含量
miR-210是一种缺氧调控的miRNA,由HIF-1α特异性调控[10],具有促血管新生[11-13]、抗凋亡[12,14]等作用。研究发现,缺氧预处理后miR-210在细胞上清及外泌体的表达均显著上升,分别约为4.8倍和4.5倍,但加入GW4869后明显降低,分别降低至约0.48倍和0.45倍(n=8,P<0.05)。由此推测,nSMase2调控miR-210经外泌体的转运。
3 讨论
本研究发现外泌体能改善心肌梗死后心功能,并且ExoH组心肌梗死后心功能改善明显。同时发现,缺氧预处理的MSCs中nSMase2的表达升高,其可能是由HIF-1α调控的。并且还发现,nSMase2的升高与ExoH的生物学作用存在一定的相关性,综上可能存在HIF-1α-nSMase2-Exo生物学作用改变的调控信号通路。
最近研究发现,nSMase2可能参与外泌体的形成、释放及miRNA、mRNA、蛋白等经外泌体包装及转运的过程[13,15],但是否对缺氧预处理来源的外泌体有影响未见报道。为进一步探讨nSMase2的作用,我们比较了缺氧调控的miRNA的改变,如miR-210,其是一种缺氧调控的miRNA,在缺氧状态下的细胞或组织中广泛表达[16-17],具有可以调节细胞周期[18-19]、促血管再生、有利于DNA损伤后修复[20-21]、改善线粒体代谢[22-23]、增强细胞抗凋亡能力等作用。本研究发现,缺氧预处理后MSCs分泌的miR-210在条件上清和外泌体中均显著上升,但加入GW4869抑制nSMase2后,细胞条件上清和外泌体中miR-210的表达水平均显著下降。由此推测,nSMase2对ExoH可能通过影响外泌体内有益miRNA的含量来发挥生物学作用。
综上所述,我们发现缺氧预处理条件下MSCs中miR-210等有益因子表达升高,同时nSMase2的表达亦提升,其可能是由Hif-1α调控的。缺氧预处理骨髓MSCs来源的外泌体拥有更好的心脏保护能力,表现在体内实验中改善心肌梗死后小鼠心功能,体外实验中具有更好的促管腔形成、增加心肌细胞抗凋亡能力等方面。可能的原因是在缺氧预处理条件下,MSCs中miR-210等有益因子的表达增加,同时nSMase2的表达增加有利于miR-210等有益因子经外泌体的包裹及释放来发挥生物学作用。本研究也证实了缺氧预处理是一种有效、安全的方式,可提升干细胞来源的外泌体对心肌梗死动物模型的生物疗效,可为今后用于优化外泌体替代治疗疗效的一种方法,但由于本研究存在一定局限性,样本量少及检测的微小RNA相对单一,因此需要进一步研究。
利益冲突:无

