第69例:临床表现进行性加重的呼吸困难
黎婧怡 刘颖娴 方理刚
100730 中国医学科学院 北京协和医学院 北京协和医院心内科
患者男性,59岁,因“呼吸困难3年余,加重1 h”,于2019年10月11日就诊急诊抢救室。患者自2016年始无诱因出现活动耐量下降,活动中胸闷、呼吸困难,否认发热、胸痛,当地医院诊断“胸腔积液、低蛋白血症”,考虑结核性胸膜炎,予三联抗结核治疗1年余,症状无明显改善,因血肌酐升高2018年自行停用抗结核治疗。2019年2月患者无明显诱因胸闷加重,并逐渐出现双下肢水肿、夜间不能平卧、端坐呼吸。2019年5月当地医院查血常规:白细胞、血小板正常,血红蛋白97 g/L;血涂片正常;血生化:转氨酶、胆红素正常,白蛋白31.9 g/L,肌酐172.9 μmol/L;血沉79 mm/第1小时,C反应蛋白60.90 mg/L;N末端B型利钠肽原(NT-proBNP)1 220 pg/ml;B型利钠肽(BNP)156.8 ng/L;心电图大致正常;超声心动图示左房增大(左房前后径47 mm),余房室大小正常,室间隔及左右室壁厚度、回声正常,运动协调,收缩幅度正常,左室射血分数(LVEF)59%,各瓣膜结构正常,少量心包积液;胸部CT示双侧胸腔积液;腹部超声示右肾略小,双肾弥漫性改变。外院予静脉输注白蛋白、利尿等治疗后症状无明显好转,且水肿由双踝部逐渐扩大至双侧大腿,并出现双侧眼睑水肿,遂于2019年10月11日就诊我院门诊。1小时前行腹部超声检查时因屏气时间较长,出现胸闷、呼吸困难加重,无明显胸痛,遂就诊急诊。既往诊断高血压10年余,血压最高180/110 mmHg,平日口服厄贝沙坦及利尿剂控制血压在140/80 mmHg左右;诊断糖尿病20余年,平日胰岛素注射降糖,未规律监测。否认吸烟饮酒史。否认心脏病家族史。查体血压159/86 mmHg,心率97 次/min,氧饱和度99%(鼻导管吸氧4 L/min),眼睑轻度水肿,舌体无肥大,双肺可闻及少许湿啰音,心律齐,各瓣膜听诊区未闻及病理性杂音,大血管未闻及杂音,四肢动脉搏动对称,腹软无压痛,移动性浊音可疑阳性,双下肢中重度水肿。急诊查血气:pH 7.22,二氧化碳分压60 mmHg,氧分压 73 mmHg,血钾4.6 mmol/L,血钠144 mmol/L,乳酸0.9 mmol/L;血常规白细胞、血小板正常,血红蛋白115 g/L,为正细胞正色素性贫血;血生化:转氨酶、胆红素正常,白蛋白30 g/L,肌酐118 μmol/L;NT-proBNP:5 634 pg/ml;凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原及D-二聚体正常,甲状腺功能正常。予吸氧、硝酸甘油泵入后症状未明显缓解,监测心电图V1~V6导联T波倒置、双向(图1);心肌标记物:肌酸激酶(CK)49→67 μg/L,肌酸激酶同工酶(CK-MB)0.9→3.3 μg/L,肌钙蛋白I(cTnI)<0.017→0.931 pg/ml,肺动脉CT血管造影未见肺栓塞,主动脉CT血管造影未见夹层。考虑急性非ST段抬高型心肌梗死,行冠状动脉造影未见明确狭窄。
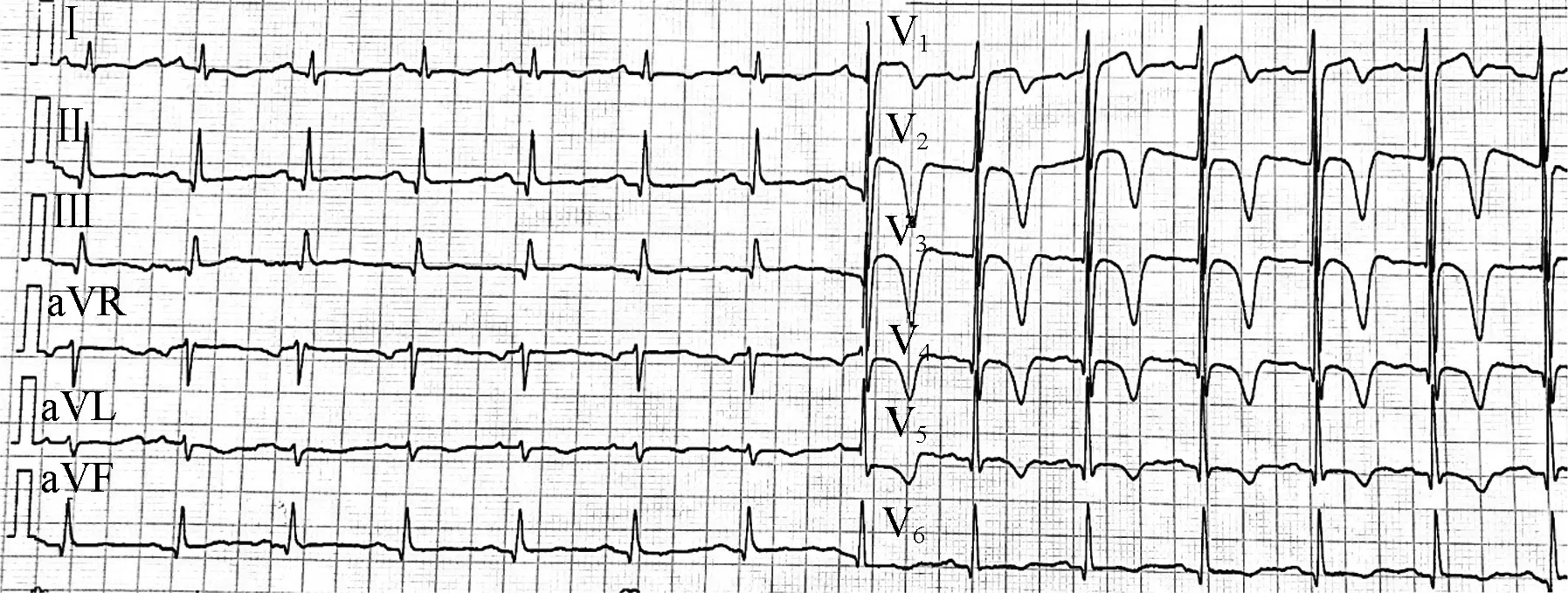
图1 2019年10月11日急诊心电图示V1~V6导联T波倒置、双向
分析患者中年男性,表现为贫血、低蛋白血症、多浆膜腔积液、肾功能不全及心力衰竭,有长期的高血压和糖尿病,是心衰的高危人群,长期糖尿病及高血压似乎是患者射血分数保留心衰的可能原因,但BNP或NT-proBNP只轻度升高,心衰程度不能完全解释严重的水肿以及反复的胸腔积液,因此长期的低蛋白血症可能是重要因素。此次患者就诊表现为急性左心衰,并出现与以往不同的T波明显倒置的异常心电图改变,心肌酶升高超过参考值上限的99百分位,因此符合急性心肌梗死诊断标准。因冠脉造影未见冠脉狭窄、阻塞,故诊断冠状动脉非阻塞性心肌梗死(myocardial infarction with non-obstructive coronary arteries,MINOCA)[1]。MINOCA是一组多种病因引起的异质性疾病。MINOCA的病因方面,需考虑冠脉相关病因和非冠脉相关病因。其中,冠脉相关病因包括动脉粥样硬化斑块破裂或糜烂、冠脉痉挛、自发夹层、急性主动脉夹层累及冠脉、微循环异常、冠脉血栓形成、冠脉栓塞。非冠脉相关病因又可以进一步细分为心脏疾病相关及非心脏疾病相关,其中,心脏疾病相关病因包括心肌炎、应激性心肌病、其他心肌病、心脏外伤、剧烈运动、快速型心律失常、药物或毒物导致的心脏损伤,非心脏疾病相关病因包括脑卒中、肺栓塞、败血症、成人呼吸窘迫综合征、终末期肾衰竭等。根据患者节段性室壁运动异常范围是否符合单支冠脉分布区域,又可划分为“心外膜模式”和“微血管模式”。综合患者的病史及辅助检查,目前无肺栓塞、主动脉夹层累及冠脉相关证据。
入院后查尿常规+沉渣正常,24 h尿蛋白0.56 g;BNP 822 ng/L;低密度脂蛋白胆固醇2.72 mmol/L;血涂片、蛋白C、蛋白S、抗凝酶Ⅲ、凝血因子、狼疮抗凝物、抗磷脂抗体谱等易栓症筛查均阴性。肿瘤标记物阴性。超声心动图示左心增大(左房前后径47 mm,左室舒张末内径56 mm),室间隔及左室后壁厚度正常,室间隔中下段及心尖部、后侧壁无运动,LVEF 34%,各瓣膜形态结构及启闭正常,血流速度未见明显增快,左室松弛功能减低,少量心包积液;心脏磁共振示左心增大,室间隔基底段-中段局部心肌稍厚,舒张末期约13~14 mm;左室运动弥漫减弱,以中下段显著(LVEF=43.9%),心肌信号未见明显异常,室间隔、左室侧壁基底段及中间段心肌中层多发延迟强化,心包积液及双侧胸腔积液;心肌断层显像(静态+门控):左室大,心尖、前壁心尖部血流灌注减低。胸腹盆增强CT示双侧胸腔积液并双肺下叶部分不张,双侧胸膜明显增厚。双肾形态饱满并双侧肾周筋膜增厚;肠系膜脂肪密度增高;腹、盆腔积液。胰腺饱满,密度不均,强化不均。
分析患者超声心动图提示室间隔中下段及心尖部、后侧壁无运动,病变范围广,不符合单支冠脉分布域,考虑为“微血管模式”引起MINOCA,可能病因需考虑微血管痉挛、心肌炎、应激性心肌病、其他心肌病、心脏外伤、剧烈运动、快速型心律失常、药物或毒物导致的心脏损伤等。患者5个月前LVEF正常,此次发生射血分数减低的心衰,表明病情出现明显的变化,患者突发的心衰及室壁运动出现中下段为主的减低,并非高血压和糖尿病能够很好解释,患者室壁运动异常范围超过单一冠脉支配区,肌钙蛋白只轻度升高,似乎较为符合应激性心肌病的表现,但应激性心肌病很少出现多发心肌中层的延迟强化,需要观察心肌运动短期恢复的情况。患者的其他器官包括胸膜、肾脏、胰腺等损害的原因需要进一步明确,是否心脏受累也是某种疾病的一个表现?
追问病史,患者无明确毒物、放射性物质接触史,否认违禁药物服用史。否认口眼干、光过敏、皮疹、关节痛、肌痛、雷诺现象、反复口腔外阴溃疡等免疫病表现,查抗核抗体谱、抗中性粒细胞胞浆抗体、抗磷脂抗体谱等自身抗体筛查均阴性,考虑自身免疫性疾病可能性小;外院及我院检查,结核抗体、结核菌素试验、(1,3)-β-D-葡聚糖试验、曲霉半乳甘露聚糖试验、巨细胞病毒核酸及抗体、EB病毒核酸及抗体等均阴性,无结核及其他细菌、真菌、病毒感染证据;内分泌筛查方面,甲状腺功能正常,甲状旁腺素正常,生长激素、血总皮质醇、24 h尿游离皮质醇、促肾上腺皮质激素均正常。糖化血红蛋白5.5%。性激素6项:卵泡刺激素(FSH)33.60 IU/L,孕酮(P)<0.08 ng/ml,睾酮(T)0.15 ng/ml,黄体生成素(LH)24.22 IU/L;血清蛋白电泳未见M蛋白,血清免疫固定电泳及游离轻链检查未见明显异常;血清免疫球蛋白G亚类测定均正常。炎症标记物升高,包括高敏C反应蛋白39.79 mg/L,血沉36 mm/第1小时,白细胞介素6 14.6 pg/ml,肿瘤坏死因子α 12.6 pg/ml。PET/CT未见实体肿瘤证据,双侧股骨成骨性改变,周围软组织代谢增高;腹膜、大网膜增厚,双肾饱满,心包积液,胸膜增厚,上颌窦内粘膜增厚,均有代谢弥漫性增高。全身骨显像示左侧上颌骨、右侧下颌骨、右侧桡骨远端、双侧股骨头、双侧股骨远端、双侧胫骨近端、双侧胫骨远端见放射性摄取增高区。
分析患者无毒品滥用,无重金属、特殊药物(化疗药物等)史,故不考虑毒性损害引起心肌病变。亦无感染及自身免疫病证据;无肿瘤直接浸润或转移及轻链型淀粉样变证据。除糖尿病外,无甲状腺疾病、甲状旁腺疾病、肢端肥大症、生长激素缺乏、肾上腺皮质醇增多症、嗜铬细胞瘤等表现。因此从病史及实验室检查判断,毒性损害、免疫介导和炎症损害、浸润性疾病、代谢紊乱、遗传异常等因素引起心肌病变均缺乏有力的证据。
患者胸腹盆CT可见双肾周筋膜明显增厚,需考虑腹膜后纤维化可能。70%的腹膜后纤维化患者为特发性腹膜后纤维化,部分为免疫球蛋白G4亚型相关,继发性腹膜后纤维化病因需考虑药物因素(麦角衍生物、β受体阻滞剂、甲基多巴、肼屈嗪、镇痛药和生物制剂等)、肿瘤性疾病、感染、放疗、手术、组织细胞增多症、Erdheim-Chester病(Erdheim-Chester disease,ECD)、淀粉样变等。结合患者的系列实验室检查,患者存在心脏、胸膜、肾脏、胰腺、上额窦、骨骼、腹膜后纤维化等多器官损害,需考虑存在系统性疾病。患者多系统受累,尤其存在多发长骨骨干的双侧对称性骨硬化表现,而无感染性疾病、实体肿瘤、自身免疫病表现,因此应考虑ECD可能。
ECD由Erdheim和Chester于1930年首次报道,是一种罕见的非朗格汉斯组织细胞疾病,发病率<5/百万,多见于成年人,男性稍多于女性。ECD的病理基础是富含脂质的组织细胞浸润各器官。最常见的特征是多发的长骨骨质硬化性病变(发生率占95%),伴或不伴骨外组织细胞浸润。临床表现从无症状到致死性的系统疾病,可涉及几乎所有脏器。当症状局限时,患者可仅表现为下肢骨疼痛。几乎一半以上的患者会出现骨外多系统疾病表现。心脏受累是预后不良的首要因素,主要表现包括心包心肌浸润、心房或房室沟肿物,可出现心衰、心肌梗死、瓣膜病、房室传导阻滞、病理性Q波等表现。超过50%的患者出现BRAF V600E基因突变,90%的患者出现MAPK/ERK通路相关基因突变。常见受累脏器见表1,其中,当病变侵犯肾周筋膜时,CT表现为双侧对称的肾周软组织密度影,边界不规则,呈特征性“毛发肾征”(hairy kidney)表现(图2A);当病变包绕整段主动脉时,CT可表现为特征性“主动脉鞘征”(coated aorta)(图2B)。如临床遇到可疑病例,建议行18F-FDG PET/CT检查,评估受累组织范围,再行受累组织活检,并完善组织BRAF V600E突变基因检测,可考虑行MAPK通路或其他突变测序。ECD的典型病理表现是大量泡沫样(黄瘤)组织细胞浸润,间杂炎症细胞和多核巨细胞浸润。ECD细胞表达组织细胞标志物CD68、CD163,不表达CD1a和S100,可通过细胞形态学及免疫组化与朗格汉组织细胞增多症鉴别。此外,需要与IgG4相关性疾病、淋巴瘤、髓系肉瘤、结核感染等疾病鉴别。治疗方面,尚无标准治疗方案,目前最为常用的药物是干扰素a,干扰素治疗的患者5年总生存率约为70%,因多数患者检测出组织中BRAF V600E突变,BRAF抑制剂威罗非尼也越来越广泛地被应用于ECD的治疗[2]。

A:肾周软组织密度影,为“毛发肾”征(箭头所示);B:“主动脉鞘”征(箭头所示)

表1 ECD常见受累脏器及发生概率
患者进一步接受心包活检术,共引流出血性心包积液500 ml,心包积液未见瘤细胞。心包活检病理诊断:(心包)纤维、脂肪组织显慢性炎,间质可见灶性、条索状及巢状泡沫细胞浸润,病变不除外Erdheim-Chester病;(脂肪)脂肪组织未见特殊。免疫组化结果:CD163(组织细胞+),CD68(组织细胞+),Cyclin D1(局灶+),Ki-67(index 1%),CD1a(-),Langerin(-),S-100(-)。心包活检组织基因提示BRAF V600E突变阳性。经托拉塞米、托伐普坦等利尿后双下肢水肿消退,夜间可平卧,活动耐量较前明显恢复。培哚普利2 mg/d,螺内酯20 mg/d抗心室重构,因患者出现肌酐、血钾升高,暂停用,予美托洛尔142.5 mg/d抗心衰及控制血压。因存在BRAF V600E突变,故应用BRAF抑制剂维莫非尼(Vemurafenib)480 mg每日2次口服治疗原发病,未再诉呼吸困难。
本例提示,对于MINOCA、心衰伴多器官受损患者,要进行全面的病因筛查,从一元论角度寻找可以解释病情全貌的病因,必要时需行活检病理进一步明确诊断。当患者出现心脏或主动脉及分支、冠脉或肾动脉等受累,合并对称的长骨病变、肾周软组织浸润时,需考虑ECD可能。
利益冲突:无

