TaERFL1a转录因子在小麦籽粒淀粉合成中的功能研究
高 天,徐梦军,李鸽子,康国章,2
(1.河南农业大学农学院,河南郑州 450002;2.河南农业大学国家小麦工程技术研究中心,河南郑州 450002)
高等植物在长期进化过程中形成了一个复杂的网络系统以调控逆境胁迫和物质合成。AP2/ERF类转录因子约由60个氨基酸残基组成,包含1个α-螺旋和3个反向平行β-折叠的DNA保守结构域,β-折叠可与顺式作用元件发生特异性结合,调控基因表达[1]。研究表明,AP2/ERF类家族转录因子参与了花器官发育、非生物及生物胁迫和物质合成等过程[2-4]。
淀粉是小麦籽粒最主要的组分,约占籽粒干重的65%~80%,其含量是小麦产量的决定因素。目前已开展了大量有关淀粉合成相关酶基因的表达和功能研究[5],但有关控制这些酶基因表达的分子调控网络尚未建立[6]。Wang等[7]发现,水稻OsbZIP58转录因子与COsAGPL3、OsGBSSI(Wx)、OsSSIIa、OsSBE1、OsBEIIb和OsISA2的启动子相结合,调控水稻籽粒淀粉的合成;Zhang等[8]、Chen等[9]、Huang等[11]研究发现,玉米转录因子ZmaNAC36、ZmbZIP91和ZmEREB156可调控多个淀粉合成相关基因的表达;Li等[11]发现,ERF类转录因子ZmEREB94调控玉米籽粒淀粉合成相关基因的表达,参与玉米淀粉的合成。Liu等[4]发现,AP2/EREBP转录因子TaRSR1通过负向调控小麦籽粒淀粉合成相关基因的表达,影响了籽粒淀粉合成。
本课题组前期研究表明,TaERFL1a转录因子参与小麦响应干旱、冷害等非生物胁迫调控[12-13],但该转录因子是否参与小麦籽粒淀粉合成尚不清楚。本研究在田间生长条件下采用BSMV-VIGS技术,以探究TaERFL1a转录因子在小麦籽粒淀粉合成中的功能。
1 材料与方法
1.1 试验材料
供试小麦品种百农207由河南科技学院欧行奇教授提供,2016年10月12日在河南农业大学科教示范园区(郑州,34°92′ N,112°99′ E)种植,按照常规高产田进行种植管理。载体BSMV-α、-β和-γ由中国科学院遗传与发育生物研究所王道文研究员馈赠。
MulⅠ、SpeⅠ、BssHⅡ、PacⅠ和NotⅠ等限制性内切酶购自NEB公司;2×Taq Plus Master Mix购于Vazyme公司;T载体、T4 DNA ligase连接酶、反转录试剂盒(PrimeScriptTMII 1st Strand cDNA Synthesis Kit)、qRT-PCR荧光定量反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,Prefect Real Time)购自TaKaRa公司;体外转录试剂盒(RiboMAXTMLarge Scale RNA Production Systems-T7)和Ribo m7G Cap Analog购于Promega公司;Trizol购自于鼎国生物有限公司;0.08 mm PVC薄膜购于上海恩尔塑业有限公司。
用Primer 5.0设计PCR引物,引物合成和基因测序均由北京六合华大基因公司完成。
1.2 BSMV-VIGS载体的构建和病毒的产生
选取TaERFL1a基因CDS中非AP2/ERF保守域,但在ABD 3个拷贝同源性较高(98.4%)的一段序列,同时沉默3个拷贝而不影响其它家族成员(图1),片段长239 bp,用特异性引物扩增,构建BSMV-VIGS-TaERFL1a重组载体。引物序列为:5′-CCTTAATTAAGCGGCGGCAT GCG-3′(PacI)和5′-TATGCGGCCGCCAAC GACCGACGAG-3′(NotI),扩增产物纯化后连入T载体(TaERFL1a-T)并测序验证。用PacI和NotI限制性内切酶分别酶切BSMV-γ和TaERFL1a-T载体,片段纯化回收后以T4连接酶连接,构建BSMV-VIGS-TaERFL1a沉默载体,酶切并测序验证,载体构建过程参考Ma等[14]的方法。以沉默报告基因绿色荧光蛋白(green fluorescent protein,GFP)载体(BSMV-VIGS-GFP)为对照[4]。

虚线表示AP2/ERF保守结构域,实线表示用于VIGS沉默片段。
将BSMV-α、BSMV-β、BSMV-VIGS-TaERFL1a和BSMV-VIGS-GFP分别用限制性内切酶MulⅠ、SpeⅠ和BssHⅡ进行充分酶切线性化,纯化线性化产物用RiboMAXTMLarge Scale RNA Production Systems-T7体外转录试剂盒进行体外转录,将转录得到的RNA进行检测,-80 ℃保存,接种前在冰上将体外转录的BSMV-α、BSMV-β、BSMV-VIGS-TaERFL1a或BSMV-VIGS-GFP等比例混合,用DEPC处理水稀释1倍,按照每2.5 μL混合液与45 μL FES缓冲液的比例混合生产BSMV病毒,用于田间摩擦接种。
1.3 TaERFL1a基因沉默小麦植株的获得
在小麦抽穗期选取生长状态一致的小区,构建塑料拱棚(2.9 m宽×5 m长×1.7 m拱高)。在小麦抽穗期(2017年4月17日)选择生长一致的50个主茎穗。接种的前1 d,塑料拱棚覆盖PVC透明薄膜,保持适宜温度和较高的湿度。病毒接种部位为小麦即将开花的穗部,取20 μL混合物点加在戴有乳胶手套的食指上,与拇指轻轻接触,从穗基部直至穗尖摩擦接种,另一只手扶好第二穗基部,防止扯断穗。接种后喷少许DEPC处理水,用保鲜膜包裹保温保湿,1 d后取掉保鲜膜;同时,大棚覆盖PVC薄膜,提高接种率。在接种后15 d开始每天观察穗部以及颖壳是否出现病毒表型。
1.4 TaERFL1a基因沉默小麦籽粒鉴定
接种后23 d出现明显病毒表型,分别取BSMV-VIGS-TaERFL1a和BSMV-VIGS-GFP浸染后有病毒表型的穗部籽粒,立即放入液氮速冻。采用Trizol法提取籽粒总RNA,参照qRT-PCR反转录试剂盒说明书的方法,检测TaERFL1a基因转录水平。TaERFL1a基因的定量引物序列为:5′-GCCAAGGACCTCGTTAGAAAG A-3′和5′-GGCCCGTTCAGATCCAGAT-3′,扩增片段长度为 154 bp。分别以Actin(GenBank accession No.AB181991)和GAPDH(GenBank accession No.EU022331)为内参基因,Actin引物序列为:5′-AGCGGTCGAACAACTGGTA-3′和5′-AAACGAAGGATAGCATGAGGAAGC-3′,片段扩增长度为101 bp;GAPDH引物序列为: 5′-TTTTCACCGACAAGGACA-3′和5′-AAGAGGAGCAAGGCAGTT-3′,片段扩增长度为179 bp。TaERFL1a基因表达水平用2-ΔΔCt法进行计算,各样品均进行3次生物学重复,以三次生物学重复均值表示最终结果。用统计学软件SPSS 17.0分析数据显著性。
接种后23 d、26 d、30 d和35 d,分别取小麦穗部及穗中部籽粒的表型进行鉴定。小麦成熟后,收获TaERFL1a基因沉默和对照小麦的成熟籽粒,随机取部分籽粒用于籽粒形态及淀粉相关指标的测定。采用双波长法测定基因沉默植株和对照植株籽粒中淀粉含量[15]。另选取60粒种子,每10粒为一组,对籽粒的长度和宽度进行测定。通过计算3组百粒重来评价籽粒的千粒重。以上所有数据均进行3次生物学重复,用SPSS 17.0分析数据显著性。以BSMV-VIGS-TaERFL1a和BSMV-VIGS-GFP沉默小麦中的成熟籽粒为材料,横向切割后,用导电胶带固定,离子溅射仪(HITACHIE-1010,日本)喷金后,在扫描电镜(HITACHI S-3400N-Ⅱ,日本)下拍照,观察小麦胚乳淀粉粒形态。
2 结果与分析
2.1 TaERFL1a基因沉默植株的获得
将BSMV-VIGS-TaERFL1a和BSMV-VIGS-GFP病毒分别接种在即将开花的小麦穗部。接种23 d后,穗部和穗下节均出现大麦条纹花叶病病毒表型(图2A),表明病毒已成功感染麦穗。用qPCR检测了接种后23 d穗部有病毒表型的籽粒中TaERFL1a基因的表达量,结果显示,接种BSMV-VIGS-TaERFL1a植株的籽粒,TaERFL1a的表达量显著低于对照植株,降幅为 67.3%~ 93.4%(图2B和C),表明接种BSMV-VIGS-TaERFL1a病毒的籽粒内TaERFL1a基因的表达被显著抑制,获得TaERFL1a基因沉默的小麦植株。
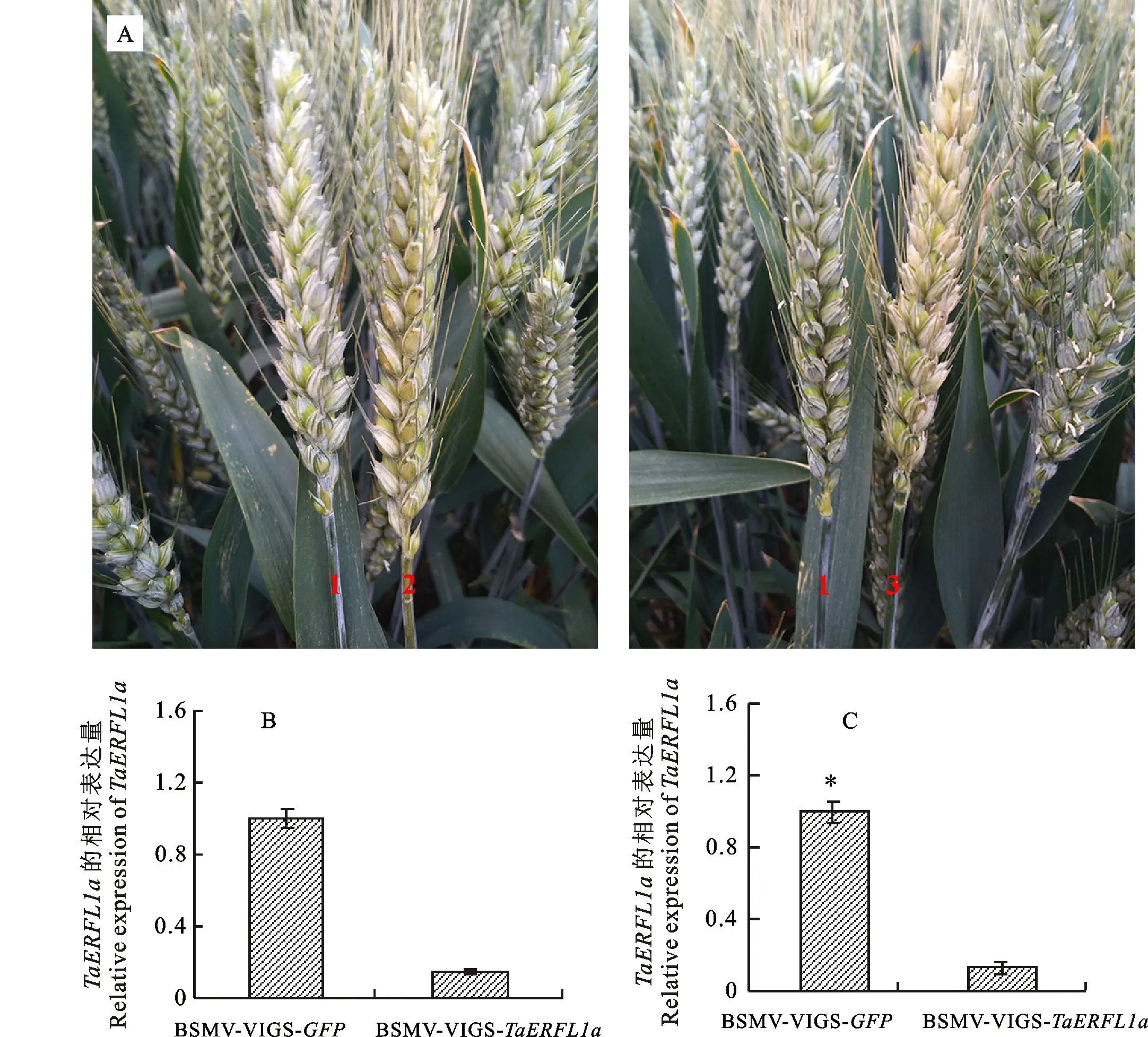
2A中1、2和3分别表示未接种小麦穗、接种BSMV-VIGS-GFP和接种BSMV-VIGS- TaERFL1a的小麦穗部;2B和2C分别表示用Actin和GAPDH为内参基因对 TaERFL1a转录水平的计算结果。*表示接种BSMV-VIGS-GFP与接种BSMV-VIGS- TaERFL1a的差异达到显著水平(P<0.05)。
2.2 TaERFL1a在小麦籽粒淀粉合成中的功能
与接种BSMV-VIGS-GFP植株相比,接种BSMV-VIGS-TaERFL1a的小麦植株的穗部表型没有显著的变化,但TaERFL1a基因沉默植株成熟籽粒偏小,充实度低,籽粒干瘪(图3)。定量测定结果表明,接种BSMV-VIGS-TaERFL1a的小麦成熟籽粒的粒长、粒宽、千粒重和淀粉含量均显著降低,分别降低了5.22%、12.70%、9.53%和5.43%(表1)。

表1 接种BSMV-VIGS-GFP和BSMV-VIGS- TaERFL1a小麦植株的成熟籽粒和淀粉性状

dpi:病毒接种小麦穗部后的天数。
电镜扫描结果显示,TaERFL1a基因沉默植株籽粒和对照小麦籽粒胚乳中淀粉粒存在较大差异。TaERFL1a基因沉默植株籽粒中胚乳大颗粒的A型淀粉数目与对照无明显差异,淀粉粒排列松散,但小颗粒的B型淀粉数目显著减少(图4),表明TaERFL1a可能通过影响B型淀粉粒的形成而影响淀粉的合成。

图4 接种病毒植株成熟籽粒胚乳扫描电镜的观察结果
3 讨 论
黄淮地区是我国冬小麦的主产区,该区冬小麦分蘖基本能够满足成穗数需求,且多花多粒的优势明显,有利于形成大穗多粒,但由于该区小麦灌浆期常出现不利天气,导致灌浆期较短(35 d左右),使许多小麦品种高粒重潜力难以得到充分发挥,因而制约了产量的进一步提高[16]。目前,黄淮地区大面积推广的小麦品种的千粒重潜力大多在48 g以上,但在实际生产中,这些品种的千粒重常年在42 g以下,饱满度较差,因此,仅粒重这一个指标,这些品种增产潜力可达900 kg·hm-2以上(以千粒重增加1 g,每公顷增加150 kg计算)。淀粉是小麦籽粒最重要的组分,因此,提高粒重主要在于提高籽粒淀粉的合成能力。
转录因子是生物信号转导途径中重要成员,它能与一个或数个功能基因的启动子相结合,从而调控下游一系列基因的表达,比调控单一功能基因能获得更好的效果,因此成为近年来研究的热点[17]。作物籽粒淀粉相关研究主要集中在功能基因方面,而对调控功能基因表达的转录因子报道较少,且集中在水稻和玉米方面[17]。本研究结果显示,抑制TaERFL1a转录因子表达后,小麦籽粒的粒长、粒宽和千粒重均显著降低,表明TaERFL1a转录因子影响小麦籽粒的粒重。进一步研究发现,TaERFL1a基因沉默植株籽粒淀粉含量显著降低,表明抑制该基因的表达能显著影响淀粉的合成;电镜观察结果显示,TaERFL1a可能通过影响籽粒中B型淀粉粒的形成参与了淀粉的合成,进而影响了粒重。已有研究发现,水稻中OsbZIP58转录因子能够结合SBE1的启动子,通过调控SBE1表达参与淀粉的合成[7];玉米中ZmbZIP91转录因子直接结合AGPS1、SSI、SSIIIa和ISA1基因上游启动子特异元件,调控其表达,影响玉米淀粉的合成[9];小麦中ERF转录因子通过特异结合靶基因启动子区域的GCC-box或DRE/CRT元件来调控下游靶基因的表达[18]。因此,推测本研究中小麦TaERFL1a转录因子可能与淀粉合成相关基因启动子序列上的特异性顺式作用元件相结合,从而调控了它们的表达,参与了小麦籽粒淀粉合成。

