甲磺酸伊马替尼与高三尖杉酯碱联合抗慢性粒细胞白血病作用
殷世亮,张弘,尹树铸,,昌盛,代泽成,周雅玲,张逍遥,王奕霖,康子安
(1. 沈阳医学院药学院,辽宁 沈阳 110034;2. 沈阳药科大学生命科学与生物制药学院;3. 吉林化工学院)
高三尖杉酯碱(homoharringtonine,HHT)、三尖杉酯碱(harringtonine,HT)、异三尖杉酯碱(isoharringtonine,IHT)是从我国特有植物粗榧、海南粗榧中提取的生物碱,其中HHT 抗肿瘤活性最强[1-2]。20 世纪 70 年代我国率先将 HHT 应用于急性白血病的临床治疗。现有的研究表明HHT 及其衍生物能够抑制白血病细胞蛋白质和核酸的合成[3-4]。慢性粒细胞白血病(chronic myelogenous leukemia,CML)是起源于骨髓内以粒系细胞增生为主要表现的血液系统恶性克隆性疾病。超过90%的CML 患者存在Philadelphia 染色体,并特异表达具有酪氨酸激酶(TPK)活性的BCR/ABL 融合蛋白,以甲磺酸伊马替尼(Imatinib)为代表的靶向作用于BCR/ABL 融合蛋白的酪氨酸激酶抑制剂(TKIs)的临床应用,使得CML 的治疗发生了根本性转变,并成为治疗 CML 的首选药物[5-6]。本研究将 BCR/ABL 蛋白激酶抑制剂 Imatinib 与HHT 联合给药,考察二者合用在CML 细胞中的抗白血病作用,希望为临床治疗CML 患者提供更为合理有效的治疗方案。
1 材料与方法
1.1 实验材料 HHT(北京协和药厂);Imatinib(美国Sigma 公司);胎牛血清(澳大利亚Clark 公司);RPMI-1640 培养基(美国 Hyclone 公司);人类CML 细胞系KCL22 细胞(美国ATCC 公司);4′,6-二脒基-2-苯基吲哚(DAPI,100 ng/ml)、碘化丙啶(PI)(日本 Wako 公司);兔抗 PARP(poly-(ADP-ribose)-polymerase)单克隆抗体(美国 Abcam 公司);鼠抗 anti-β-actin 单克隆抗体(美国Santa Cruz 公司);兔抗Mcl-1 单克隆抗体(美国BD 公司);增强型ECL 化学发光试剂盒(德国Merck 公司);蛋白定量试剂盒(碧云天公司)。
1.2 细胞培养 将人类CML 细胞系KCL22 细胞培养于37 ℃、5%CO2的饱和湿度培养箱中。所用RPMI-1640 培养基中加入 10%(v/v)经加热灭活的胎牛血清,100 U/ml 青霉素和 100 U/ml 链霉素混合双抗,以及1 mmol/L 谷氨酰胺。
1.3 DAPI 荧光染色法进行细胞凋亡的形态学观察 复筛的细胞连续生长至对数生长期,将细胞接种于 6 孔板中,以每孔 2×105/ml 的细胞密度接种KCL22 细胞,每孔加入4 ml 培养基。采用相应浓度药物处理相应时间后,取2 ml 细胞悬液,2 000 r/min,离心 3 min,弃去细胞上清液,重悬于 200 μl 冰预冷的磷酸盐缓冲液(PBS)中。将细胞悬液加入带有滤纸片的载玻片套管中离心制片,1 000 r/min,离心 3 min,室温放置 20 min 固定,然后加入 DAPI 染料 50 μl,用盖玻片封片,染色10 min。在荧光显微镜360 nm 激发波长下记录并观察KCL22 细胞的染色情况和细胞形态学改变。细胞呈现DAPI 着色蓝色荧光并出现核皱缩、断裂、边缘化、发泡、发芽及凋亡小体等典型凋亡形态的细胞被认为是早期凋亡细胞。细胞若呈现较弱DAPI 着色蓝色荧光,细胞膨大破损,说明细胞已经死亡,为坏死细胞或晚期凋亡细胞。
1.4 细胞PI 单染的流式细胞术(FCM)检测KCL22 细胞分别经 0.2 μmol/L HHT 和 0.2 μmol/L Imatinib 处理 24 h 后离心收集细胞(3×106个),经冰预冷的 PBS 洗涤,用 500 μl PBS 重悬细胞,加入50 ml 冰预冷的75%乙醇固定,过夜。离心收集细胞,PBS 洗涤后于 500 μg/ml 的 RNase 溶液中37 ℃孵育 30 min,加入 PI 染色液染色 10 min。制备样品中DNA 含量采用流式细胞术检测,测定吸收波长为625 nm,激发波长为488 nm。横坐标代表细胞染色荧光发射强度即DNA 的含量,纵坐标代表所采集细胞的总数。检测所得数据采用FCM分析系统软件(Becton Dickinson)进行分析处理。
1.5 Western blot 法检测 通过Western blot 法考察了HHT 和Imatinib 单独和联合给药后KCL22 细胞凋亡指示蛋白PARP 蛋白的活化裂解情况,以及Mcl-1 的蛋白表达水平。样品细胞总蛋白(200 μg)通过RAPA 细胞裂解缓存液裂解得到,采用蛋白定量试剂盒定量蛋白,通过Bio-Rad 垂直凝胶电泳分离蛋白,并将总蛋白通过转印半干转移系统转印到硝酸纤维素膜上,采用含有5%脱脂奶粉的TBST 缓冲液孵育1 h,将硝酸纤维素膜与相应特异性单克隆抗体于4 ℃孵育过夜。采用TBST洗涤3 次后,与相应抗体对应的二抗室温孵育1 h后TBST 洗涤1 次,经增强型化学发光试剂(ECL Kit)孵育10 min 后于蛋白凝胶显色系统(Bio-Rad)显色并进行图形采集。
1.6 统计学方法 采用SPSS 15.0 软件进行统计学分析。所得数据以均数±标准差表示,多组间比较采用One-way ANOVA,两两比较采用q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Imatinib 和HHT 联合给药诱导KCL22 细胞凋亡的形态学观察 通过细胞核荧光染料DAPI 染色后采用荧光显微镜观察Imatinib 和HHT 单独给药及联合给药诱导KCL22 细胞凋亡作用。给予0.2 μmol/L Imatinib 或 0.2 μmol/L HHT 单 独 处 理KCL22 细胞24 h,均未能诱导 KCL22 细胞凋亡;当采用 0.2 μmol/L Imatinib 和 0.2 μmol/L HHT 联合处理KCL22 细胞24 h,可观察到KCL22 细胞明显的凋亡形态,Imatinib 和 HHT 诱导KCL22 细胞凋亡具有协同作用,见图1。
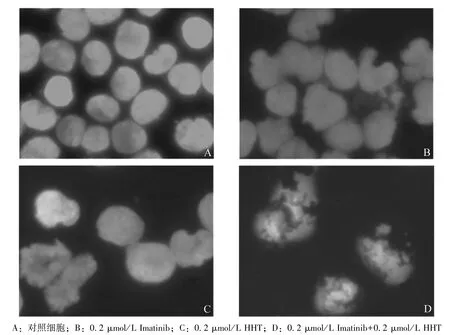
图1 荧光显微镜下观察Imatinib 合用HHT 协同诱导KCL22 细胞凋亡的细胞形态学观察(×400)
2.2 在不同剂量下,Imatinib 和HHT 联合给药诱导KCL22 细胞凋亡 分别将Imatinib 和HHT 以不同的浓度单独或联合给药KCL22 细胞24 h,采用DAPI 荧光染色的细胞计数法对凋亡细胞计数,结果表明,单独给予 KCL22 细胞 0.1、0.2 μmol/L Imatinib 或 0.2、0.4 μmol/L HHT 不能诱导 KCL22细胞凋亡,当采用 0.2、0.4 μmol/L HHT 与 0.1 μmol/L Imatinib 联合给药细胞 24 h,则分别诱导(49±4.2)%和(77±3)%的 KCL22 细胞凋亡;采用 0.2、0.4 μmol/L HHT 与 0.2 μmol/L Imatinib联合给药细胞24 h,则分别诱导(66±3.2)%和(92±2)%的 KCL22 细胞凋亡,Imatinib 与不同浓度HHT 合用均协同诱导KCL22 细胞凋亡,见图2。

图2 Imatinib 合用不同浓度HHT 协同诱导KCL22 细胞凋亡
2.3 在不同作用时间点下,Imatinib 和HHT 联合给药诱导KCL22 细胞凋亡 以培养12、24、48 h的KCL22 细胞作为对照,分别将 Imatinib 和 HHT各以 0.2 μmol/L 单独或联合给药 KCL22 细胞 12、24、48 h,采用DAPI 荧光染色的细胞计数法对凋亡细胞计数,结果表明,单独给予 KCL22 细胞0.2 μmol/L Imatinib 或 0.2 μmol/L HHT 处理 12、24、48 h,不能有效诱导 KCL22 细胞凋亡;当采用 0.2 μmol/L HHT 与 0.2 μmol/L Imatinib 联合给药 12、24、48 h,则分别诱导(25±2.7)%、(64±4.3)%、(93±1.9)%的 KCL22 细胞凋亡,可见在多个作用时间点下,Imatinib 与HHT 合用均可协同诱导KCL22 细胞凋亡,见图3。

图3 Imatinib 合用HHT 在不同时间点下协同诱导KCL22 细胞凋亡
2.4 Imatinib 和HHT 联合给药诱导KCL22 细胞凋亡的流式细胞术检测 给予0.2 μmol/L Imatinib或 0.2 μmol/L HHT 单独处理 KCL22 细胞 24 h 后采用流式细胞术PI 染色检测,KCL22 细胞分别有5.3%和7.9%细胞发生凋亡,与对照细胞2.7%凋亡率相比未出现显著的诱导细胞凋亡作用。当采用 0.2 μmol/L Imatinib 和 0.2 μmol/L HHT 联合处理KCL22 细胞24 h,采用流式细胞术PI 染色可以检测出显著的SubG1 期凋亡峰的存在,约63.5%的KCL22 细胞出现细胞凋亡,见图4。
2.5 Imatinb 和HHT 联合处理KCL22 细胞对细胞凋亡通路相关蛋白的作用 将KCL22 细胞分别给予 0.2 μmol/L Imatinib 和 0.2 μmol/L HHT 处理 24 h,其抗凋亡蛋白Mcl-1 的蛋白表达水平下调并不显著,当对 KCL22 细胞联合给予 0.2 μmol/L Imatinib 和 0.2 μmol/L HHT 处理 24 h 后,其抗凋亡蛋白Mcl-1 的蛋白水平显著下调,同时细胞凋亡指示蛋白PARP 被协同活化,见图5。
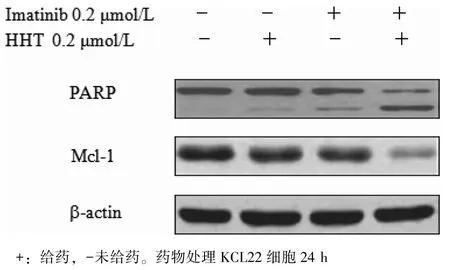
图5 Imatinib 合用HHT 对KCL22 细胞凋亡通路相关蛋白的影响
3 讨论
现有的研究表明,Imatinib 并不能完全治愈CML,并随着BCR-ABL 酪氨酸激酶抑制剂的广泛应用,临床上对Imatinib 出现了广泛的耐药性。近年来的报道表明,HHT 对Imatinib 耐药的CML 仍然敏感,对BCR-ABL 酪氨酸激酶突变的CML 患者仍然有效,美国FDA 已在2012 年批准HHT 用于治疗初治及酪氨酸激酶抑制剂耐药的难治CML[7]。因此将 Imatinib 与 HHT 联合用于 CML 及耐药CML 的临床治疗可能会取得更好的治疗效果。
在本研究中,Imatinib 与 HHT 联合给药具有协同诱导CML 细胞系KCL22 细胞凋亡的作用,并在不同剂量和作用时间点下其抗白血病作用具有良好的协同作用。采用 0.2 和 0.4 μmol/L HHT 处理KCL22 细胞12 和24 h,未能显著引起细胞凋亡的发生,同时采用 0.1 和 0.2 μmol/L Imatinib 处理KCL22 细胞12 和24 h 也不能够引起显著的细胞凋亡,但在此浓度下将Imatinib 和HHT 联合给药可显著地诱导KCL22 细胞发生凋亡。本研究结果表明,Imatinib 与HHT 联合给药能够诱导CML 细胞系KCL22 细胞发生凋亡,将两者联合给药CML 细胞具有协同的抗白血病作用。
研究表明,HHT 可以诱导CML 细胞凋亡并下调Bcl-2 家族中抗凋亡蛋白Mcl-1 的表达水平并发挥诱导细胞凋亡作用[3],因此应用Western blot法考察了Imatinib 和HHT 单独及联合处理KCL22细胞后Mcl-1 的蛋白表达水平,以及细胞凋亡指示蛋白PARP 的裂解活化情况。本研究结果发现,Imatinib 与HHT 联合给药可以显著地下调KCL22细胞Mcl-1 的表达水平,并能引起细胞凋亡指示性蛋白PARP 的活化和裂解。Mcl-1 为线粒体抗凋亡蛋白Bcl-2 家族中重要成员,Mcl-1 蛋白的抑制或下调均可以引起白血病细胞的凋亡[8-9]。本研究提示HHT 可能通过下调Bcl-2 家族中抗凋亡蛋白Mcl-1 发挥协同Imatinib 诱导CML 细胞凋亡的抗白血病作用。
综上所述,HHT 与 Imatinib 在不同剂量和不同时间点作用下,可以协同抑制KCL22 细胞生长并诱导其凋亡,发挥了协同的抗白血病作用,希望我们的研究为CML 的临床治疗提供更为合理和有效的治疗方案。

