Nrf2基因对中波紫外线诱导角质形成细胞光损伤的保护作用
任 静,马良娟
紫外线照射皮肤发生氧化应激反应,从而诱导产生以羟自由基和脂质过氧化物为主的活性氧(reactive oxygen species,ROS),ROS 可直接导致脂质、蛋白质和核酸的损伤以及皮肤光老化[1]。Nrf2基因是一种含有亮氨酸拉链基本结构的核转录因子,它是机体内重要的氧化应激因子, 以转录调控的方式对抗皮肤细胞的氧化应激,从而在氧化反应中保护细胞免受损害[2]。基于此,本文通过研究中波紫外线(UVB)诱导人永生化角质形成细胞(HaCaT)氧化损伤,观察和评估Nrf2基因对细胞的氧化损伤和光损伤的保护作用。
1 材料与方法
1.1 材料
1.1.1 细胞 HaCaT 由哈尔滨医科大学附属第二医院皮肤科柏冰雪教授馈赠。
1.1.2 仪器 紫外线光源(南京华强公司);紫外光强度计(深圳市欣宝瑞仪器有限公司);超净工作台(哈尔滨市东联生化仪器有限公司);倒置显微镜(日本Nikon 公司);iMark 酶标仪(美国Bio-Rad 公司);离心机(长沙湘仪公司);CO2培养箱(上海力康医疗有限公司);水浴振荡器(哈尔滨东联生化仪器有限公司);ChemiScope 6000 系列化学发光成像系统(上海勤翔科学仪器有限公司)。
1.1.3 试剂 PBS 粉剂、CCK-8 细胞增殖检测试剂盒(日本同仁化学研究所);DMSO(美国Sigma 公司);胰酶细胞消化液(上海碧云天公司);DMEM培养基(美国Hyclone 公司);胎牛血清(天津康源公司);Nrf2基因沉默慢病毒包装(上海吉玛公司);超氧化物阴离子荧光探针、试剂盒、RIPA 裂解液(上海碧云天公司); BCA 蛋白浓度测定试剂盒(上海碧云天公司);PVDF 膜 (北京Biosharp 公司);一抗Nrf2 抗体(兔抗人)(日本CST 公司);辣根酶标记山羊抗兔IgG 抗体(美国Proteintech 公司)。
1.2 方 法
1.2.1 细胞培养 HaCaT 细胞用含10%胎牛血清的DMEM 培养液置于细胞培养箱中 (37℃、95%湿度及体积分数5%CO2)贴壁培养。传代取对数生长期的HaCaT 细胞,加入胰酶消化液消化后,用含10% 胎牛血清的DMEM 培养基以1×105个/ml 细胞密度接种于6 或96 孔培养板中,待长至50%~60%且处于对数生长,换成无血清培养基,饥饿24 h 后进行实验。
1.2.2 细胞转染 转染具体步骤按慢病毒包装转染试剂说明书进行预实验,确认目的细胞的感染方法和感染复数(MOI)。将细胞接种于6 孔板,进行正式实验。待生长稳定后收集细胞检测Nrf2 沉默效果并培养待用。
1.2.3 细胞分组处理 待HaCaT 细胞融合80%以上后,分为正常组(无UVB 辐射)、UVB 辐射组(采用UVB 辐射)、SiRNA 组(基因沉默,无UVB 辐射)、SiRNA+ UVB 照射组(基因沉默,采用UVB 辐射)。每组细胞均有3 个 复孔,弃去细胞培养基,加入适量PBS 覆盖细胞,再用30 mJ/cm2剂量UVB 辐射。空白对照组需用铝箔覆盖。弃去PBS,加入10%胎牛血清DMEM 培养基于培养箱中继续培养24 h。
1.2.4 测定指标及方法 采用Western blot 法检测Nrf2 表达的变化。主要步骤:收集上述每组孔板里HaCaT 细胞,提取细胞总蛋白后采取BCA 法测蛋白浓度。8%SDS-PAGE 凝胶垂直电泳,采用湿转法将蛋白转至PVDF 膜上,5%脱脂奶粉封闭,加入Nrf2(浓度比分别为1:1 000),4℃过夜,加辣根过氧化物酶标记的羊抗兔IgG 进行孵育,ECL 试剂检测膜上的免疫反应条带,并用ChemiScope 6000 系列化学发光成像系统采集图像、对条带灰度值进行量化分析。以β-肌动蛋白(1:1 000)作为内参照,比较不同处理后上述蛋白表达的差异,实验重复3 次以上。①HaCaT 细胞增殖活性的测定:将细胞接种于96 孔板,按1.2.3 分组处理细胞,每孔加入溶液(按培养基:CCK-8=10:1 的比例提前配好)110 μl,孵育3 h 后弃去上清,于酶标仪450 nm 波长测各孔A值。②细胞内活性氧ROS 含量的测定:UVB 辐射30 min 后收集细胞,弃去原培养基;加入含1 μmol/L DHE 的无血清培养基,于37℃、5%CO2培养箱孵育30 min;用无血清培养液冲洗4 次,使未进入细胞的DHE 得到充分去除。在流式细胞仪上使用535 nm 激发波长和610 nm 发射波长检测DHE 平均荧光强度。
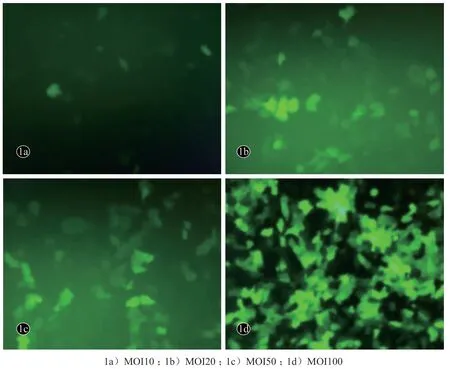
图1 不同MOI值时HaCaT转染情况(×200)
1.3 统计学方法
运用SPSS22.0 软件进行统计学分析。数据用组间比较,采用单因素ANOVA 方差分析。
2 结果
2.1 不同MOI 值时HaCaT 转染情况
从图1 可见,随着MOI 值的增高,绿色荧光阳性的细胞比例逐渐增大(图1a-1d),而MOI 为20 时与MOI 为50 时,细胞转染效率均在50%,符合实验转染要求,选择20 为细胞最合适的MOI。
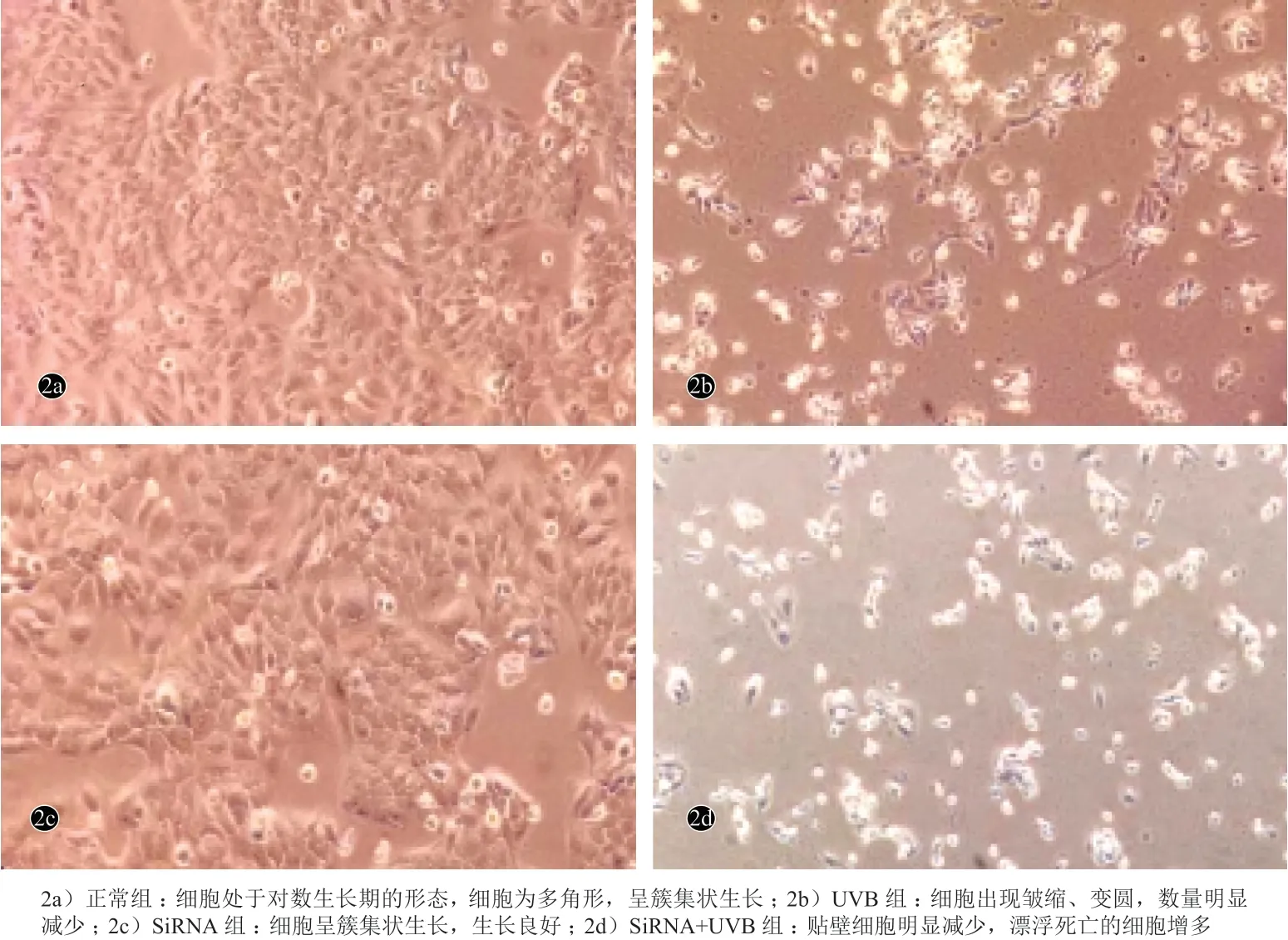
图2 UVB 照射前后HaCaT 细胞形态变化(×200)
2.2 UVB 照射前后 HaCaT 细胞的形态学变化
倒置光学显微镜下显示正常的 HaCaT 细胞处于对数生长期的形态, 细胞为多角形,呈簇集状生长,生长良好(图 2a);30 mJ/cm2UVB 照射后继续培养24 h 的 HaCaT 细胞出现皱缩、变圆,数量明显减少(图2b)。NrF2-siRNA 组(基因沉默,不辐射),细胞呈簇集状生长,生长良好(图2c)。Nrf2-siRNA+UVB组(基因沉默后照射30 J/cm2UVB 后继续培养24 h)贴壁细胞明显减少,漂浮死亡的细胞增多,贴壁的细胞部分去正常的膜结构(图2d)。
2.3 各组HaCaT 细胞的活力情况
CCK-8 检测结果显示,各实验组细胞生存率分别为 100%、45.86%、59.66%、15.14%。与正常对照组相比,基因沉默组以及经30 mJ/cm2UVB 照射后的各组细胞的活性降低,差异有统计学意义(P<0.05);与 UVB 照射组对比,siRNA+UVB 组的细胞活性明显降低,各实验组差异均有统计学意义(P<0.05)(表1)。
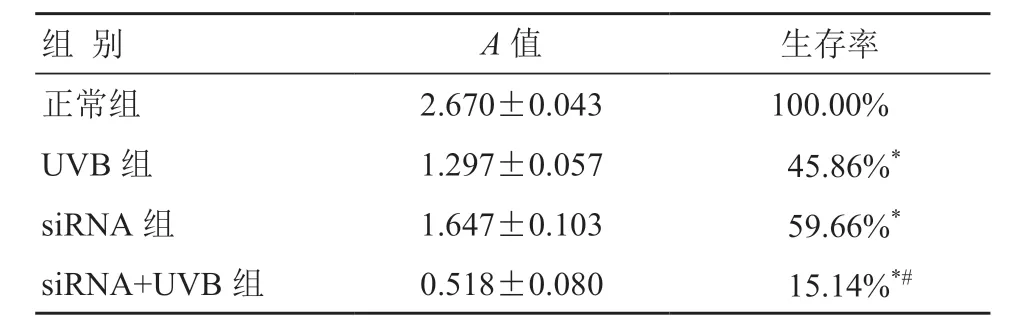
表1 各组细胞存活率
2.4 各组HaCaT 细胞的活性氧荧光强度
每管内计数约1 万个细胞,计算单个细胞的平均荧光强度(MEAN),P2 为ROS 表达阳性区域。A、B、C、D 分别为正常细胞组、UVB 照射组、SiRNA组、SiRNA+UVB 照射组。与正常组相比,Nrf2基因沉默组ROS 平均荧光强度增加,UVB 照射后细胞ROS 水平明显增高(电轴右偏,MEAN 增强),其中,与正常组相比,UVB 照射组MENA 增加1 倍左右;与SiRNA 组 相 比,SiRNA+UVB 组 的MEAN 增 加幅度在2 倍以上。说明UVB 照射能使细胞ROS 增加,其中Nrf2基因沉默后,再进行UVB 照射细胞的ROS增加更显著,表明细胞损伤程度也更严重(图3)。
2.5 各组HaCaT 细胞中Nrf2 蛋白的表达
稳定转染Nrf2-siRNA 基因的HaCaT 细胞,Nrf2蛋白的表达明显降低,说明慢病毒感染HaCaT 细胞是成功的。与正常组相比,30 mJ/cm2UVB 照射后,HaCaT 细胞中 Nrf2 蛋白的表达降低(图 4)。
3 讨论
UVB 辐射主要是由皮肤吸收的(90%的波长范围内的辐射是由表皮层阻止的),因此它主要影响表皮细胞。在光老化过程中,角质层可能会发生角化过度,表皮干燥、增厚,有皱纹,色素沉着,毛细血管扩张症,皮肤松弛,黑头。临床上,光老化包括日光性角化病、基底细胞癌、鳞状细胞癌和黑素瘤[3]。紫外线照射皮肤发生氧化应激反应,诱导产生以羟自由基和脂质过氧化物为主的活性氧(ROS),可直接导致脂质、蛋白质和核酸的损伤以及皮肤光老化[1]。抗氧化剂对氧化应激的反应是一种重要的防御机制,可抗内在和外在氧化损伤的有害影响[4]。在本次研究中,实验研究证明 30 mJ/cm2UVB 照射后 24 h,倒置光学显微镜下观察 HaCaT 细胞出现皱缩,贴壁细胞数量明显降低,漂浮细胞增多。CCK-8 的方法检测HaCaT 细胞在不同情况下的存活率,发现经30 mJ/cm2UVB 照射后与正常组相比,细胞的存活率下降。流式细胞仪分析HaCaT 细胞的ROS 荧光强度,发现经30 mJ/cm2UVB 照射后细胞的ROS 平均荧光强度增强。实验证实UVB 能诱导HaCaT 细胞的光损伤。Nrf2 在细胞内的氧化条件下与抗氧化反应原件(antioxidant response elemen,ARE)结合,启动抗氧化基因的转录,诱导转录的与细胞保护有关的抗氧化酶。Nrf2 诱导转录的与细胞保护有关的抗氧化酶包括谷胱甘肽S 转移酶(GST)、醌氧化还原酶(NQO1)、γ-谷氨酰半胱氨酸连接酶(GCL)、血红素氧合酶-1(HO-1)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)、葡萄糖醛酸转移酶(UDP-UGT)[5-7],在氧化反应中保护细胞免受损害。对Nrf2基因敲除小鼠进行紫外线照射,其抗氧化基因的表达降低后,氧化应激损伤明显加强,证明 Nrf2-ARE 通路是调控细胞内氧化还原状态的重要途径[8]。在进行大鼠脑缺血再灌注的试验(损伤机制主要是产生的大量自由基与脂质、蛋白质及核酸发生反应,从而导致膜脂质过氧化)时,大鼠脑缺血后再灌注的脑组织中Nrf2 的表达上升,使用激动剂增加Nrf2 表达时,缺血脑组织的含水量减少,梗死体积缩小,证明 Nrf2 在脑缺血再灌注的损伤中具有保护作用,以及具有清除自由基的作用[9]。因此,探索激活细胞防御的保护性分子,包括天然产物中的保护性分子,即通过激活Nrf2 以防护紫外线诱导的氧化应激,为光老化的防治提供了新策略。由于表皮角质形成细胞经常暴露于紫外线照射,激活Nrf2 是人类皮肤细胞的有效保护的关键。在本次研究中,证实 UVB 辐射后,Western-blot 技术检测到HaCaT 细胞中 Nrf2 蛋白表达降低,同时,笔者的研究发现,稳定转染Nrf2-siRNA 基因的HaCaT 细胞,在Nrf2 蛋白表达降低的基础上,进行UVB(30 mJ/cm2)照射后继续培养24 h,倒置光学显微镜下观察 HaCaT 细胞与其他组比较,贴壁细胞明显减少,漂浮死亡的细胞增多,贴壁的细胞部分去正常的膜结构。CCK-8 法检测发现与 UVB 照射组及siRNA组对比,siRNA+UVB 组细胞活性是显著降低的。流式细胞仪检测HaCaT 细胞的ROS 荧光强度,发现稳定转染Nrf2-siRNA 基因的HaCaT 细胞的平均荧光强度明显高于正常组和UVB 组,在进行UVB(30 mJ/cm2)照射后,siRNA+UVB 组与siRNA 组比较,平均荧光强度增加2 倍左右,而UVB 组进行UVB(30 mJ/cm2) 照射后与正常组比较平均荧光强度增加1倍左右。本实验的研究结果表明,稳定转染Nrf2基因沉默表达的HaCaT 细胞,在UVB 照射后,细胞的损伤更严重,其机制可能与Nrf2基因 抗氧化应激通路密切相关。UVB 照射细胞诱发细胞损伤,除了Nrf2-ARE 通路,还有其他多种信号通路参与皮肤光老化的发生,如核因子κB(NF-κB)信号通路,丝裂原活化蛋白激酶(MAPK)信号通路和磷脂酰肌醇-3 激酶-丝氨酸/苏氨酸激酶——西罗莫司靶蛋白(PI3K-AKt-mTOR)信号通路[10]。
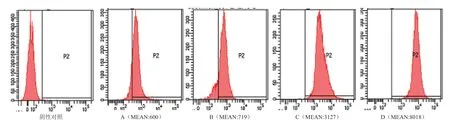
图3 各组HaCaT 细胞中ROS的平均荧光强度

图4 各组HaCaT细胞Nrf2蛋白的表达
综上所述,UVB 能造成体外培养的HaCaT 损伤,Nrf2基因在UVB 诱导的角质形成细胞的光损伤中具有保护作用。

