莱菔硫烷减轻肾缺血再灌注大鼠肝损伤
何 炜 刘风藏 于国霞 王 磊△
(1 华北石油管理局总医院功能检查科,任丘 062552;2 河北医科大学解剖学教研室,石家庄 050017;3 石家庄市妇幼保健院药剂科,石家庄 050051)
肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)是手术治疗肾脏疾病过程中常见的病理生理现象[1]。肾在缺血及其后的血液再灌注过程中会有大量活性氧族(reactive oxygen species,ROS)产生,导致肾损伤。因此,氧化应激被认为是引发RIRI 的主要机制之一[2-3]。本课题组前期研究表明,RIRI 发生后,肝脏也会遭受过氧化损伤[4]。核因子NF-E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是抗氧化应激转录调控因子,可调节抗氧化蛋白的表达[5-6]。超氧化物歧化酶(superoxide dismutases,SOD)是重要的抗氧化酶,可清除ROS,同时也是Nrf2 转录调控的靶基因之一[7]。莱菔硫烷(sulforaphane,SFN)是Nrf2 通路的诱导剂,可上调Nrf2 及其靶基因,发挥抗氧化等生物学作用[8]。本研究给予RIRI 模型大鼠SFN,观察肝组织形态、功能、过氧化损伤及SOD 的表达变化,探讨SFN 在防治RIRI 诱发的肝损伤中的作用。
1 材料和方法
1.1 RIRI 模型的制备、分组和样品采集
24 只雄性Wistar 大鼠(200±10)g,随机分为对照组(Control 组)、RIRI 组、缺血+SFN 组(SFN1组),灌注+SFN 组(SFN2 组)。RIRI 组参照余晓东等[9]的方法建立RIRI 动物模型。腹腔注射6%水合氯醛(5 mL/kg)麻醉大鼠,充分暴露双侧肾,切除右侧肾,无创动脉夹在靠近肾门处夹闭左侧肾动脉,阻断血供45 min 后弃去动脉夹,重新恢复左侧肾的血液供应。对照组大鼠切除右侧肾,并分离左侧肾动脉,但并不夹闭。SFN1 组大鼠在夹闭左侧肾动脉后立即将二甲基亚砜稀释的SNF 均匀涂抹于小肠表面,SFN2 组大鼠在弃去血管夹恢复血液灌注时立即将SNF 均匀涂抹于小肠表面,其余操作步骤同RIRI 组。对照组和RIRI 组只在小肠表面涂抹等量的二甲基亚砜。灌注24 h 后收集血液,3 000 r/min,离心10 min,收集血清用于谷丙转氨酶(alanine transaminase,ALT)测定;4%多聚甲醛固定肝,用于H-E 染色观察大鼠肝形态学变化。其余肝置于液氮中,用于丙二醛(malondialdehyde,MDA)和H2O2含量,SOD 活性、SOD mRNA 和蛋白表达水平测定。
1.2 大鼠肝形态结构观察
H-E 染色观察肝组织形态结构:4%多聚甲醛固定肝组织,常规脱水、透明,石蜡包埋,切片厚度5 µm,脱蜡至水,H-E 染色,脱水、二甲苯透明2~5 min、中性树胶封片。光学显微镜下观察肝组织形态结构变化。
1.3 血清ALT 活性测定
采用微板法检测ALT 活性,检测过程按南京建成检测试剂盒说明书进行。
1.4 肝组织MDA 含量检测
冰冻肝组织按20 mg/100 μL的比例加入预冷生理盐水快速匀浆,匀浆液4 000 r/min,4℃离心 20 min,收集约150 μL上清液,按照1∶1的比例于上清液内加入150 μL生理盐水,即为10%肝组织匀浆,作为待测样本。匀浆液中MDA含量采用南京建成MDA测定试剂盒检测,以每克肝组织蛋白中所含MDA的量(mmol/g pro)代表肝匀浆MDA含量。
1.5 肝组织H2O2含量和SOD 活性测定
冰冻肝组织按重量体积比1∶9 加入预冷生理盐水,快速匀浆,匀浆液10 000 r/min,4℃离心10 min,收集上清即为10%肝组织匀浆。匀浆液中H2O2含量和SOD 活性均采用南京建成测定试剂盒检测,每克肝组织蛋白中所含H2O2的量(mmol/gpro)代表肝匀浆H2O2含量;每毫克样本蛋白所含的酶活性单位(U/mg pro)表示肝组织SOD 活性。
1.6 肝组织SOD mRNA 水平测定
采用RNA提取试剂盒提取肝组织总RNA。2 μg RNA反转录成模板cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参照,Real-time PCR测定SOD mRNA表达水平。
1.7 肝组织SOD 蛋白水平测定
免疫印迹法测定大鼠肝组织SOD 蛋白水平。大鼠肝组织匀浆,离心后取上清。电泳蛋白上样量为62 μg。经过转膜和封闭处理,PVDF 膜上加入SOD 抗体(购于Abcam 公司),室温静置过夜。再加入辣根过氧化物酶标记IgG 抗体(购于Zymed公司)。双色红外线成像系统拍照并进行图像分析,以SOD 与GAPDH 条带积分光密度值之比表示其蛋白含量。
1.8 统计学处理
2 结果
2.1 大鼠肝组织形态结构改变
光镜下可见,对照组大鼠肝细胞大小均匀,围绕中央静脉排列成条索状,肝血窦大小均匀未见异常;RIRI 组大鼠肝细胞萎缩,体积变小,肝血窦扩张;SFN1 组大鼠肝细胞肿胀,体积增大,肝血窦被挤压变窄,偶可见空泡变性;SFN2 组大鼠部分肝细胞萎缩,肝血窦略有扩张,肝细胞内可见有大量空泡,数量多于SFN1 组(图1)。

图1 对照组(A)、RIRI 组(B)、SFN2 组(C)、SFN1 组(D)肝形态结构H-E 染色,标尺=50 μm,×400Fig1 Microstructure of the liver in the control group(A),RIRI group(B),SFN2 group(C)and SFN1 group(D),H-E staining,bar=50 μm,×400
2.2 血清ALT 活性改变
各组大鼠血清内ALT 活性分别为:对照组(86.35 ±12.22)U/L、RIRI 组(210.27±29.94)U/L、SFN2 组(161.71±21.75)U/L、SFN1组(132.75 ±20.51)U/L。与对照组相比,RIRI组、SFN2 组、SFN1 组ALT活性均明显升高(P<0.05),SFN2 组和SFN1 组ALT 活性低于RIRI组(P<0.05),SFN1 组又低于SFN2 组(P<0.05)。
2.3 肝组织MDA、H2O2含量的改变
与对照组相比,RIRI 组、SFN2 组,SFN1 组大鼠肝组织MDA 和H2O2含量明显升高(P<0.05),但SFN2 组和SFN1 组肝 组织MDA 和H2O2含量明显低于RIRI 组(P<0.05),SFN1 组又低于SFN2 组(P<0.05)(表1)。
2.4 肝组织SOD 活性改变
大鼠肝组织SOD 活性分别为:对照组(133.33±14.21)U/mg pro、RIRI 组(53.36±7.28)U/mg pro、SFN2 组(73.46±8.96)U/mg pro、SFN1 组(86.75 ±10.16)U/mg pro。与对 照组 相比,RIRI 组、SFN2 组、SFN1 组SOD 活性均降低(P<0.05),SFN2 组和SFN1 组SOD 活性高于RIRI组(P<0.05),SFN1组又高于SFN2组(P<0.05)。
表1 肝MDA、H2O2 含量(n=6,±s,mmol/g pro)Tab1 MDA and H2O2 content in the liver(n=6,±s,mmol/g pro)

表1 肝MDA、H2O2 含量(n=6,±s,mmol/g pro)Tab1 MDA and H2O2 content in the liver(n=6,±s,mmol/g pro)
*P<0.05 vs control group;#P<0.05 vs RIRI group;△P<0.05 vs SFN2 group
Group MDA H2O2 Control 42.08±6.35 55.49±8.75 RIRI 96.49±12.38*124.15±18.52*SFN2 68.86±9.15*# 96.09±12.14*#SFN1 54.62 ±9.57*#△ 75.00 ±11.14*#△
2.5 肝组织SOD 基因的表达改变
与对照组相比,RIRI组、SFN2组、SFN1组大鼠肝组织SOD mRNA表达水平均升高(P<0.05)。SFN2组和SFN1组大鼠肝组织的SOD mRNA相对表达水平又高于RIRI组(P<0.05),但SFN2组和SFN1组之间差异无统计学意义(P>0.05,图2A)。
2.6 肝组织SOD 蛋白的表达改变
与对照组相比,RIRI 组、SFN2 组、SFN1 组大鼠肝组织SOD 蛋白表达水平均升高(P<0.05)。SFN2 组和SFN1 组大鼠肝组织SOD 蛋白相对表达水平又高于RIRI 组(P<0.05),但SFN2 组 和SFN1 组SOD 蛋白相对表达水平差异无统计学意义(P>0.05,图2B)。
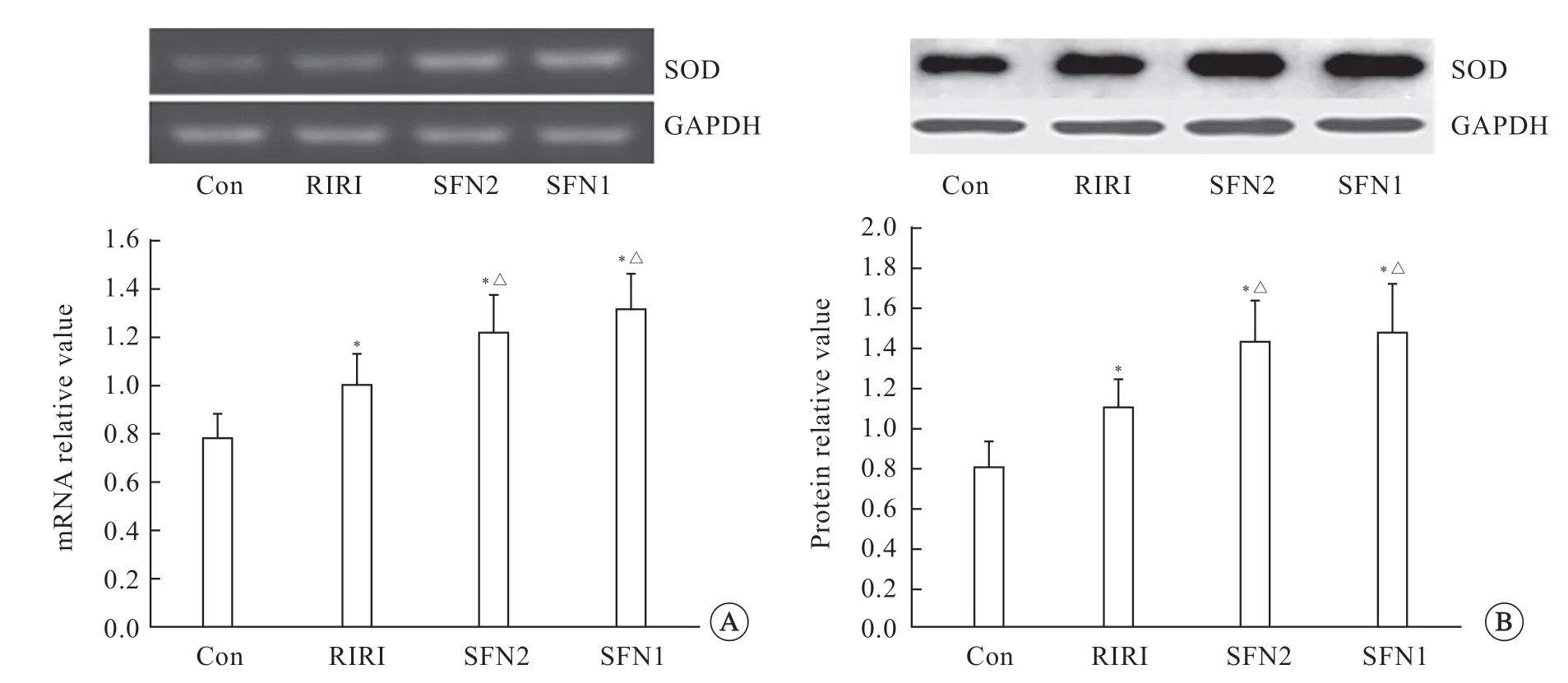
图2 肝SOD mRNA(A)和蛋白(B)的表达Fig2 Expression of SOD mRNA(A)and protein(B)in the liver
3 讨论
首先,本研究观察了肝组织形态结构和功能的改变。显微镜及ALT 结果显示:RIRI 组、SFN1组、SFN2 组3 组大鼠的肝组织结构和功能均已受损,且RIRI 组最为严重,SFN1 组损伤轻于SFN2 组。提示肾缺血再灌注导致了大鼠肝形态结构和功能严重受损,SFN 处理能明显改善肝组织结构,减轻肝功能损伤,且缺血后即刻给予SFN 的改善作用要优于再灌注后给予SFN。
其次,本研究检测了肝组织H2O2和MDA的含量。H2O2是引发过氧化损伤的一个主要因素[11]。以H2O2含量反映肝组织内的ROS 含量即氧化应激水平。MDA 是组织细胞发生过氧化损伤的标志物之一[12]。实验结果显示:RIRI 组、SFN1 组、SFN2组3 组大鼠肝组织内H2O2和MDA 含量均明显升高。说明在RIRI 发生时,肝也已发生氧化应激,遭受过氧化损伤,这与本课题组前期研究结果一致。SFN1 组和SFN2 组含量明显低于RIRI 组,SFN1 组又低于SFN2 组。说明在大鼠肝组织氧化应激水平和过氧化损伤程度上,RIRI 组最为严重,SFN1 组又轻于SFN2 组。此结果提示,SFN 处理明显降低了肝组织的ROS 含量,减轻了肝组织过氧化损伤的程度,并且缺血后即刻给予SFN 的抗氧化作用要比再灌注后给予强。
最后,本研究检测了肝组织SOD 的活性及表达变化。SOD 是机体内清除超氧阴离子的重要抗氧化酶[13-14]。SOD 活性结果显示,RIRI 组、SFN1组、SFN2 组3 组大鼠肝组织内SOD 活性均降低,SFN1 组 和SFN2 组SOD 活性要高于RIRI组,提 示SFN 处理减轻了肝组织SOD 活性的丧失,而SFN1组又高于SFN2 组,提示缺血后即刻给予SFN 的效果要优于再灌注后给药。笔者推测,RIRI 发生时,肝组织有大量ROS 产生,引发肝组织发生过氧化损伤,导致其SOD 活性降低,SFN 降低了肝组织ROS 的含量,从而减缓了SOD 活性的丧失,而SFN1 组要比SFN2 组效果更好,是因为SFN1 组的SFN 提早作用了45 min。
SOD表达变化结果显示,RIRI组SOD mRNA和蛋白表达水平均高于对照组,笔者推测,由于ROS堆积,机体反馈性上调SOD的表达导致其升高。SFN1组和SFN2组的SOD表达又高于RIRI组,这是SFN诱导Nrf2上调SOD表达所致。SFN1组和SFN2组SOD表达无差异,SOD表达变化没有与活性变化平行,推测SFN1组给药早,其SOD表达提前升高后降低了肝组织ROS的含量,从而提前减缓了SOD活性的丧失,因此SFN1组SOD活性比SFN2组高,给药24 h后2组SFN对SOD表达的影响作用已趋近相同,导致2组SOD表达水平无差异。
综上所述,RIRI发生后,SFN可上调肝组织SOD的表达,增强肝对ROS的清除作用,降低肝组织氧化应激水平和过氧化损伤程度,改善肝的形态结构和功能。并且缺血后即刻给予SFN处理对于肝组织的抗氧化保护作用要优于再灌注后给药。

