白桦脂醇对慢性应激抑郁模型大鼠行为及神经营养因子表达的影响*
傅增辉 金 艳 林再红 姜 岩 刘 晶 杜 姝 张广萍 陈团团
(齐齐哈尔医学院附属第三医院神经内科,齐齐哈尔 161002)
抑郁症(depression)是一种复杂的情感性精神障碍综合征,其发病机制尚不明确[1]。白桦脂醇(Betula platyphylla),又称桦木醇、桦木脑,为白桦树皮提取物[2]。近年研究表明白桦脂醇与白桦脂酸具有抗炎、抗菌和抗病毒等作用,并表现出巨大的药理学潜能。动物实验提示其具有生物活性多样,且在较高剂量下毒性很低[3]。有研究报道,白桦脂醇在Aβ 诱导的痴呆大鼠模型上显示出显著改善认知功能的作用[4],并且在脑缺血再灌注模型上表现出神经保护作用[5]。研究证实,中枢神经系统内的多种神经递质与抑郁症的发生发展相关[6];另外,傅晓艳等[7]报道,神经营养因子对抑郁症的抑郁行为具有神经保护作用。本实验将探讨白桦脂醇对慢性应激抑郁模型即慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)模型大鼠的抗抑郁作用,观察实验大鼠的抑郁行为,检测海马神经元凋亡情况,检测5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)和多巴胺(dopamine,DA)神经递质水平,检测脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、神经营养蛋白3(neurotrophin-3,NT-3)和神经生长因子(nerve growth factor,NGF)水平,为治疗抑郁症提供基础理论依据,也为抑郁症治疗靶点的研究提供新的思路。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠40只,2月龄,体质量(194.01±18.03)g,均由齐齐哈尔医学院实验动物中心提供,许可证号:第SCXK(黑)2016-001 号,本实验遵循齐齐哈尔医学院实验动物中心实验动物使用管理规定,并通过齐齐哈尔医学院伦理委员会批准。饲养温度(25±1)℃,湿度50%~55%,24 h 昼夜循环光环境,及时更换垫料并提供充足的食物和水。
1.2 试剂
白桦脂醇由大兴安岭林格贝寒带生物产业公司提供;放射免疫分析药盒为北京普尔伟业生物科技有限公司产品;兔抗鼠多克隆抗体,美国Abbkine公司提供;Revert Aid First Strand cDNA synthesis、SYBR Premix Ex TaqTM、ROXReference Dye Ⅱ,美国Thermo Fisher 公司提供。
1.3 动物分组及造模
将40 只大鼠随机分为正常组、模型组、氟西汀组和白桦脂醇组,每组10 只。正常组大鼠常规群养结合蒸馏水灌胃每日1 次;模型组大鼠孤养CUMS 结合蒸馏水灌胃每日1 次;氟西汀组大鼠每日应激刺激前1 h 给予氟西汀灌胃(用蒸馏水配置,给药5 mg·mL-1·kg-1);白桦脂醇组大鼠每日应激刺激前1 h 给予白桦脂醇灌胃(用蒸馏水配置,给药20 mg·mL-1·kg-1),4 组均持续28 d 后进行行为学检测。采用改进CUMS 抑郁动物模型[8]造模方法。正常组每笼饲养5 只,正常饮食、饮水,不予任何刺激;接受造模组每笼饲养1 只,应激刺激持续28 d,包括:禁水24 h、禁食24 h、夹尾 1 min、电击足底20 V,每次10 s每次电击间隔 1 min,20次、强迫冰水游泳4℃4 min、倾斜笼子45°12 h、转换昼夜节律、制动2 h、热刺激40℃ 5 min。每天随机安排1种刺激,相同刺激不连续出现,每种刺激重复不少于4次。造模结束根据体重及强迫游泳实验进行模型评价。
1.4 行为学检测
(1)悬尾实验(tail suspension test,TST),将大鼠尾巴连接于高处,距离地面1.5 m 左右,记录并计算每只大鼠在5 min 内静止的时间。其中静止时间为大鼠头部和肢体相对于躯干不动而躯干摆动的时间。(2)糖水偏爱测试(sucrose preference test,SPT),每笼均放置2 个水瓶,第1个24 h,2瓶均为1%蔗糖水,随后的24 h,一瓶为1%蔗糖水,另一瓶为蒸馏水,禁食水24 h 后,进行动物的糖水消耗实验,即同时给予每只大鼠预先定量好的1%蔗糖水、蒸馏水各1 瓶,24 h 后计算糖水进食量,并统计大鼠的糖水偏爱率,糖水偏爱率(%)=糖水进食量/总液体消耗×100%。(3)强迫游泳实验(forced swimming test,FST)将大鼠单独放入透明水缸中,水温23℃~25℃。游泳进行6 min,前2 min 不做记录,观察记录鼠的不摆动时间,即后4 min 漂浮不动时间。为避免对下一只测试鼠产生影响,每次实验后消毒水缸并更换水。
1.5 检测凋亡细胞
大鼠行为学测试结束后,每组中随机取5 只大鼠,腹腔注射10%水合氯醛(3 mL/kg)麻醉,剪开腹壁,暴露心,用灌注穿刺针沿着心的纵轴方向经心尖部插入左心室至主动脉根部,止血钳固定,剪开右心耳,立即灌入4℃的生理盐水,多聚甲醛灌注,后取出脑组织,多聚甲醛固定24 h,梯度乙醇脱水,浸蜡,包埋,切片。按罗氏TUNEL 凋亡染色试剂盒说明书进行TUNEL 细胞凋亡染色,细胞核呈棕黄色染色为阳性细胞。每只大鼠取5 张脑染色切片,每张切片随机观察并拍摄5 个非重叠高倍(10 目镜×40 物镜)视野,将所拍图片用美国IPP6.0 图像处理,计算凋亡细胞数目,用凋亡细胞数/高倍镜视野表示。
1.6 检测5-HT、NE 和DA 神经递质水平
采用高效液相-电化学检测(HPLC-ECD)测定各组大鼠脑内5-HT、NE 和DA 含量,取每组剩余的5 只,将大鼠行断头,快速在冰盘上分离出脑组织,制作组织匀浆,4 ℃,12 000 r/min,离心20 min,取上清,用高效液相-电化学检测(HPLCECD)法检测脑内单胺神经递质5-HT、NE 和DA 的色谱,进行线性回归分析,计算出各组大鼠脑中5-HT、NE 和DA 的含量。
1.7 免疫印迹检测BDNF、NT-3 和NGF 蛋白水平
BDNF、NT-3 和NGF 水平的检测采用免疫印迹,取1.6 步骤中组织匀浆并提取总蛋白,用12%的胶进行SDS-PAGE 电泳,电泳后将蛋白转移到PVDF 膜上,5%脱脂奶粉封闭1 h,一抗(均为1∶ 1 000)4 ℃缓慢孵育过夜,含2.5%脱脂奶粉的TBST 洗膜2 次,每次5 min。山羊抗兔二抗(1∶ 5 000)室温孵育1 h,清洗同上。ECL 显色,化学发光成像系统分析检测结果。
1.8 统计学处理
2 结果
2.1 各组大鼠体质量变化
与正常组比较,大鼠造模在第2周即出现体质量下降(P<0.01),反映大鼠在抑郁形成的过程中导致体质量减轻,说明造模成功;与模型组比较,氟西汀组和白桦脂醇组大鼠的体质量在3、4周增加(P<0.05或P<0.01),且在4周时白桦脂醇组较氟西汀组的大鼠体质量改善明显(P<0.05)(表1)。
表1 各组大鼠不同时间体质量的比较(n=10,±s,g)Tab1 Comparison of body mass change of rats(n=10,±s,g)

表1 各组大鼠不同时间体质量的比较(n=10,±s,g)Tab1 Comparison of body mass change of rats(n=10,±s,g)
**P<0.01 vs normal group;△P<0.05,△△P<0.01 vs model group;#P<0.05 vs fluoxetine group
Group 1 week 2 weeks 3 weeks 4 weeks Normal group 194.74±18.87 241.44±16.44 276.73±19.65 293.84±21.83 Model group 193.30±16.90 153.85±20.75** 125.75±16.37** 108.48±17.01**Fluoxetine group 195.69±17.74 157.10±17.96 173.84±18.67△ 181.96±18.75△△Betula platyphylla group 194.83±18.94 159.22±19.41 181.63±15.12△△ 204.18±21.81△△#
2.2 各组大鼠行为学比较
造模成功后,抑郁模型大鼠表现出行动迟缓,精神萎靡,治疗后,氟西汀组和白桦脂醇组较治疗前改善,模型组无变化。治疗后,与正常组比较,模型组大鼠悬尾静止时间、强迫游泳不动时间均明显延长(P<0.01);与模型组比较,氟西汀组和白桦脂醇组均明显延长(P<0.01),且氟西汀组较白桦脂醇组明显延长(P<0.05)。与正常组比较,模型组大鼠糖水偏爱率明显下降(P<0.01);与模型组比较,氟西汀组和白桦脂醇组均明显下降(P<0.01),且氟西汀组较白桦脂醇组明显下降(P<0.05)(表2)。
表2 各组大鼠行为学比较(n=10,±s)Tab2 Comparison of rat behavior in each group(n=10,±s)

表2 各组大鼠行为学比较(n=10,±s)Tab2 Comparison of rat behavior in each group(n=10,±s)
**P<0.01 vs normal group;△△P<0.01 vs model group;#P<0.05 vs fluoxetine group
Group Suspension time(s)Scurose preference test(%)Forced swimming time(s)Normal group 45.74±5.63 11.73±2.09 82.20±6.43 Model group 95.33±4.01** 5.91±1.93** 152.89±10.01**Fluoxetine group 68.05±6.71△△ 8.62±1.57△△ 113.22±7.40△△Betula platyphylla group 55.83±7.82△△# 10.19±2.15△△# 91.04±8.95△△#
2.3 各组大鼠海马区神经元细胞凋亡数比较
经TUNEL染色后,各组均可见TUNEL阳性细胞,凋亡细胞被染成棕色,细胞核呈棕黄色,有些细胞核则固缩深染,呈深棕色,形状不规则,有的呈指环样,有的在其核周可见棕黄色毛刷样结构,部分凋亡阳性细胞胞质亦着色。与正常组(0.210%±0.034%)海马凋亡细胞数/高倍镜视野比较,模型组(0.974%±0.047%)显著上升(P<0.01);与模型组比较,氟西汀组(0.497%±0.028%)和白桦脂醇组(0.331%±0.040%)显著下降(P<0.01);且白桦脂醇组显著低于氟西汀组(P<0.05,图2)。
2.4 各组大鼠5-HT、NE 和DA 含量比较
与正常组大鼠脑组织中5-HT、NE 和DA 含量比较,模型组均明显减少(P<0.01);与模型组比较,氟西汀组和白桦脂醇组均明显减少(P<0.01),且氟西汀组较白桦脂醇组明显减少(P<0.05,表3)。
2.5 各组大鼠BDNF、NT-3 和NGF 蛋白表达水平比较
与正常组大鼠脑组织BDNF、NT-3 和NGF蛋白相对表达水平比较,模型组均明显减少(P<0.01);与模型组比较,氟西汀组和白桦脂醇组均明显增加(P<0.01);氟西汀组较白桦脂醇组明显减少(P<0.05,图2)。
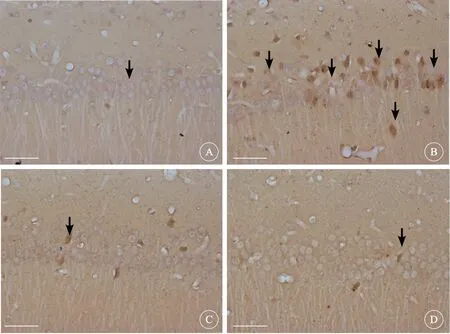
图1 各组大鼠海马区神经元凋亡比较,TUNEL 染色,×400Fig1 Comparison of neuron apoptosis in the hippocampus of rats in each group,TUNEL staining,×400
表3 各组大鼠5-HT、NE 和DA 含量比较(n=10,±s,μg/mL)Tab3 Comparison of 5-HT,NE and DA content in rats of each group(n=10,±s,μg/mL)

表3 各组大鼠5-HT、NE 和DA 含量比较(n=10,±s,μg/mL)Tab3 Comparison of 5-HT,NE and DA content in rats of each group(n=10,±s,μg/mL)
**P<0.01 vs normal group;△△P<0.01 vs model group;#P<0.05 vs fluoxetine group
Group 5-HT NE DA Normal group 0.27±0.04 0.89±0.03 0.39±0.05 Model group 0.08±0.03** 0.40±0.05** 0.18±0.08**Fluoxetine group 0.19±0.02△△ 0.68±0.04△△ 0.28±0.03△△Betula platyphylla group 0.26±0.03△△# 0.83±0.03△△# 0.35±0.06△△#
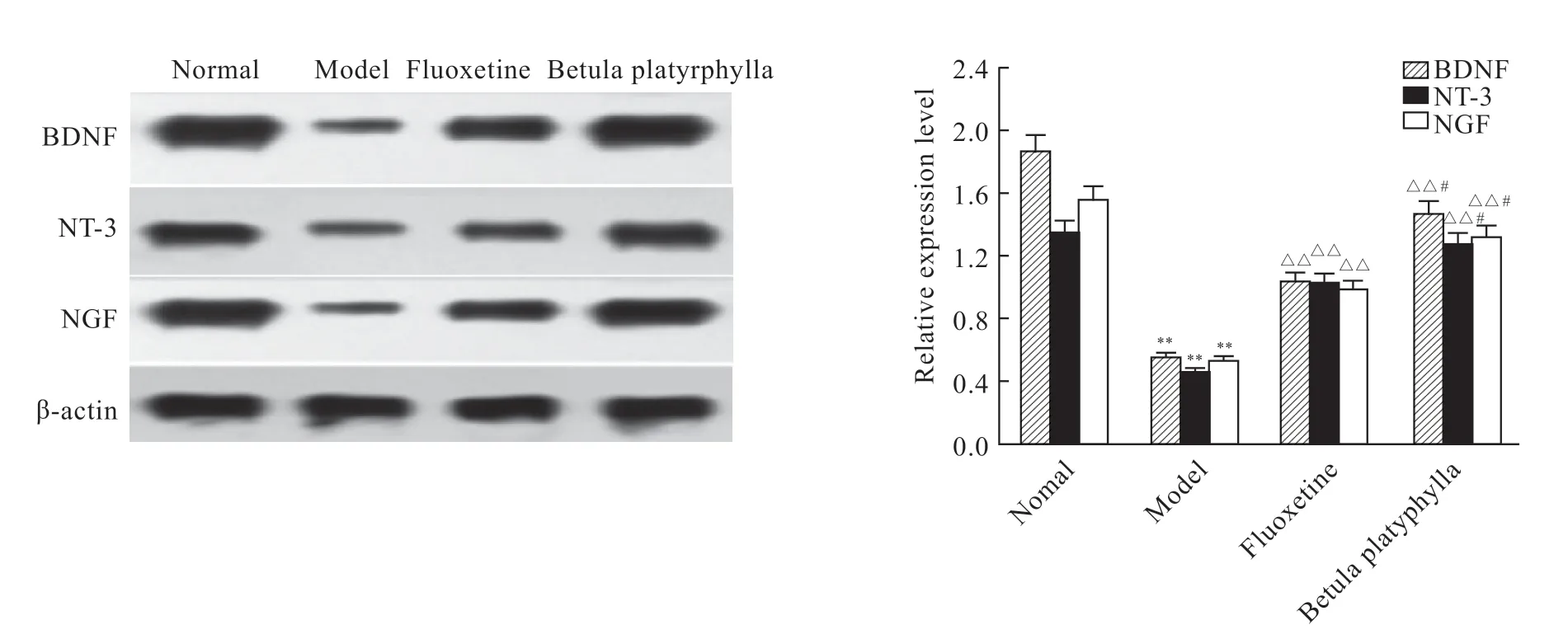
图2 各组大鼠BDNF、NT-3 和NGF 蛋白表达水平比较Fig2 Expression of BDNF,NT-3 and NGF protein in rats of each group
3 讨论
为探讨白桦脂醇的抗抑郁作用,本研究选取慢性应激抑郁模型大鼠为研究对象,观察其在行为学中的变化,检测大鼠海马区神经元细胞凋亡、单胺类神经递质及神经营养因子的表达情况,为进一步研究白桦脂醇提供理论基础。本实验采用改进CUMS 成功建立模型,运用慢性、低水平的应激源导致抑郁状态[9],这与人类发生抑郁的机制更为接近,且CUMS 模型模拟快感缺乏等抑郁症状表现可持续几个月,基本符合抑郁模型的要求。
大多数国家和地区抑郁症的发病率在8%~12%,25~40 岁一般为首次发病年龄,第2个发病高峰为50~60 岁[10]。近年来“单胺假说”的发病机制中神经递质及其受体备受学界关注[11],有学者报道,抑郁焦虑症状在通过药物影响脑内单胺类神经递质功能和提升其在神经突触间的浓度中精神活动、情绪反应、体温调节和学习记忆等功能改善[12]。5-HT、NE 和DA 均为单胺类神经递质[13],这些重要的中枢神经递质,参与多种生理功能和病理状态的调控,并且伴有心境低落、食欲减退、睡眠障碍、昼夜节律紊乱、性功能障碍和运动功能抑制等症状的抑郁症患者,往往伴有5-HT、NE 和DA 水平功能的下降[14]。在本研究中,白桦脂醇治疗可以提高CUMS 大鼠脑内5-HT、NE 和DA 水平,且与氟西汀组相比其水平更高。
神经营养因子(neurotrophin)家族是一类小分子多肽物质,促进神经系统的发育,维持神经系统的功能,在各种神经的生长发育以及再生中起重要作用[15]。神经营养因子具有调节神经元分化发育并促进神经存活、分裂及生长等作用,对抑郁症的抑郁焦虑情绪、认知功能有显著的调节作用,其家族成员包括BDNF、NT-3 和NGF 等[16]。研究表明,抑郁症模型大鼠的海马区神经元凋亡及失活伴随着BDNF、NT-3 和NGF 的表达降低,而上调中枢神经系统中BDNF、NT-3 和NGF 的水平可以调节抑郁行为[17]。Bermingham 等[18]证实,中枢神经中神经元内的BDNF 表达可通过调节单胺类神经递质,结合单胺受体而发挥其生物学作用。并且BDNF 具有调节和保护5-HT 能神经元和DA 能神经元的作用,是两者神经元的重要调控物质[19]。上调抑郁模型大鼠海马区BDNF 的表达以促进5-HT 与NE 的水平,能够缓解大鼠的抑郁焦虑情绪[20]。Duman 等[21]在 2006年提出“抑郁症的神经营养假说”。BDNF对神经纤维重塑、神经元再生与抑郁症的发生发展有深远影响和作用,慢性应激能引起BDNF 水平降低,神经元凋亡数量增加,而BDNF 的表达下调可以增高抑郁焦虑情绪发生,且经抗抑郁药物治疗后,CUMS 模型大鼠海马区BDNF 表达明显升高[22]。在本研究中,白桦脂醇治疗可以提高CUMS 大鼠脑组织BDNF、NT-3 和NGF 水平,且与氟西汀组相比其水平更高,正如既往研究,白桦脂醇可能通过干预神经营养因子水平而影响神经递质水平并改善CUMS 大鼠抑郁水平。
本实验采用多种行为学检测,证实白桦脂醇可以缓解CUMS 模型大鼠抑郁行为,推测其是通过影响神经营养因子BDNF、NT-3 和NGF 的表达,进而调节单胺神经递质水平,从而发挥其抗抑郁的功效。课题组将继续从区域定位角度研究白桦脂醇对神经元再生的影响,深入阐明其对神经结构功能影响的分子机制及作用靶点。

