野皂荚多糖氧化降解产物的体外代谢过程研究
王鑫纯, 徐 伟, 蒋建新, 朱莉伟
(北京林业大学 材料科学与技术学院;林业生物质材料与能源教育部工程研究中心,北京 100083)
肠道微生物菌群主要是指在人体肠道中丰富多样地存在,同时对人体的健康和营养起到关键作用菌群的总称。肠道微生物是人体重要的“微生物器官”,被认为是参与分解膳食纤维、氨基酸、药物,并产生甲烷和维生素,同时与衰老、免疫、饮食、疾病状况、药物使用等诸多生理功能紧密相关[1-2]。人体肠道微生物由1 150种流行物种组成,与大鼠肠道微生物群落在分裂水平上相似,并且在大肠中可以观察到更多的菌群多样性[3]。野皂荚(GleditsiamicrophyllaGordon ex Y. T. Lee,GM),属皂荚科,落叶灌木,主产于太行山,生长于向阳干燥的山坡或路边,广泛分布于河北、河南、山西、山东、陕西等地,资源丰富。野皂荚种子中含半乳甘露聚糖约30%,并主要集中在内胚乳部分,其含聚糖达到75%以上,其主链由β-1,4-糖苷键连接的D-吡喃甘露糖组成,支链由α-1,6-糖苷键连接的D-半乳糖组成,野皂荚半乳甘露聚糖(GMG)的甘露糖与半乳糖之比为3.18 ∶1,其水溶液为假塑性流体,在低浓度时具有高黏度,大分子在自然状态下呈缠绕的网状结构,常常在食品工业中用作增稠剂、持水剂,可用于冰淇淋、色拉酱、果汁、面制品等产品中[4-6]。多糖是人类日常摄入最丰富的饮食成分。从食材或中草药中获得的多糖会对肠道的生理功能产生重要影响,例如促进肠道脂肪的排出,促进粪便中有毒代谢物的排出,以及调节消化酶的活性等[7-9]。有研究表明低聚半乳甘露聚糖可以抑制肠道病原菌促进有益菌的繁殖、调节营养物质代谢降低血糖、调节机体肠道功能改善便秘、增强免疫力和抗氧化能力、作为饲料添加剂、同时具有抗生素的功能等[10-15]。Badia等[16]用产肠毒素大肠杆菌感染猪肠道后,发现半乳甘露聚糖可以显著抑制产肠毒素大肠杆菌在猪肠道细胞表面的粘附,表明半乳甘露聚糖具有一定的肠道保护作用。人体通过饮食摄入的大部分多糖并不能被人体胃肠道消化,但进入大肠后肠道微生物却可以将其加以降解利用。不同碳源因其单糖组成、相对分子质量、取代度和分支连接类型不同而影响肠道菌群的发酵速率。同时在肠道中降解程度及降解速度不同还会引起肠道微生物菌群发生不同变化,直接或间接地影响人体对营养物质的摄取、能量吸收以及免疫系统等机体反应[17]。因此,本研究以不同体积分数的H2O2对GMG进行氧化降解预处理,分析了GMG的氧化降解特性,并选用遗传基因稳定、安全的SD大鼠的肠道菌群模拟人体肠道体外代谢,旨在将半乳甘露聚糖进一步开发成为功能性食品提供理论依据。
1 材料与方法
1.1 原料、试剂与仪器
野皂荚原胶粉(含半乳甘露聚糖62.40%),购于河北涉县龙胶厂;SD大鼠,由北京大学医学院动物部提供。乙酸、丙酸、正丁酸、异丁酸(均≥99.95%),购于国药集团化学试剂有限公司;过氧化氢、氯化钠、氯化钾、碳酸氢钠、氯化铵、一水合硫酸镁、磷酸二氢钾、磷酸氢二钾、氯化钙、七水合硫酸亚铁,均为分析纯,购于北京化工厂;L-半胱氨酸、胰蛋白胨、蛋白胨、酵母浸提物、酪蛋白、粘蛋白、胆汁盐、刃天青和Tween 80,购于上海源叶生物有限公司。
YQX-I厌氧培养箱,上海跃进医疗器械有限公司;pHS-3C型pH计;ALPHA II 傅里叶变换红外光谱仪,德国BRUKER OPTICS;DAWN 8+多角度激光光散射仪,美国WYATT;318C+酶标仪,上海沛欧分析仪器有限公司;UV-2000型紫外-可见分光光度计,美国UNICO;Waters e2695高效液相色谱仪,美国Waters公司。
1.2 野皂荚多糖的纯化
参考文献[18]方法将野皂荚原胶粉配制成质量分数为0.50%的均匀胶液,置于80 ℃下水合30 min。去除水不溶物后,添加无水乙醇,在15 840 r/min下离心15 min,分离沉淀。沉淀物在60 ℃下真空干燥6 h,即得纯化野皂荚多糖粉末,置于干燥器中保存备用。HPLC测得其含半乳甘露聚糖(88.85±3.13)%。
1.3 大鼠肠道菌群的提取
参考蒋婕等[19]报道的方法,并稍作修改。选择SPF级别的健康雌性SD大鼠,周龄为8周,每笼4只,共10笼,25 ℃恒温恒湿饲养,在无菌的环境下,收集大鼠的粪便于无菌袋中,置于-80 ℃冰箱中保存。收集7 d后,将大鼠粪便与生理盐水按1 ∶8(g ∶mL)进行均质化,用四层纱布过滤后,将大鼠肠道菌群悬浊液立即转移到厌氧瓶中备用。
1.4 野皂荚多糖的体外代谢
1.4.1多糖氧化预处理 将纯化野皂荚多糖粉末分别用0.3%、0.6%、1.5%、3.0%和4.5%的H2O2溶液溶解,在45 ℃下磁力搅拌反应12 h,并用乙醇沉淀。沉淀物后续处理同1.2节。不同体积分数H2O2溶液氧化降解预处理后的GMG分别标记为GMG- 0.3、GMG- 0.6、GMG-1.5、GMG-3.0和GMG- 4.5。
1.4.2培养基配制 培养基参考Di等[20]的配制方法,稍作改动。5 g胰蛋白胨、5 g蛋白胨、4.5 g酵母浸提物、4.5 g氯化钠、4.5 g氯化钾、3 g酪蛋白、4 g粘蛋白、1.5 g碳酸氢钠、0.69 g一水合硫酸镁、0.8 gL-半胱氨酸、0.5 g磷酸二氢钾、0.5 g磷酸氢二钾、0.4 g胆汁盐、0.08 g氯化钙、0.642 g氯化铵、0.005 g七水合硫酸亚铁、4 mL 0.025%刃天青以及1 mL Tween 80定容于1 L。在121 ℃下灭菌15 min,以备使用。
1.4.3体外代谢实验 将氧化预处理后的GMG配制成无菌多糖液,大鼠肠道菌悬液、培养基、无菌多糖液按体积比2 ∶2 ∶1在厌氧工作站(厌氧工作条件为V(CO2) ∶V(H2) ∶V(N2)=1 ∶2 ∶17)中涡旋均匀,模拟体外远端盲肠糖代谢。用无氧无菌的蒸馏水作空白样,未经处理的GMG作对照样,分别在0、6、12、24和48 h时进行取样。每个样品设3个平行组。
1.5 分析方法
1.5.1相对分子质量测定 以葡聚糖(相对分子质量25 500)为标准品,0.1 mol/L硝酸钠溶液为溶剂,使用多角度激光散射检测器(MALS),手动进样测定纯化野皂荚多糖和H2O2氧化降解处理后的野皂荚样品(0.20 mol/L)相对分子质量,数据通过Astra软件(版本6.0.2)分析[21]。
1.5.2红外光谱分析 将纯化野皂荚多糖和H2O2溶液预处理后野皂荚半乳甘露聚糖与绝干KBr充分混合、研磨、压片,在波数为4000~400 cm-1的范围内,使用傅里叶变换红外光谱分析。
1.5.3pH值测定 分别在代谢时间为0、6、12、24和48 h,吸取一定量的代谢产物置于冰水中20 min以停止代谢过程。使用pH计测定代谢产物的pH值,每个样品平行测定3次。
1.5.4代谢产物的分析 将乙酸、丙酸、正丁酸、异丁酸、正戊酸制成混合液作为短链脂肪酸(SCFAs)和支链脂肪酸(BCFAs)的标准样品,绘制标准曲线。在0、6、12、24和48 h时取出相应的培养瓶进行取样,在21 756 r/min下离心5 min,取1 mL上清液过0.22 μm微孔滤膜,以5 mmol/L硫酸作为流动相、HPX-87H为色谱柱(柱温为65 ℃)、示差折光检测器(检测器温度为35 ℃,流速为0.6 mL/min)在高效液相色谱仪上进行检测。
1.5.5糖的测定 通过苯酚-硫酸法分别测定0、6、12、24以及48 h时代谢产物中总糖含量[22]。采用二硝基水杨酸法分别测定0、6、12、24以及48 h时代谢产物中还原糖的含量[23]。
2 结果与讨论
2.1 H2O2氧化降解野皂荚多糖的结构分析
2.1.1相对分子质量测定 H2O2的强氧化性可以将多糖的长链随机断裂,使得多糖的相对分子质量降低[24]。本实验中选用的GMG相对分子质量为1 039 400,用体积分数0.3%、0.6%、1.5%、3.0%和4.5%的H2O2溶液进行氧化降解后,其产物GMG- 0.3,GMG- 0.6,GMG-1.5,GMG-3.0和GMG- 4.5的相对分子质量分别为949 429、520 843、382 493、135 300和32 060。可以看出,随着H2O2体积分数的增大,氧化降解所得产物的相对分子质量逐渐减小,但是H2O2氧化预处理后的野皂荚多糖相对分子质量均在万级以上。
2.1.2FT-IR分析 不同体积分数H2O2氧化降解GMG的红外光谱图见图1。由图1可以看出,H2O2氧化降解野皂荚多糖结构并没有改变。图中3400~3300 cm-1的宽峰是多糖分子中—OH的伸缩振动峰,2930 cm-1出现了—CH2—的非对称伸缩振动吸收峰,这是多糖的特征吸收峰。1660 cm-1出现的峰是野皂荚多糖胶所吸收的水分子的2个—OH剪切所形成的吸收峰,1146和1080 cm-1的峰为C—O伸缩振动吸收峰,870 cm-1出现的峰是β-吡喃糖苷键的特征吸收峰,810 cm-1出现的峰是野皂荚多糖胶骨架的伸缩振动峰。
2.2 体外代谢过程分析
2.2.1代谢过程中pH值变化 代谢过程中在肠道菌群作用下会产生SCFAs和BCFAs,导致发酵液的pH值下降,因此pH值是代谢过程中的重要指标之一。如图2所示,代谢培养液初始pH值为7.00~7.30,随着肠道微生物代谢反应的进行,空白组pH值基本不变,经过H2O2预处理GMG多糖组pH值在6 h后迅速降至5.70,然后逐渐降至5.10;而未经过H2O2预处理的GMG多糖组pH值变化相对较小。这主要是因为pH值变化与代谢产物中SCFAs及BCFAs的浓度相关,随着代谢时间的变化,代谢产物中SCFAs和BCFAs的含量增大从而导致pH值逐渐降低[25]。多糖实验组pH值变化趋势基本一致。未经过H2O2预处理的GMG代谢产物pH值降到5.39,而GMG- 0.3、GMG- 0.6、GMG-1.5、GMG-3.0和GMG- 4.5代谢产物pH值分别降到5.15、5.16、5.12、5.05和5.01。pH值的适当降低可以促进一些有益结肠微生物菌群的繁殖,并抑制一些有害微生物的繁殖[26]。
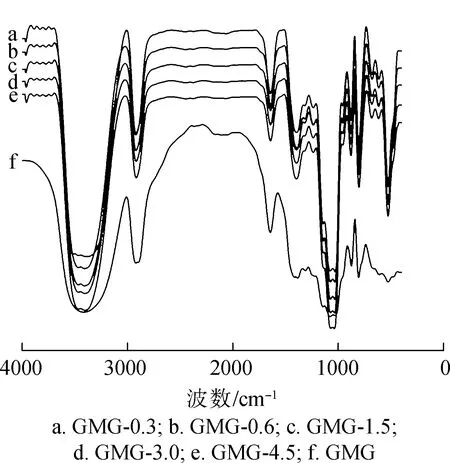
图1 H2O2预处理前后GMG的红外谱图
Fig.1 FT-IR of GMG before and after pretreated by different volume fraction of H2O2solution
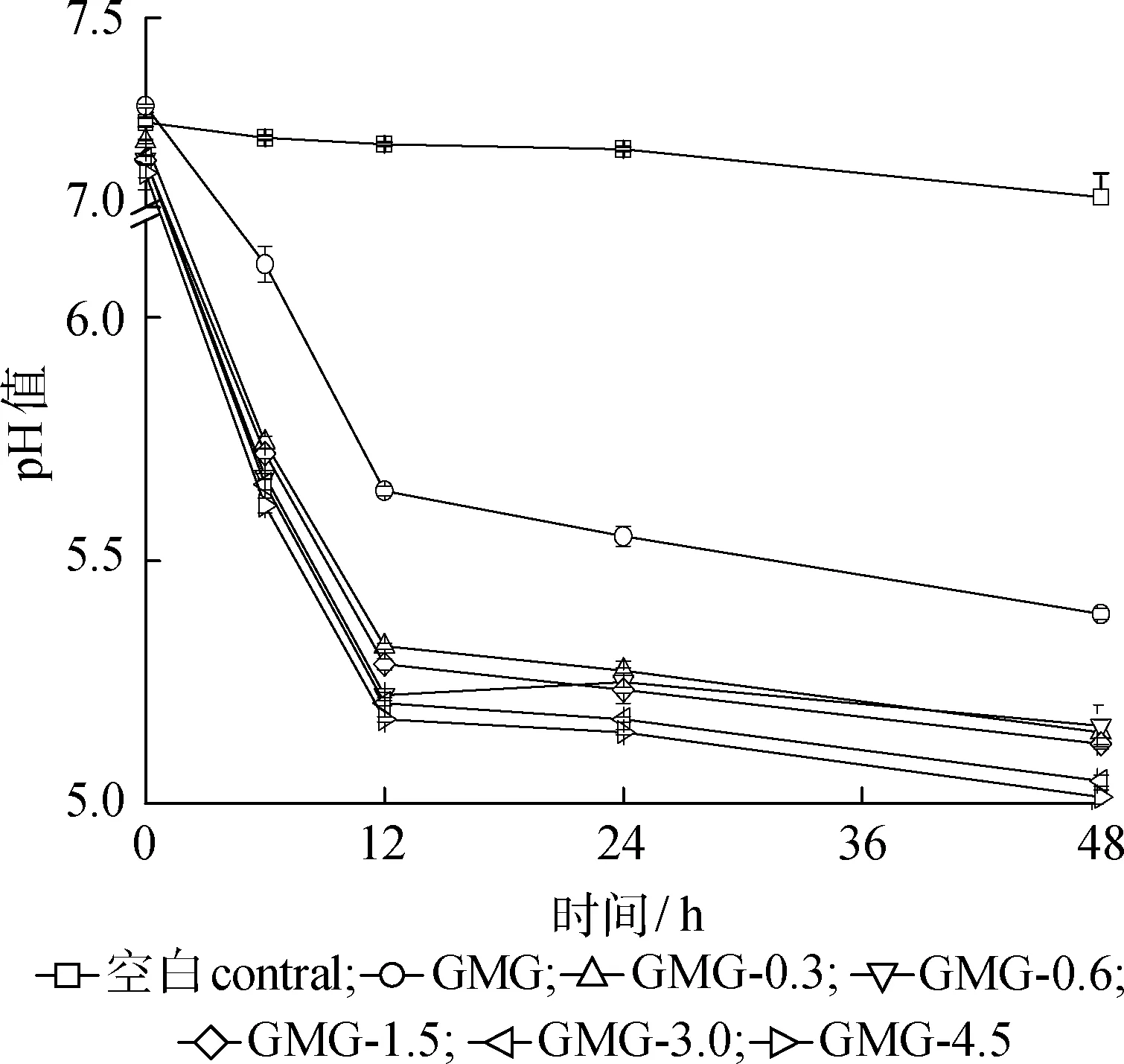
图2 H2O2预处理前后GMG代谢过程中的pH值
Fig.2 pH value of metabolites of GMG before and after pretreated by H2O2
2.2.2代谢产物中SCFAs和BCFAs的含量变化 代谢产物除了pH值这个重要指标外,代谢产物中的SCFAs、BCFAs含量也是代谢过程中的重要指标。乙酸和丙酸是半乳糖和甘露糖分解过程的次级代谢产物。代谢中间物在甘露糖酶和半乳糖酶系的催化作用下生成磷酸化的半乳糖和甘露糖,在相关酶的作用下进行异构及转化,从而进入糖代谢途径[27]。
当多糖被用作碳源时,产生的SCFAs主要是乙酸。由表1可知,未经过H2O2预处理的GMG多糖组在6 h开始有乙酸积累,浓度为4.92 mmol/L,并随着时间的延长浓度逐渐增加,48 h时浓度为15.89 mmol/L。而经过预处理的GMG多糖组0到6 h之间未能检测到乙酸,12 h开始逐渐累积,浓度在2.31~4.01 mmol/L,24 h后浓度激增至12.26~17.35 mmol/L,随后逐渐放缓,48 h时测得GMG- 0.3、GMG- 0.6、GMG-1.5、GMG-3.0和GMG- 4.5代谢产物中乙酸浓度分别为21.72、25.36、21.07、21.36和15.21 mmol/L,其中GMG- 0.6代谢产物乙酸浓度最高。有研究表明乙酸能够改善高血脂饮食大鼠的葡萄糖耐量和胰岛素分泌,同时乙酸也是能量物质之一,可以被结肠上皮细胞吸收,然后经过循环系统转移到靶细胞,以提供能量[28]。
由表1可知,多糖实验组与空白对照组在0 h已检测到少量的丙酸,这可能是由于大鼠的盲肠内容物中本身含有的,代谢前12 h丙酸产量较少,而代谢到48 h时,丙酸快速累积,浓度增加了2~3倍。未经过预处理的GMG多糖组在0~6 h之间丙酸浓度下降,可能是由于微生物在进行大量的生理代谢活动,直至48 h时丙酸浓度为4.05 mmol/L;而经过H2O2预处理的GMG多糖组除GMG- 4.5代谢产物中丙酸浓度较低外,其余的丙酸浓度差别不显著,48 h时浓度分别为10.25、10.07、9.73、9.51和6.82 mmol/L。丙酸在脂质代谢中具有关键性作用,因为丙酸可以抑制脂肪合成,可减弱与肥胖有关的炎症和减少脂肪的生成,对脂肪组织有直接的有益影响[29]。

表1 GMG代谢不同时间代谢产物中SCFAs及BCFA含量变化1)
1)同列不同字母表示在不同时刻之间存在显著差异different letters in the same column indicate that there are significant differences between different moments (p<0.05), 下表同the same as following tables
由表1可知,在整个代谢过程中正丁酸的积累略有不同,未经过预处理GMG组在12 h时才有正丁酸积累,48 h浓度为3.96 mmol/L;而经过H2O2预处理GMG多糖组在0~6 h时就开始了大量的代谢作用,24 h时其浓度略有波动,但到48 h时浓度明显增加,GMG- 4.5代谢产物情况例外,在代谢6~48 h期间,正丁酸浓度一直在8 mmol/L左右波动。在48 h时测得5种H2O2预处理GMG代谢产物中正丁酸浓度分别为8.57、9.62、11.09、9.43和7.85 mmol/L。正丁酸盐作为结肠上皮细胞的直接能量来源,具有抗炎特性,对常见的病原体有抑制作用,如产荚膜梭菌、沙门氏菌和坏死性肠炎等,并且能够增强结肠环境的防御屏障,对糖尿病以及胰岛素的拮抗具有有益影响[30-31]。
由表1和图2结合来看,在0~12 h代谢期间,主要是正丁酸对总酸浓度涨幅影响较大,在12~48 h 之间,由于乙酸和丙酸的大量积累而导致总酸浓度激增。有研究表明代谢产物的pH值变化与代谢产酸类型之间有一定关系。当pH值为4~5时,趋向于乙酸的产生;当pH值为5~6时,趋向于丙酸的产生;当pH值为6~7时,趋向于丁酸的产生[32]。本实验结果与该规律一致。由表1中总SCFAs浓度可以看出,多糖代谢组总SCFAs浓度均显著高于空白对照组,并在0~48 h之间总SCFAs浓度逐渐增加,在48 h时总SCFAs浓度分别为40.54、45.05、41.89、40.29和29.88 mmol/L,GMG- 0.6所产生的SCFAs最多。可以看出,多糖代谢组比空白对照组代谢更剧烈。
乙酸、丙酸、正丁酸均被视为糖代谢过程中能量物质的代谢产物,对健康有益。而在蛋白质代谢过程中,会产生一些代谢物,若长期存在对健康非常不利,比如氨、BCFAs等。在本实验中BCFAs仅检测到了异丁酸,由表1可以看到,未经过预处理的GMG多糖组在48 h代谢期间,累积的异丁酸浓度均大于1.50 mmol/L,长期积累不利于人体健康。而经过H2O2预处理的GMG多糖组BCFAs浓度均在0~1.50 mmol/L范围内,GMG- 0.3、GMG- 0.6、GMG-1.5和GMG-3.0糖代谢产物中异丁酸浓度均为先增加后减少至0 mmol/L,而GMG- 4.5糖代谢产物中异丁酸浓度则是在6 h增加至1.37 mmol/L后,随后有所降低,24 h后又趋于上升,48 h时达到1.38 mmol/L。
由于代谢过程中碳源的单糖组成、相对分子质量、取代度和分支连接类型均会影响其代谢过程,所以通过不同体积分数的H2O2预处理后GMG的代谢过程也不同。预处理GMG实验组中,GMG- 4.5相对分子质量最小为32 060,其产生的SCFAs浓度最低为29.88 mmol/L,但其产生的BCFAs浓度却在48 h 时是最高的,为1.38 mmol/L,这并不利于人体健康。而GMG- 0.6的相对分子质量为520 843,其产生的SCFAs浓度最高为45.05 mmol/L,48 h时产生的BCFAs浓度已代谢降至0 mmol/L,有利于生物体生长代谢,对健康有益。
2.2.3代谢过程中总糖及还原糖的变化 肠道微生物在代谢过程中会产生一些酶,这些酶可以对代谢培养物中的聚糖产生作用,使其相对分子质量逐渐降低,从而被肠道菌群利用。因此总糖和还原糖的浓度变化经常被用作衡量碳水化合物代谢程度的指标之一。如表2所示,多糖实验组中的总糖初始质量浓度约为(0.500±0.002)g/L,经过微生物代谢后均大幅下降。总糖在0~48 h之间变化较大,这与SCFAs和BCFAs的变化一致。GMG- 0.6代谢产物中总糖的消耗量最多,从(6.63±0.99)% 增加到(52.86±3.11)%。
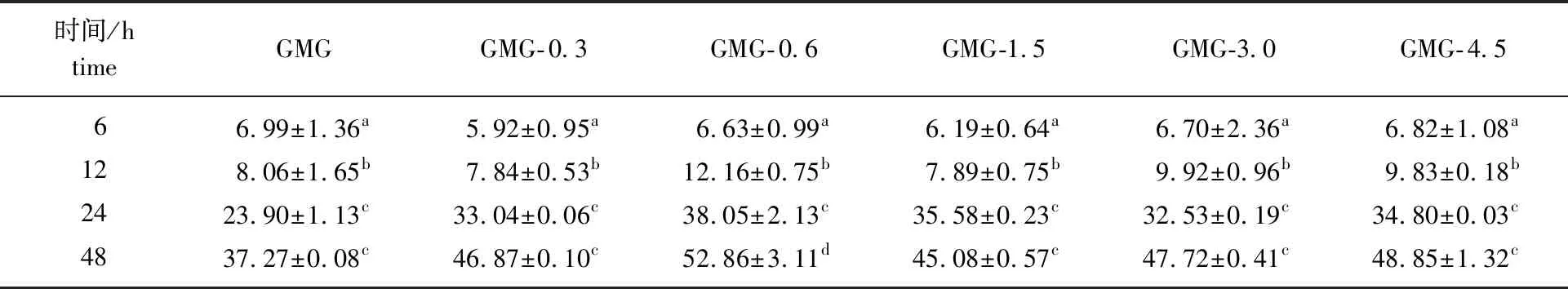
表2 GMG代谢不同时间代谢产物中的总糖消耗率
表3为不同体积分数H2O2处理后的多糖代谢产物中的还原糖浓度。
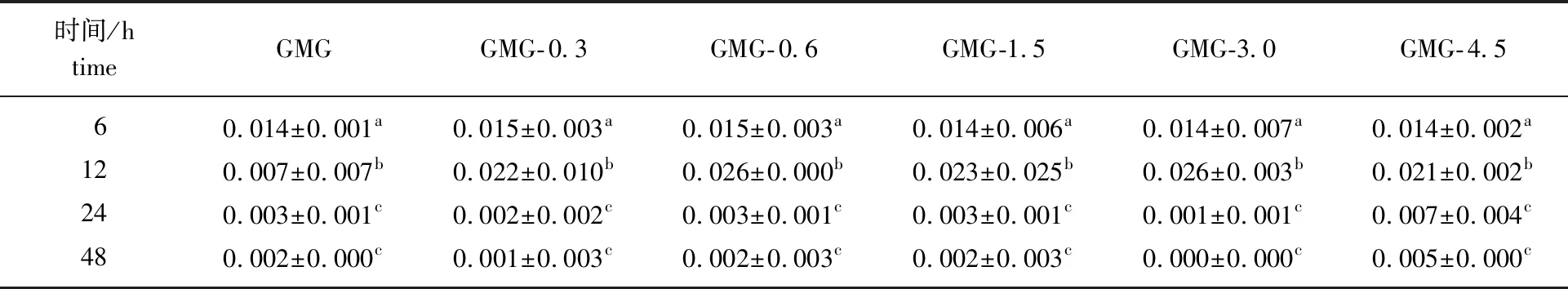
表3 GMG代谢不同时间代谢产物中的还原糖质量浓度
由表3可知,在代谢过程中,未经过处理的GMG代谢产物中的还原糖浓度是逐渐下降的,可能是由于GMG不易被微生物利用;而经过处理后的GMG其代谢产物中的还原糖浓度先增大后减小,结合SCFAs和BCFAs浓度变化可以看出,从0~6 h的代谢过程中,肠道菌群首先代谢容易利用的寡糖,同时分泌能够降解半乳甘露聚糖的酶——α-半乳糖苷酶和β-甘露聚糖酶,从而产生更多的寡糖和还原糖,在12 h时还原糖浓度达到最大[33]。在12 h之后,肠道菌群快速将环境中游离的还原糖代谢利用。以上研究表明,GMG可以被肠道菌群很好地利用。
由图3可以看出,GMG- 0.6代谢情况最佳,在48 h时其总SCFAs浓度和总糖消耗率均最高,分别为45.05 mmol/L和(52.86±3.11)%,表明GMG- 0.6代谢作用最剧烈。然而,GMG- 0.6相对分子质量并不是最小,这可能是因为氧化降解过程中产生的寡糖数量较多,或是氧化降解使得醇沉出来多糖的取代度值较适宜,有利于肠道微生物代谢利用,并分泌大量相关酶,从而整个代谢过程较为旺盛。

图3 GMG代谢过程中总糖(a)以及总SCFAs(b)变化趋势Fig.3 Changes of total sugar(a) and total SCFAs(b) of GMG under metabolism
实验结果表明:半乳甘露聚糖可以被肠道菌群利用,并且代谢产生大量的SCFAs,对抗炎、葡萄糖耐量、控制胰岛素分泌和控制血糖等方面有一定帮助。今后研究中可以对肠道微生物菌群进行分析,阐述野皂荚半乳甘露聚糖在病理上的功能性,并进一步进行大鼠体内代谢实验,揭示体内代谢机制,从而为临床用药等方面提供理论支撑。
3 结 论
3.1实验将野皂荚半乳甘露聚糖(GMG)用0.3%、0.6%、1.5%、3.0%和4.5% H2O2溶液氧化降解,得到产物GMG- 0.3、GMG- 0.6、GMG-1.5,GMG-3.0和GMG- 4.5,与SD大鼠的肠道微生物进行培养,在体外模拟远端人体盲肠利用野皂荚半乳甘露聚糖的情况。结果表明:随着预处理H2O2体积分数的提高,GMG的相对分子质量逐渐降低,由未处理(GMG)的1 039 400降至32 060(GMG- 4.5),红外光谱分析表明GMG经H2O2氧化降解后官能团无显著变化。
3.2不同GMG代谢产物的pH值差异并不显著,除空白组外,多糖实验组均呈现下降的趋势。从SCFAs和BCFAs浓度变化来看,多糖实验组所产生的各种酸浓度均显著高于空白组,并且产酸类型与代谢产物的pH值变化有关。
3.3肠道微生物在其分泌的有关酶的作用下,可以将半乳甘露聚糖代谢利用,不同体积分数H2O2预处理GMG代谢产物在SCFAs和BCFAs浓度变化、总糖以及还原糖浓度之间的差异,与H2O2预处理后GMG的单糖组成、相对分子质量、取代度不同有关。GMG- 0.6代谢情况最佳,代谢产生乙酸浓度最高为25.36 mmol/L,总SCFAs浓度最大为45.05 mmol/L,总糖消耗率最大为(52.86±3.11)%。

