葡萄籽多酚提取条件优化及其脂肪酶抑制影响
姜帆,吴子健,侯惠静,张一然
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津天狮学院食品工程学院,天津 301700;3.天津商业大学艺术学院,天津 300134)
我国葡萄产量丰富,但仅有少量直接食用,大部分的葡萄常常用于酿酒以及制备干果等快销食品.在此过程中会产生大量的葡萄皮、葡萄籽等副产物[1-2].葡萄籽中多酚的提取与利用能够提高葡萄的综合开发,同时避免环境污染.研究表明葡萄籽多酚具有较强的抗氧化能力,可抗炎、抑制肿瘤、预防心血管疾病以及清除自由基等[3-7];另外,葡萄籽多酚还具有胰脂肪酶抑制活性,能够影响机体对脂肪的消化[8],使用葡萄籽多酚作为减肥产品,可以避免通过影响中枢神经系统抑制人的食欲来减肥所造成的机体神经系统的伤害[9-10].
多酚的提取主要有溶剂提取法[11]、超声波辅助提取法[12]、超临界流体萃取技术[13]等方法,其中溶剂提取法由于其简便利于操作的特点,目前仍被广泛应用。李曌等[14]研究了不同的溶剂类型对葡萄籽多酚提取的影响;李华等[15]在葡萄籽中提取的多酚得率为3.3%左右。目前葡萄籽多酚的提取效率有待提升[16].现阶段对葡萄籽的开发利用主要集中在葡萄籽油、抗氧化性质的应用方面[17],而关于葡萄籽多酚类物质的脂肪酶抑制作用的研究很少。本研究通过Plackett-Burman试验和响应面试验优化葡萄籽多酚的提取工艺条件,提高葡萄籽多酚的利用率,并进一步利用大孔吸附树脂法对所提取的葡萄籽多酚进行分级分离,研究分析不同体积分数乙醇洗脱液所得的葡萄籽多酚组分对胰脂肪酶的抑制效应,以便为葡萄籽的进一步开发利用提供科学依据.
1 材料与方法
1.1 试验材料与试剂
试验用葡萄籽由天津王朝葡萄酒业有限公司提供;AB-8大孔吸附树脂购自天津南开化工厂;三丁酸甘油酯、猪源胰脂肪酶、纤维素酶购自Sigma公司;其余试剂均为国产分析纯.
1.2 试验仪器与设备
FW80微型高速万能粉碎机(天津市华鑫仪器厂)、ICC basic加热循环恒温器(德国IKA)、3-18K台式高速冷冻离心机(德国SIGMA公司)、DHG-9920A-L型电热鼓风干燥箱(上海丙林电子科技有限公司)、NTS-4000C型恒温振荡水槽(东京理化器械株式会社)、R-200旋转蒸发仪(日本EYELA公司)、FH10型单通道蠕动泵(美国Catalyst公司)、AL204型电子天平(梅特勒-托利多仪器上海有限公司)、UV5紫外可见分光光度计(梅特勒-托利多仪器上海有限公司)、FDU-810型冷冻干燥机(日本东京理化).
1.3 试验方法
1.3.1 制备工艺路线 葡萄籽→冷冻干燥→粉碎过20目筛→正己烷脱脂→有机溶剂萃取→真空浓缩→冷冻干燥→AB-8大孔树脂吸附提取葡萄籽多酚→真空浓缩→冷冻干燥
1.3.2 葡萄籽的预处理[18]葡萄籽多酚提取前需要经过预处理,具体步骤如下:葡萄籽经冻干,然后粉碎过20目筛,将葡萄籽粉与正己烷1.0∶2.5(M/V)比例混合,4 ℃下脱脂30.0 min,然后经离心(3 000g,4 ℃)10.0 min取沉淀弃上清,脱脂步骤重复两次,最后烘干得到脱脂的葡萄籽粉.
1.3.3 葡萄籽多酚提取浸提溶剂的选择 5.00 g葡萄籽粉混悬于50 mL磷酸缓冲液(pH5.0)中,加入纤维素酶(添加量为0.1 mg/mL)50 ℃下酶解2 h[19];然后进行有机溶剂提取,选取的有机溶剂分别为体积分数为60%的乙酸乙酯、乙醇、甲醇以及丙酮溶液,提取温度为40 ℃,提取时间为30.0 min,料液比为1∶9(M/V)、提取次数为3次[20-23];所得多酚浸提液经真空浓缩以及冷冻干燥得到粗提物,测定比较粗提取的多酚含量.
1.3.4 总多酚含量的测定 葡萄籽提取物中总多酚含量的测定按照Folin-Ciocalte法[24]进行,以单宁酸作为标准物质,在765 nm处测定吸光度值.
1.3.5 葡萄籽多酚提取条件的优化 为确定葡萄籽多酚类物质的最佳提取条件,以总多酚提取量为响应值,采用三步法进行试验条件优化.首先采用Plackett-Burman试验设计挑选出对响应影响较大的几个因素(表1)[25],然后以最陡爬坡试验确定响应值最大时的中心试验点,最后再利用响应曲面法中的中心复合设计进行试验,通过试验数据拟合得到二阶响应面模型,最终确定最优的葡萄籽多酚提取条件,并进行验证[26].
1.3.6 AB-8大孔吸附树脂对葡萄籽多酚吸附性能的考察 分别绘制AB-8大孔吸附树脂对葡萄籽多酚的等温吸附曲线和静态吸附动力学曲线,并测定不同质量浓度葡萄籽提取液对大孔树脂吸附量的影响,具体步骤如下:

表1 葡萄籽多酚提取条件优化的Plackett-Burman试验设计
分别取处理好的AB-8大孔吸附树脂1.0 g加到5.0、10.0、20.0、30.0以及40.0 mL的葡萄籽多酚粗提溶液(质量浓度为4.0 mg/mL)中,于25 ℃下静态吸附24 h,然后测定上清液中总多酚总量并绘制葡萄籽多酚与AB-8大孔吸附树脂间的等温吸附线.
将预处理好的AB-8大孔吸附树脂1.0 g置于100 mL葡萄籽多酚溶液(质量浓度为4.0 mg/mL)中,具塞锥形瓶中密封并于25 ℃下以120 r/min的速度进行恒温振荡,定时测定上清中的多酚含量,并按照公式(1)计算AB-8大孔吸附树脂对葡萄籽多酚的比吸附量,并绘制其静态吸附曲线.
取预处理过的AB-8大孔吸附树脂各1.0 g于250 mL的具塞锥形瓶中,再分别将质量浓度为1.0、3.0、5.0、7.0、9.0 mg/mL的葡萄籽提取液100 mL加入锥形瓶中,密封置于恒温振荡器,25.0 ℃、120 r/min条件下震荡,24 h后从上清液中取样,按照公式(1)计算比吸附量,研究葡萄籽多酚溶液的质量浓度对AB-8大孔树脂吸附量的影响.
(1)
式中,C0:吸附前葡萄籽多酚提取液中多酚含量(mg/mL);Ci:吸附后葡萄籽多酚提取液中多酚含量(mg/mL);V:测试样液体积(mL);M:AB-8树脂的湿质量(g).
1.3.7 AB-8大孔吸附树脂法分离葡萄籽多酚[28]利用AB-8大孔吸附树脂法分离葡萄籽多酚,分离条件如下:层析柱规格为16 mm ×400 mm;层析柱材料为处理好的AB-8大孔吸附树脂;上样量为600 mL葡萄籽多酚粗提液(质量浓度7.5 mg/mL);上样流速和洗脱速率均为1.0 mL/min;洗脱溶液为乙醇溶液,体积分数分别为20%、40%、60%、80%.将不同体积分数的乙醇洗脱液分别收集,浓缩干燥,备用.
1.3.8 脂肪酶抑制率的测定 按照You Q等[29]的方法取15 mL 50 mmol/L pH7.0的磷酸盐缓冲液,加入0.5 g三丁酸甘油酯,再加入1 mL 2.0 mg/mL葡萄籽多酚溶液于37 ℃条件下搅拌5 min,加入1 mL猪胰脂肪酶(12IU)反应3 min,用15 mL的95%乙醇灭活,用氢氧化钠溶液(0.1 mol/L)标定,记录消耗氢氧化钠的量.
脂肪酶抑制剂的抑制率,按公式(2)计算:
(2)
测定1.0、2.0、3.0、4.0、5.0 mg/mL葡萄籽浸提物溶液对脂肪酶活力的抑制率,绘制出葡萄籽多酚溶液浓度和抑制率的关系曲线,找出IC50值.
1.4 数据统计

2 结果与分析
2.1 不同提取剂对葡萄籽多酚提取率的影响
按照1.3.3试验方法,测定比较了4种提取溶剂对葡萄籽多酚的提取能力,结果如图1所示.
图1显示不同溶剂提取葡萄籽多酚的提取率从高到低排列依次是乙醇>丙酮>乙酸乙酯>甲醇.其中提取溶剂为乙醇时,葡萄籽多酚的提取率最高,达到12.11%,并且提取率与其他溶剂相比存在显著差异(P<0.05),因而确定乙醇溶液为葡萄籽多酚的提取溶剂.
2.2 响应面法优化葡萄籽多酚的提取条件
2.2.1 Plackett-Burman试验筛选显著因素 根据Plackett-Burman试验组合设计原理,设计了12个试验点的响应分析试验,其结果见表2.通过试验结果以及DesignExpert 8.0软件的分析结果,为下一步的研究从选取的各因素中筛选出显著因素[30].

小写字母不同表示差异显著(P<0.05).
经回归拟和后,各试验因素对响应值的影响可用如下函数表示:
Y=13.1+0.024X1-0.059X2+0.444X3+1.01X4-0.755X5+0.259X6
S=0.987 358,R-Sq=82.1%,R-Sq(调整)=60.5%.
Plackett-Burman试验每个因素分别选取了高(1)和低(-1)两个水平,以葡萄籽得率作为响应值,通过比较两水平因素的差异性和整体的差异性确定因素之间的显著性来筛选因素,达到节约试验耗材、提高试验响应值的目的[31].如表3所示,试验因素X4(温度)和X5(时间)对响应值在95%水平上影响显著,而乙醇体积分数、纤维素酶添加量、料液比、提取次数对响应值的影响不显著.因此,根据plackett-Burman试验结果选取X4和X5这两个显著影响得率的因素进行下一步试验[32],其他因素取值为乙醇体积分数70%、纤维素酶添加量0.5 mg/mL、料液比1∶10、提取次数4次.
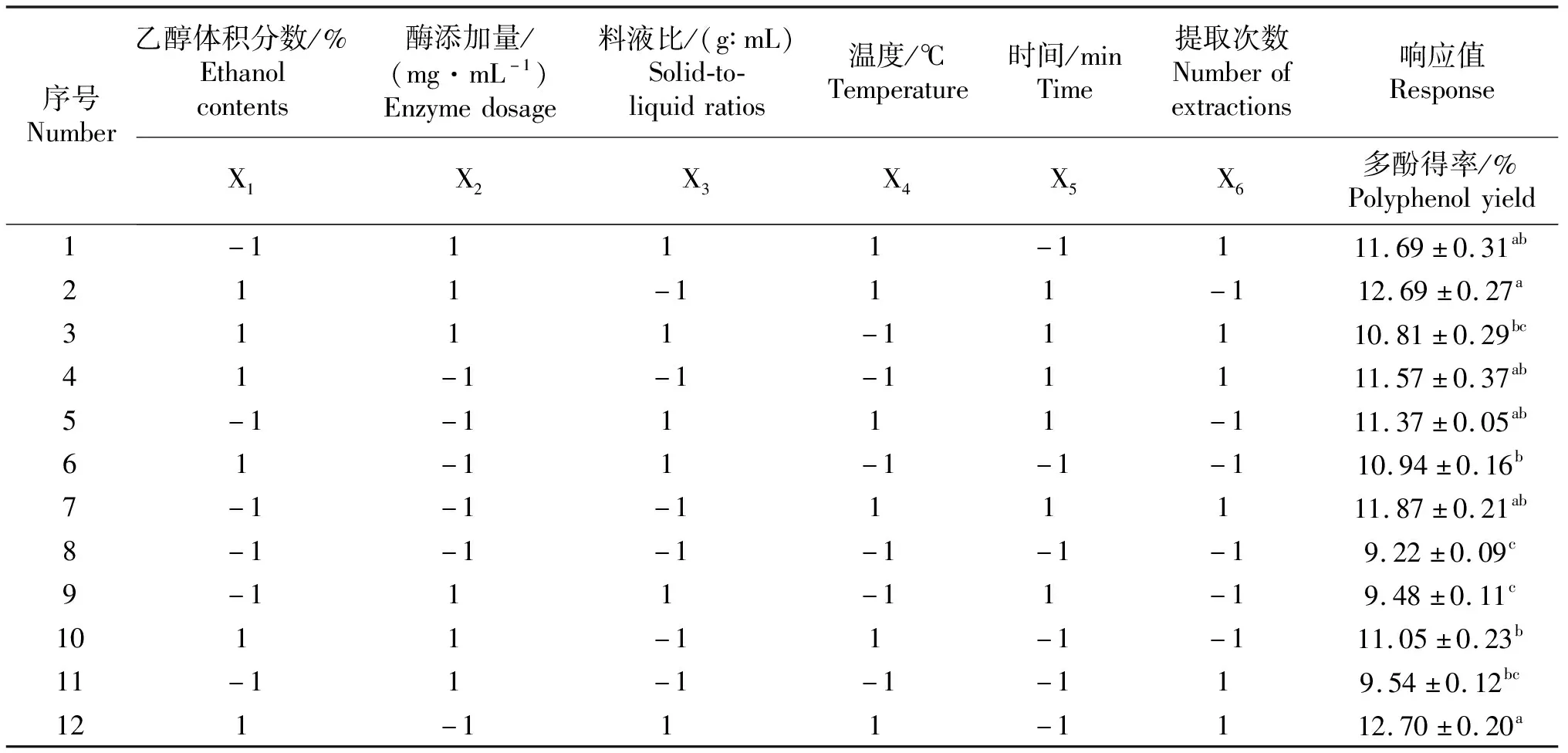
表2 Plackett-Burman试验结果
2.2.2 最陡爬坡试验 最陡爬坡试验以试验值变化的梯度方向作为爬坡方向,根据Plackett-Burman试验结果得出的两个关键因素效应确定变化步长,逼近最大响应区域.

表3 Plackett-Burman试验结果的回归分析
α=0.05
如表4所示,当提取温度为55 ℃、提取时间为40 min时,葡萄籽多酚的提取率显著高于其他组合(P<0.05),选择这一点作为响应面试验设计的中心点.
2.2.3 中心复合试验 如表5所示,进行了因素数为2,试验次数为13次,中心点5个的响应面分析试验.
拟合的二次回归方程式为:Y=8.218 42X4+1.927 76X5+0.057 200X4X5-0.091 710X4X4-0.064 170X5X5-240.286 19,决定系数R2=0.996 4,说明回归方程的拟合程度较好.

表4 最陡爬坡试验结果
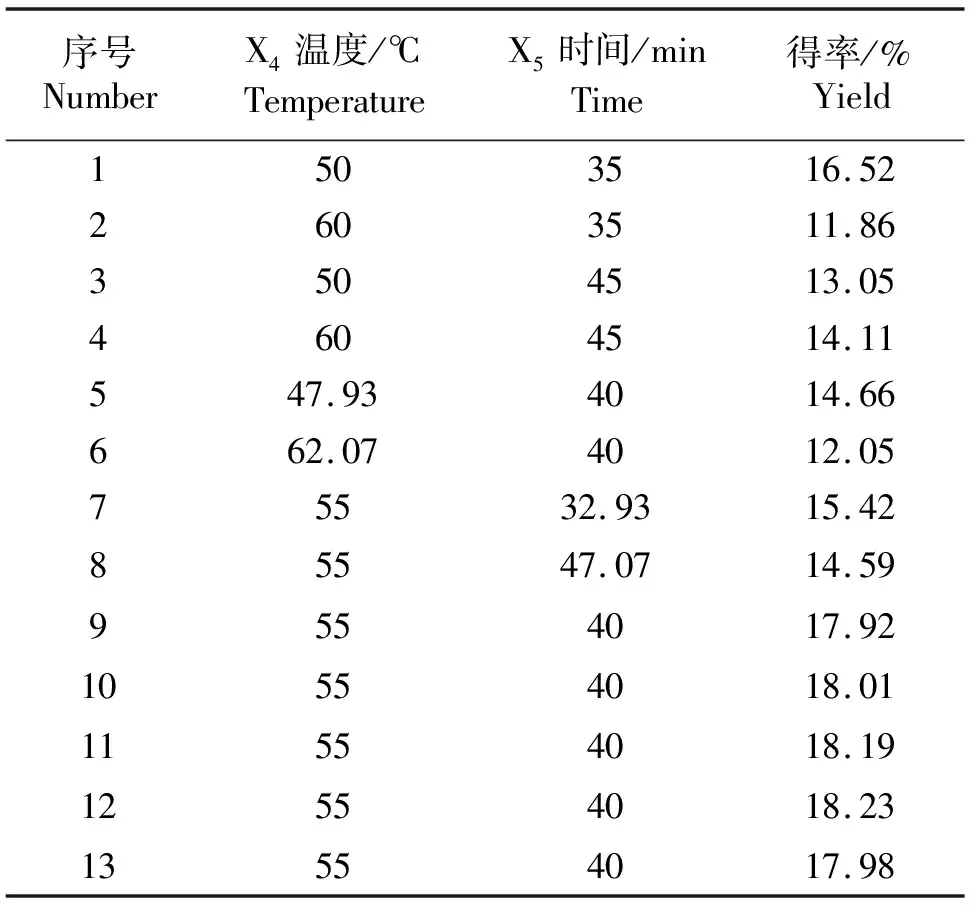
表5 中心复合试验结果
使用Design Expert 8.0.6软件对中心复合试验结果进行回归分析,得到响应面二次模型的方差分析表,结果如表6所示.

表6 响应面二次模型的方差分析
从表6中可以看到,回归方程的模型显著(P<0.05),失拟项不显著(P=0.148 1>0.05),表明此模型能较好的与本试验数据拟合,用上述回归方程可很好地描述温度、时间与得率之间的关系.同时其自变量一次项温度(X4)、时间(X5)、二次项X4X5、X4X4、X5X5显著(P<0.05),从X4、X5和X4X5的P值可看到温度和时间对葡萄籽多酚的提取率有重要影响.
由图2~3可知,在一定范围内,总趋势是葡萄籽多酚的提取率随温度的升高先增加然后减少,时间对葡萄籽多酚提取率的影响也是先增加后减少[33].采用Design Expert 8.0.6软件对回归方程进行分析,得到提取葡萄籽多酚类物质的最佳工艺条件为:乙醇体积分数为70%,纤维素酶添加量为0.5 mg/mL,料液比为1∶10,浸提温度为53.76 ℃,浸提时间为38.96 min,浸提次数为4次,此时葡萄籽多酚提取率预测值为18.31%,为了方便实际操作,将提取工艺参数修正为:乙醇体积分数为70%,纤维素酶添加量为0.5 mg/mL,料液比为1∶10,浸提温度为54 ℃,浸提时间为39 min,浸提次数为4次.

图2 葡萄籽多酚得率与时间、温度的等值线图
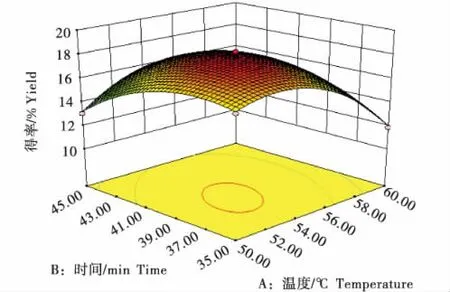
图3 葡萄籽多酚得率与时间、温度的曲面图
2.2.4 验证与比较试验 利用上述响应面法试验得到的葡萄籽多酚类物质的提取条件,进行3次提取试验(平行试验),结果见表7.此时葡萄籽多酚的得率为(18.24±0.05)%,与预测值较为接近,说明模型与实际情况基本吻合.

表7 验证与比较试验结果
2.3 AB-8大孔吸附树脂对葡萄籽多酚的吸附研究
2.3.1 AB-8树脂对葡萄籽多酚的等温吸附线 大孔树脂对于不同的吸附对象,有不同的吸附性能力.吸附等温线可以表征吸附剂与吸附剂之间的定性相互作用.吸附等温线可以描述一定温度下目标在树脂表面的积累规律.从吸附等温线可以推断出树脂的吸附过程和机理,从而更好地控制吸附过程[34].
在25 ℃时,溶液中的葡萄籽多酚浓度对树脂上吸附的葡萄籽多酚的浓度作图的结果如图4所示.根据Brunauer等划分的典型等温吸附线类型及De Vault,D.J.提出的“优惠”和“非优惠”平衡曲线的概念[35-36],AB-8大孔吸附树脂对葡萄籽多酚的等温吸附线属于向上凸的“优惠”吸附等温线,与Langmuir吸附相符,为单分子层吸附,并且随着葡萄籽多酚溶液体积的增加,AB-8树脂对葡萄籽多酚的吸附量也增加,表明AB-8树脂对葡萄籽多酚的吸附性能良好.
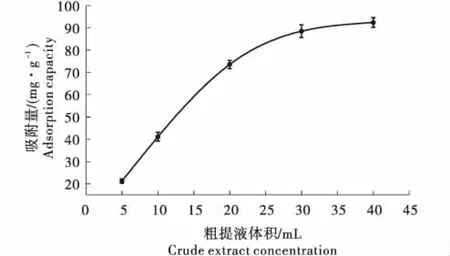
图4 AB-8大孔吸附树脂对葡萄籽多酚的等温吸附线
2.3.2 AB-8树脂的吸附动力线的绘制 在25 ℃,AB-8树脂吸附葡萄籽多酚过程中,吸附时间对AB-8大孔吸附树脂上吸附的葡萄籽多酚的吸附量作图,如图5所示.
由AB-8大孔吸附树脂对葡萄籽多酚的静态吸附曲线可以看出,AB-8大孔吸附树脂的吸附量随时间的增加而逐渐增大,6 h后吸附量趋于稳定,说明6 h后基本达到吸附平衡,葡萄籽多酚于大孔吸附树脂之间的吸附是以物理吸附为主,属于慢性吸附类型.
2.3.3 不同的葡萄籽提取液浓度对AB-8树脂吸附性的影响 如图6所示,多酚质量浓度小于7.0 mg/mL时,AB-8吸附树脂对葡萄籽多酚的吸附能力随着葡萄籽多酚质量浓度升高而增加,当多酚质量浓度大于7.0 mg/mL时,AB-8大孔吸附树脂对葡萄籽多酚的吸附能力随着多酚质量浓度的升高反而呈下降趋势.这可能是因为在多酚溶液质量浓度较低时,提高葡萄籽多酚溶液的质量浓度,可以增加多酚分子与树脂的接触面积,加速多酚进入树脂内部.但当葡萄籽多酚质量浓度增加至一定程度后,继续升高质量浓度会使溶液粘度增大,不利于多酚分子的扩散且容易产生沉淀,对树脂造成污染并容易堵塞[37].同时,溶液质量浓度增加,试液中杂质含量增加,与多酚的竞争吸附也会增加,导致树脂吸附量有所下降[38].因此,本试验的葡萄籽多酚溶液质量浓度控制在7.0 mg/mL左右为宜.

图5 AB-8大孔吸附树脂对葡萄籽多酚的静态吸附曲线

图6 提取液中多酚质量浓度对AB-8大孔树脂吸附性的影响
2.4 葡萄籽多酚对脂肪酶抑制率的测定
2.4.1 不同体积分数乙醇洗脱出的葡萄籽多酚脂肪酶抑制率 由图7所示,随着乙醇体积分数的增加,乙醇洗脱出的葡萄籽多酚对脂肪酶的抑制率逐渐增加,当乙醇体积分数超过40%时,乙醇洗脱出的葡萄籽多酚对脂肪酶的抑制率有所下降.40%乙醇洗脱出来的葡萄籽提取物配制的溶液对脂肪酶有较高的抑制率,与其他体积分数乙醇洗脱的葡萄籽多酚脂肪酶抑制率有显著差异(P<0.05),因此选择40%乙醇作为洗脱溶剂.

图7 不同体积分数乙醇洗脱液洗脱出的葡萄籽多酚的脂肪酶抑制率
2.4.2 不同质量浓度葡萄籽提取液对脂肪酶抑制率的影响 从图8可以看出,在一定的范围内,多酚质量浓度和多酚对脂肪酶的抑制率成正比,随着葡萄籽提取液浓度的增大,其对脂肪酶活力的抑制作用也随着增大,IC50=2.46 mg/mL.

图8 不同质量浓度葡萄籽提取液对抑制率的影响
3 讨论
本试验在多酚物质的提取研究基础上,通过Plackett-Burman试验筛选出显著影响多酚提取率的因素为提取温度和提取时间,然后通过爬坡试验确定响应面试验的中心试验点后进行响应面法优化提取条件.李西柳等[39]通过正交试验得出提取温度和提取时间对总多酚含量影响显著,乙醇体积分数和料液比对总多酚含量影响不显著,与本研究结果相吻合.响应面优化后的葡萄籽多酚提取率为18.24%,而传统提取方法通常为0.03%左右[40],贾荣等[41]在类似研究中提取葡萄籽多酚的提取率为11.71%,都低于本试验条件下的多酚提取率.本试验通过优化葡萄籽多酚提取条件,为后续试验提供一定参考价值,提高多酚的利用率,有很好的经济效益.
葡萄籽多酚抑制胰脂肪酶的活性可有效抑制脂肪的水解和吸收,可有助于减肥和预防高脂血症[42].本试验提取纯化的葡萄籽多酚对胰脂肪酶有抑制作用,其IC50值为2.46 mg/mL.高德艳[43]采用正交法选择有机溶剂萃取的最佳条件并用HPD100型大孔吸附树脂进行分离葡萄籽中的多酚类物质,其IC50值为2.40 mg/mL,略低于本试验所提取的葡萄籽多酚的脂肪酶抑制能力.
4 结论
本试验得到了葡萄籽多酚的最佳粗提条件为:乙醇体积分数70%,纤维素酶添加量0.5 mg/mL,料液比1∶10,浸提温度54 ℃,浸提时间39 min,浸提次数4次.AB-8大孔吸附树脂对葡萄籽多酚的纯化条件为:上样质量浓度7.0 mg/mL,上样速率1.0 mL/min,40%乙醇洗脱,洗脱速率1.0 mL/min.上述方法得到的葡萄籽多酚对胰脂肪酶抑制的IC50值为2.46 mg/mL.

