不同产地乌拉尔甘草及其内生细菌的抑菌活性比较
李鹏杰,曼琼,邓毅,2,杨志军,杨秀娟,马骏
(1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000)
植物内生菌是指伴随原植物生长或某段时期生活在健康植物组织和器官内的微生物,或寄生于健康植物且不影响植物生长,最终可能成为组织的一部分[1].随着环境的污染,野生资源遭到严重破坏,一些植物出现濒临灭绝的情况.因此,利用植物内生菌与宿主植物之间相同或相近的生源合成途径,合成与宿主相同或相似的活性成分,对传统中药进行开发和利用,已成为中药学研究的一种新方式.
甘草为二级野生保护植物,被称为“国老”,具有抗癌、抗炎、抗氧化、抑菌、解毒等药理作用[2-5].国内研究报道[6-7],甘草内生菌具有与宿主相似的药理学作用,其抑菌作用最为常见.刘霞等[8]通过对陕西野生甘草中内生菌的分离,筛选出对番茄灰霉病菌(Botrytiscirerea)、辣椒疫霉病菌(Phytophthoracapsici)、苹果干腐病菌(Botryosphaeriaberengeriana)、烟草赤星病菌(Alternariaalternata)等植物病原菌有抑菌效果的甘草内生菌共7株.刘建利等[9]通过对宁夏乌拉尔甘草内生菌的分离,并且进行对甜瓜采后病害病原菌的抑菌试验,筛选出8株抑菌作用较强的甘草内生细菌.但是,通过比较甘草内生菌在不同产地之间抑菌活性差异性的报道较少.因此本试验通过对甘肃和新疆野生乌拉尔甘草内生细菌分离纯化,比较甘肃与新疆乌拉尔甘草及其内生细菌对动物病原菌抑菌活性的差异性,以期为研究甘肃乌拉尔甘草的抑菌作用及其品质评价提供试验依据.
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料 甘肃及新疆产地野生乌拉尔甘草(GlycyrrhizauralensisFisch.)于2018年10月分别采集于甘肃省酒泉市和新疆阿克苏市依干其乡,经甘肃中医药大学中药鉴定教研室李硕副教授鉴定均为正品.将30 g左右新鲜野生甘草,清净泥土,保鲜膜包装,4 ℃保存.
1.1.2 试剂与仪器 3%次氯酸钠(河北瑞康医药科技有限公司,批号:20180101),氯化汞(上海中秦化学有限公司,批号20180413),无水乙醇(天津市富宇精细化工有限公司,批号:20180820),HZQ-F160A恒温振荡器(上海一恒科学仪器有限公司),ZY-063气浴恒温摇床(德国),B2HFsafe生物安全柜(上海力申科学有限公司),LDZX-30FB电热恒温培养箱(上海一恒科学仪器有限公司),酶标分析仪(RT-6100),细胞计数仪等.
1.1.3 培养基 普通营养琼脂(北京奥博星生物技术有限责任公司,批号:20180616),普通营养肉汤培养基(青岛高科园海博生物技术有限公司,批号:20180504).
1.1.4 供试菌 基于本课题组前提研究,选用金黄色葡萄球菌(百纳创联生物技术有限公司、ATCC25923)和肺炎链球菌(百纳创联生物技术有限公司、BNCC338425).
1.2 试验方法
1.2.1 甘草提取液的制备 精准称取不同产地甘草粉末0.5 g,分别置于50 mL锥形瓶中,加10倍量75%乙醇,混合,浸泡30 min,在50 ℃的条件下,超声提取2次,30 min/次,过滤,合并滤液,滤液用旋转蒸发仪真空浓缩至5 mL,放入4℃冰箱,备用[10].
1.2.2 甘草表面灭菌 取不同产地新鲜甘草的根,清洗干净,切成5~6 cm的小节,在无菌条件下,依次用3%次氯酸钠、0.1%氯化汞、75%乙醇各浸泡3 min,并用无菌蒸馏水各冲洗3~5次.收集最后1次的冲洗液备用[11-12].
1.2.3 灭菌检验 冲洗液检查:将收集到的冲洗液吸取100 μL涂布于普通营养琼脂平板上,在37 ℃条件下培养72 h,观察培养结果.
组织印迹检查:用无菌镊子将灭菌过的甘草组织块切面与普通营养琼脂平板表面轻轻接触几秒,置于37 ℃条件下培养72 h,观察培养结果.若无菌生长则表明甘草表面灭菌彻底.
1.2.4 甘草内生细菌的分离纯化 在无菌条件下,将表面灭菌的甘草组织块,用无菌解剖刀切成0.5 cm左右的小块,逐一放入普通营养琼脂平板中,且横切面朝下,置于37 ℃条件下,培养48 h,待菌落形成后,从菌落边缘挑取不同形态的菌株,采用四区划线法转接到新的平板中,相同条件进行培养,直至纯化.根据产地的不同,将分离纯化的甘草内生细菌进行编号,甘肃酒泉野生甘草内生细菌标记为JQYB001、JQYB002,…,新疆野生甘草内生细菌标记为XJYB001、XJYB002,….
1.2.5 甘草内生细菌发酵液的制备及浓度的测定 将不同产地分离纯化出的甘草内生细菌,挑取单个菌落,接种到普通营养肉汤培养液中,在37 ℃、220 r/min恒温振荡器中培养48 h,吸取10 μL发酵液注入细胞计数板中,通过细胞计数仪测量发酵液浓度,并收集剩余发酵液,置于4 ℃冰箱备用.
1.2.6 甘草内生细菌抑菌作用有效菌株的初步筛选 根据倾注平板法[13],向50 ℃、250 mL普通营养琼脂培养基中加入1 mL浓度为0.5麦氏比浊管浓度的供试菌,将其混合均匀,倒入9 cm培养皿中,水平静置凝固.将制备好的平板进行打孔,每个平板打3个,并向每孔中加入不同菌株发酵液100 μL,放入4 ℃冰箱扩散2 h,再转入到37 ℃培养箱进行培养24 h,筛选出有抑菌效果的菌株.用(+)表示有抑菌效果,用(-)表示无抑菌效果.
1.2.7 甘草及有效菌株抑菌直径的测定 根据上述试验方法,将甘草提取液(浓度为0.1 g/mL)和有效菌株发酵液(浓度为1×107CFU/mL),注入到已打好孔且具有病原菌的平板中,每孔注入100 μL,37 ℃培养24 h,进行抑菌直径的测量.每株菌株及提取液做3个复孔,并且进行统计学分析[14].
1.2.8 甘草及有效菌株最小抑菌浓度的测定 根据二倍稀释法[15],在96孔板中,第1~8孔中分别每孔依次加入普通营养肉汤、供试菌、不同稀释倍数的甘草提取液或发酵液共200 μL,其比例为4∶1∶5,第9~10孔各加200 μL的无菌生理盐水和普通营养肉汤培养基作空白对照组,再另一排的第1~8孔中依次加入普通营养肉汤、无菌生理盐水、不同稀释倍数的发酵液共200 μL,其比例为4∶1∶5,作为有效菌株的对照组,每组做3个复孔.在37 ℃培养箱中培养24 h后,进行D值的测定,并进行统计学分析.
1.2.9 甘草内生细菌的鉴定 根据《伯杰氏细菌鉴定手册》对有效菌株进行革兰氏染色形态观察和初步理化特性鉴定.用(+)表示革兰氏阳性菌,用(-)表示革兰氏阴性菌.
1.3 数据处理
2 结果与分析
2.1 甘草内生细菌的分离纯化
根据菌落形态、颜色等差异性,从甘肃酒泉和新疆产甘草各15份样品中分离得到甘草内生细菌分别为162株和83株.其中甘肃酒泉产甘草内生细菌比例最大,占总菌株的66.1%.
2.2 甘草内生细菌有效菌株的初步筛选及革兰氏染色
对肺炎链球菌有抑菌作用的有效菌株甘肃酒泉3株、新疆3株,对金黄色葡萄球菌有抑菌作用的有效菌株甘肃酒泉11株、新疆6株;对2种病原菌同时有抑菌作用的有效菌株甘肃酒泉1株、新疆1株.其中各产地甘草有效菌菌株形态特征、染色特性见图1,且经革兰氏染色理化鉴定,革兰氏染色阳性菌4株,阴性菌17株,结果见表1.

A、B:酒泉甘草内生细菌菌株形态特征;C:新疆甘草内生细菌菌株形态特征;D、E:酒泉甘草内生细菌菌株染色特征;E:新疆甘草内生细菌菌株染色特征.
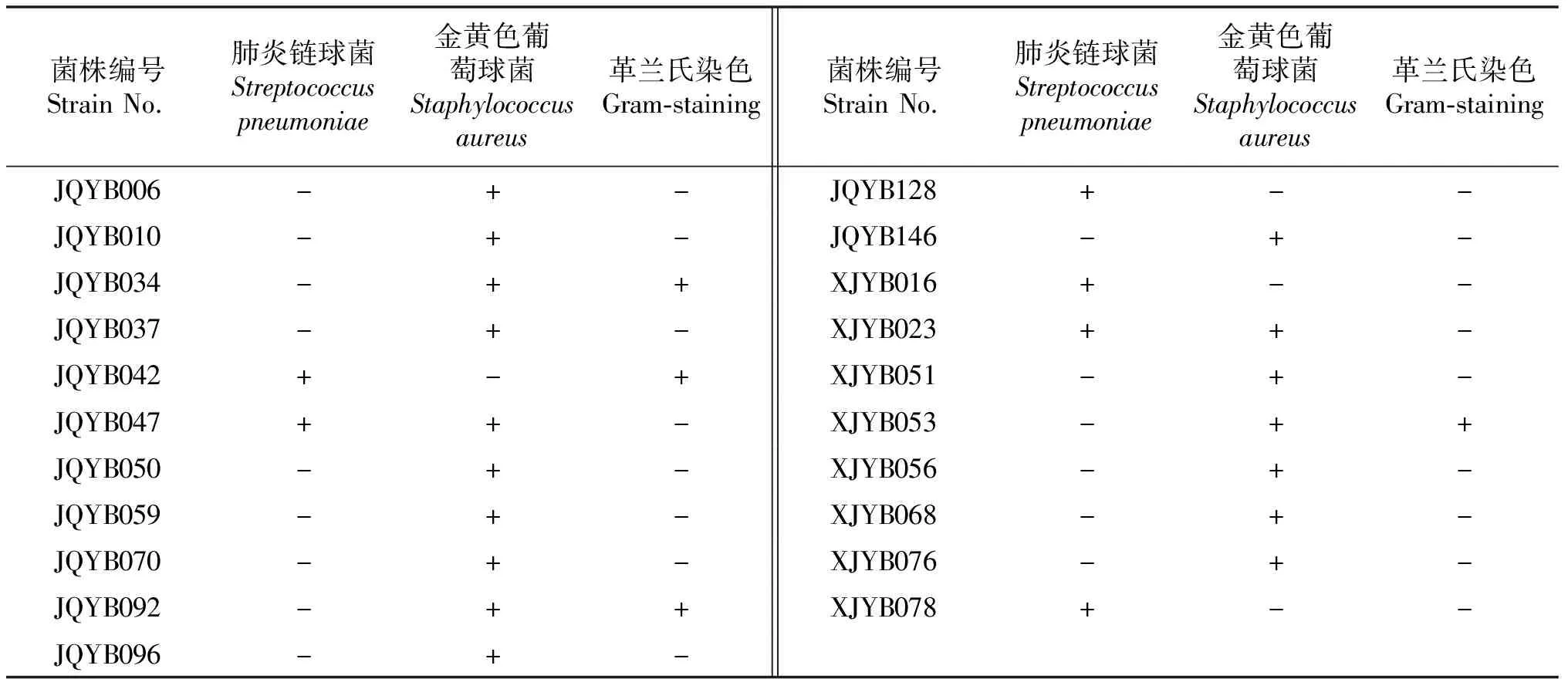
表1 甘草内生菌对2种供试菌抑菌活性初步筛选及革兰氏染色
“+”表示有抑菌效果及革兰氏阳性菌,“-”表示无抑菌效果及革兰氏阴性菌.
“+” indicates bacteriostatic effect and Gram-positive bacteria,“-” indicates no bacteriostatic effect and Gram-negative bacteria.
2.3 甘草提取液及有效菌株对肺炎链球菌的抑菌活性
与空白组比较,各个产地甘草提取液及内生细菌组对肺炎链球菌均有抑制作用(P<0.01).与酒泉甘草提取液组比较,酒泉各内生细菌组的抑菌直径均低于宿主提取液组,差异有统计学意义(P<0.01).与新疆甘草提取液组比较,XJYB023组的抑菌直径与宿主提取液组相近,差异无统计学意义(P>0.05),最小抑菌浓度(MIC)为7.02×104CFU/mL.酒泉、新疆甘草提取液组组间相比,酒泉宿主提取液组的抑菌直径大于新疆宿主提取液组,差异有统计学意义(P<0.05).酒泉有效内生细菌组与XJYB023组相比,酒泉内生细菌组的抑菌直径小于XJYB023组,差异有统计学意义(P<0.05).结果见表2.

表2 不同产地有效菌株对肺炎链球菌抑菌圈直径表及MIC
与空白组比较,◆P<0.01;与酒泉甘草提取液组比较,**P<0.01;与新疆甘草提取液组比较,◇P<0.05,◇◇P<0.01;与XJYB023组比较组比较,□P<0.05,□□P<0.01.
Compared with the blank group,◆P<0.01;compared with Jiuquan licorice extract group,**P<0.01;compared with Xinjiang licorice extract group,◇P<0.05,◇◇P<0.01;compared with XJYB023 group For comparison,□P<0.05,□□P<0.01.
2.4 甘草提取液及有效菌株对金黄色葡萄球菌的抑菌活性
与空白组相比,各产地甘草提取液及内生细菌组对金黄色葡萄球菌均有抑制作用(P<0.01).与酒泉甘草提取液组比较,JQYB006、JQYB037、JQYB050、JQYB070组的抑菌直径与酒泉宿主提取液组相近,差异无统计学意义(P>0.05),MIC分别为1.96×104、4.01×105、2.09×104、2.32×104CFU/mL.与新疆甘草提取液组比较,XJYB051、XJYB053组的抑菌直径大于新疆宿主提取液组,差异有统计学意义(P<0.05),其MIC分别为9.44×104、1.26×104CFU/mL.酒泉、新疆甘草提取液组组间相比,酒泉宿主提取液组的抑菌直径大于新疆宿主提取液组,差异有统计学意义(P<0.05).酒泉有效菌株组与XJYB051组相比,JQYB006、JQYB050、JQYB070组的抑菌直径与XJYB051相近,差异无统计学意义(P>0.05).酒泉有效菌株组与XJYB053组相比,JQYB050组的抑菌直径与XJYB053相近,差异无统计学意义(P>0.05).结果见表3.

表3 不同产地有效菌株对金黄色葡萄球菌抑菌圈直径表及MIC
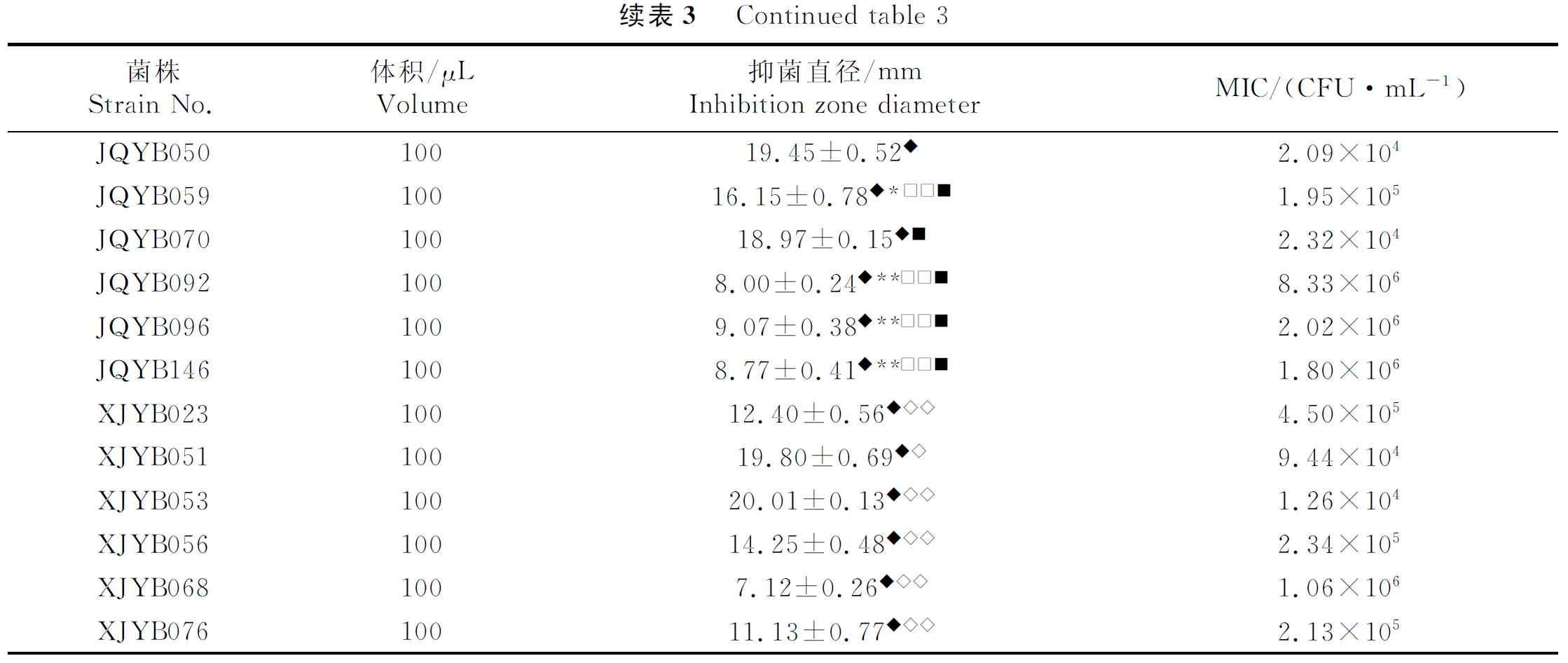
续表3 Continuedtable3菌株StrainNo.体积/μLVolume抑菌直径/mmInhibitionzonediameterMIC/(CFU·mL-1)JQYB05010019.45±0.52◆2.09×104JQYB05910016.15±0.78◆∗□□■1.95×105JQYB07010018.97±0.15◆■2.32×104JQYB0921008.00±0.24◆∗∗□□■8.33×106JQYB0961009.07±0.38◆∗∗□□■2.02×106JQYB1461008.77±0.41◆∗∗□□■1.80×106XJYB02310012.40±0.56◆◇◇4.50×105XJYB05110019.80±0.69◆◇9.44×104XJYB05310020.01±0.13◆◇◇1.26×104XJYB05610014.25±0.48◆◇◇2.34×105XJYB0681007.12±0.26◆◇◇1.06×106XJYB07610011.13±0.77◆◇◇2.13×105
与空白组相比,◆P<0.01;与酒泉甘草提取液组相比,*P<0.05,**P<0.01;与新疆甘草提取液组比较,◇P<0.05,◇◇P<0.01;与XJYB051组比较,□P<0.05,□□P<0.01;与XJY053组比较,■P<0.01.
Compared with the blank group,◆P<0.01;compared with Jiuquan licorice extract group,*P<0.05,**P<0.01;compared with Xinjiang licorice extract group,◇P<0.05,◇◇P<0.01;compared with the XJYB051 group,□P<0.05,□□P<0.01;compared with the XJY053 group,■P<0.01.
3 讨论
中药微生态是与品质效用之间关系的学科,主要是通过研究中药内部功能菌群的筛选及其功能基因的注释,功能菌群在中药有效活性成分、毒性成分合成代谢,生长等,其中包括植物内生细菌和内生真菌[16].甘草植物组织中内生细菌资源丰富,不同产地植物组织内生细菌在数量上存在一定的差异,在抗菌等药理学方面也存在一些差异.
目前,甘草内生细菌在抗病原菌方面有着重要的研究意义,但大部分集中于植物病原菌方面.刘建利等[9]从宁夏甘草的根、茎、叶中分离纯化出甘草内生细菌151株,通过以甜瓜病害病原菌为指示菌,筛选出至少对2种病原菌有抑菌作用的菌株19株,其中8株内生细菌对4种病原菌有较好抑菌效果.祖丽皮亚木·木沙尔等[17]从新疆甘草中分离出100株甘草内生细菌,对植物病原真菌抑制效果明显的菌株有13株.杨树等[18]研究表明拮抗菌株,能合成并分泌具有拮抗的化学物质,能抑制病原菌的生长,从而控制病原菌的传播.因此,本试验从甘肃、新疆产地甘草中分别分离出162株和83株菌株,筛选出对肺炎链球菌、金黄色葡萄球菌等病原菌有抑菌效果的菌株分别为13株和8株.并且对甘肃、新疆甘草及内生细菌进行抗菌药理作用比较,发现甘肃地区甘草对2种病原菌的抑菌效果优于新疆地区甘草,也发现JQYB006、JQYB050、JQYB070这3株菌株对金黄色葡萄球菌的抑菌活性,不但和酒泉宿主相似,也和XJYB051、XJYB053这2株菌株抑菌活性相似,说明该5株菌株产生的次生代谢产物相似,这对甘草内生细菌的研究具有潜在开发价值.
4 结论
本研究经对甘肃、新疆产地乌拉尔甘草内生细菌的分离纯化、菌落形态学观察以及抑菌试验等结果进行分析,结果表明甘肃乌拉尔甘草中内生细菌资源优于新疆地区,且甘肃乌拉尔甘草对病原菌的抑菌效果优于新疆甘草,JQYB006、JQYB050、JQYB070菌株与XJYB051、XJYB053菌株对金黄色葡萄球菌的抑菌效果相似.这不仅为乌拉尔甘草道地性研究及获得新的抗菌药物提供试验依据,也为后续试验次生代谢产物方面的研究奠定基础.

