基于肠道菌群调节的小檗碱和黄芪甲苷联用降糖机制研究
孟 琦 ,宝 丽,张 烨,张 蕾,王真真,鄢 丹*,孟祥乐
(1. 河南大学 药学院,河南 开封 475000;2. 首都医科大学附属北京世纪坛医院 临床合理用药生物特征谱学评价北京市重点实验室暨国际合作联合实验室,北京 100038;3. 河南中医药大学第一附属医院,河南 郑州450000)
中国已成为世界上糖尿病患病人数最多的国家,研制安全有效、毒副作用小、价格低廉的防治糖尿病的药物已成为热点和难点[1]。近年,中医药或其有效成分在治疗2型糖尿病方面临床疗效确切,且具有较低的副作用,如泻心汤[2],黄连解毒汤[3],黄芪散[4]等。其中黄连经常与黄芪配伍使用,尤其是黄芪用于治疗糖尿病(中医称为消渴症),早在《名医别录》就明确提出了黄芪有“止渴”作用,其后《日华子本草》指出黄芪治疗消渴。现在临床亦多用黄芪配伍其他中药辨证治疗消渴。现有静脉注射剂(主要活性成分是黄芪甲苷),用于治疗2型糖尿病临床疗效良好[5]。另外,黄连(主要活性成分为小檗碱)因其有降血糖、降血脂、抗炎和抗氧化作用,经常用于治疗2型糖尿病[6]。根据中国食品药品监督管理局数据,黄连多作为抗糖尿病中成药的主要成分,且大多数与黄芪配伍,如金芪降糖片、糖脉康胶囊、消渴平片等[7]。尽管黄连和黄芪配伍被频繁用于抗糖尿病配方中,但目前它们之间的相互作用关系还不清晰。
当前,将肠道菌群作为靶点,从中药中寻找治疗2型糖尿病的活性成分或组方已成为开发新药的新途径[8]。黄芪的主要活性成分黄芪甲苷,有抗糖尿病、抗炎、抗氧化、提高机体免疫力等多种药理活性[9]。黄连的主要活性成分小檗碱有降血糖作用[10],由于其吸收率和生物利用度较低,所以本实验认为其降血糖作用可能不是在吸收之后产生的,而是在肠道中发挥作用[11]。因此,本文通过单独和联合灌胃给予小檗碱、黄芪甲苷治疗2型糖尿病大鼠2周[12],然后收集其粪便进行16S rRNA测序,并对肠道菌群结构进行分析,以研究小檗碱和黄芪甲苷联合使用对2型糖尿病大鼠的降糖机制,从而解释了不同中药成分之间的相互作用及配伍机制。
1 材料
1.1 实验动物
Sprague Dawley(SD)雄性大鼠25只,SPF级,6周龄(实验动物合格证号:1100111911013013),购自北京维通利华实验动物技术有限公司[许可证号SCXK(京)2016-0006],饲养于北京世纪坛医院动物房[许可证号SYXK(京)2017-0025]。饲养条件:SPF级洁净度,室温 20~22 ℃,湿度60 %±5 %,12 h明暗交替,自由饮食饮水。本实验中所有动物程序都被首都医科大学附属北京世纪坛医院伦理委员会认可(许可号:2019-keyanlunshen-21),并在实验动物保护协会规定的指导下进行动物实验。
1.2 药品、试剂与仪器
盐酸小檗碱(纯度≥97 %,大连美仑生物技术公司);黄芪甲苷(纯度>95 %,上海源叶生物科技有限公司);羧甲基纤维素钠,链脲佐菌素(生化试剂,Sigma公司);维持饲料(北京科奥协力饲料有限公司);高脂饲料(含10 %蛋黄粉,10 %蔗糖,10 %猪油和10 %胆固醇,北京华阜康股份有限公司)。血糖仪及试纸(德国罗氏诊断有限公司);T100型PCR仪(Bio-rad公司);高通量测序分析仪(IonS5TMXL Ion 530 Chip,Thermofisher公司)。
2 方法
2.1 动物造模、分组与给药
用维持饲料饲养SD大鼠,适应1周后,所有25只大鼠均以高脂饮食饲养4周。然后腹腔内注射45 mg/kg链脲佐菌素溶液(溶于pH 4.5 0.1 mmol/L柠檬酸钠缓冲液),72 h后,空腹血糖(FBG)≥11.1 mmol/L被确定为糖尿病模型造模成功[13-14]。将造模成功的大鼠随机分为4组:模型(BL)组、黄芪甲苷(AIV)组、小檗碱(BBR)组和黄芪甲苷与小檗碱联合用药组(AB)。将所有药物溶解于0.5 %羧甲基纤维素钠溶液中。连续灌胃给药2周。在全部试验过程中,每周记录一次体重、空腹血糖。未建模的大鼠用10 %水合氯醛麻醉处死。
2.2 动物粪便收集、DNA提取、PCR扩增及测序
给药结束后,收集大鼠粪便,取粪便方法为一人托持大鼠,另一人待其排便时用无菌棉签辅助将新鲜粪便接入无菌冻存管中,立刻放入液氮,过程中尽量避免杂菌污染,收集完成后转-80 ℃冰箱保存。用CTAB/SDS法从粪便样品中提取总基因组DNA。肠道内容物DNA提取按DNA提取试剂盒说明进行,使用1 %琼脂糖凝胶电泳检测提取DNA的质量。对提取的DNA进行PCR扩增,本实验选用的扩增引物为515F-806R,其中515F序列为5’-GTGCCAGCMGCCGCGGTAA-3’,806R序列为5’-GGACTACHVGGGTWTCTAAT-3’。扩增程序为95 ℃预变性5 min,34个循环(94 ℃变性1 min,57 ℃退火45 s,72 ℃延伸1 min),最后72 ℃延伸10 min,16 ℃保温5 min。扩增后的产物使用2 %琼脂糖凝胶电泳检测。选取目的条带,使用凝胶回收试剂盒回收。回收后的扩增产物使用Tris-HCl洗脱收集,定量后按比例混合不同样品的扩增产物。采用2 %琼脂糖凝胶电泳检测PCR产物。根据PCR产物的浓度将样品等量混合,使用TAE浓度为1 % 的2 %琼脂糖凝胶电泳纯化PCR产物,剪切回收目标条带。使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒(Thermofisher公司)进行文库的构建,经Qubit定量和文库检测合格后,使用 IonS5TMXL 测序平台(Thermofisher)上机测序,以97 %的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),然后对OTUs序列与Silva132数据库进行物种注释。
2.3 生物信息分析
为计算alpha、beta多样性,使用R软件(2.15.3版)计算Shannon指数,并进行主坐标分析(PCoA);为挖掘反映样品之间差异的更深层微生物多样性数据,使用LEfSe方法进行丰度显著差异分类单元筛选,判别标准为:Kruskal-Wallis检验筛选值α<0.05,配对Wilcoxon检验筛选值α<0.05,显著判别值LDA>3.5;代谢通路预测使用PICRUSt。
2.4 统计分析
采用 GraphPad Prism 7.0进行组间数据统计分析,多组间的显著性差异统计采用单因素方差分析(ANOVA)。数据结果显示均采用±s表示。P<0.05的差异被认为是具有统计学意义,本文的显著性水平表示为*P<0.05,**P<0.01 和***P<0.001。处理后的数据再使用 GraphPad Prism 7.0作图。组间LEfse比率通过非参数Kruskal-Wallis rank sum检验分析。
3 结果
3.1 对大鼠血糖和体重的影响
2周灌胃给药结束时,空腹血糖方面,与模型组相比,黄芪甲苷组、小檗碱组和联合用药组的平均血糖均降低,其中联合用药组的平均血糖(18.79 ± 3.27 mmol/L,每组5只2型尿病大鼠)显著低于模型组(20.86 ± 4.35 mmol/L,每组5只2型糖尿病大鼠)(*P<0.05)(图1A)。在体重方面,与模型组相比,黄芪甲苷组、小檗碱组和联合用药组的平均体重均增加,其中小檗碱组(329.90 ±50.06 g)、联合用药组(331.94 ± 49.87 g)分别比模型组(318.07 ± 39.29 g)增加3.71 %(*P<0.05)和4.05 %(*P<0.05)(图1B)。上述结果表明,联合用药有效改善了2型糖尿病大鼠的空腹血糖和体重。

图1 黄芪甲苷(AIV)、小檗碱(BBR)及联合用药(AB)组的2型糖尿病大鼠空腹血糖和体重变化图
3.2 黄芪甲苷与小檗碱联合用药对2型糖尿病大鼠微生物群落结构的影响
为比较不同样本的多样性,首先对OTU丰度矩阵中的全部样本根据最低测序深度统一进行随机重抽样,即“序列量拉平处理”,从而校正测序深度引起的多样性差异。Alpha多样性(alpha diversity)反映的是单个样品内部的物种多样性,可通过群落多样性指数衡量,Shannon是表示群落多样性指数的一种形式,此指数值越大,表明样品的物种多样性越高。由图2A Shannon指数可见,黄芪甲苷组、小檗碱组、联合用药组和模型组相比较群落多样性均减少,且小檗碱组(*P<0.05)、联合用药组(**P<0.01)与模型组的差异有统计学意义。
本研究试图从肠道菌群结构出发,探讨小檗碱与黄芪甲苷合用对菌群结构的影响,进而推测黄连与黄芪配伍使用的作用机制。由图2B,图3,图4可见,给药2周后,黄芪甲苷、小檗碱及联合用药均能引起肠道菌群结构的变化。
在门水平上,丰度较高的菌群依次为Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Actinobacteria(放线菌门)、Tenericutes(柔壁菌门)、Verrucomicrobia(疣微菌门)、Proteobacteria(变形菌门)、Melainabacteria(麦角藻菌门)、Deferribacteres(脱铁杆菌门)、Elusimicrobia(迷踪菌门)和Cyanobacteria(蓝细菌)。其中厚壁菌门与拟杆菌门具有绝对优势。小檗碱组和联合用药组的Bacteroidetes丰度比模型组分别高13.32 %、26.90 %;而黄芪甲苷组的Bacteroidetes丰度比模型组低5.04 %;Firmicutes丰度比模型组分别低19.80 %,7.41 %,4.54 %(图3)。
在属水平上,丰度较高的菌群依次为Bifidobacterium、Lactobacillus、Turicibacter、unidentified Ruminococcaceae、Bacteroides、unidentified Lachnospiraceae、Anaeroplasma、Faecallibaculum、Akkermansia和Marvinbryantia(图4)。

图2 黄芪甲苷(AIV)、小檗碱(BBR)及联合用药(AB)组2型糖尿病大鼠粪便肠道菌群的Shannon(A)及PCoA分析图(B)

图3 黄芪甲苷(AIV)、小檗碱(BBR)及联合用药(AB)组2型糖尿病大鼠肠道菌群在门水平的物种分布

图4 黄芪甲苷(AIV)、小檗碱(BBR)及联合用药(AB)组2型糖尿病大鼠肠道菌群在属水平的物种分布
3.3 差异菌属筛选及药物调节作用
通过Galaxy在线分析平台(http://huttenhower.sph.harvard.edu/galaxy/),提交相对丰度矩阵进行LEfSe分析[15],显示细菌丰度的差异。LDA评分的阈值为3.5,结果见图5。与模型组相比,黄芪甲苷组、小檗碱组、联合用药组的大鼠肠道菌群中门、纲、目、科和属分类水平均发现差异菌群。Romboutsia属和Lactobacillus reuteri种在黄芪甲苷组呈上调趋势,unidentified Ruminococcaceae属、Ruminococcus spYE281种和Bacteroides intestinalis种在小檗碱组呈上调趋势,Akkermansia属和Parabacteroides属在联合用药组呈现上调趋势,但Proteobacteria菌的丰度在模型组中增多。
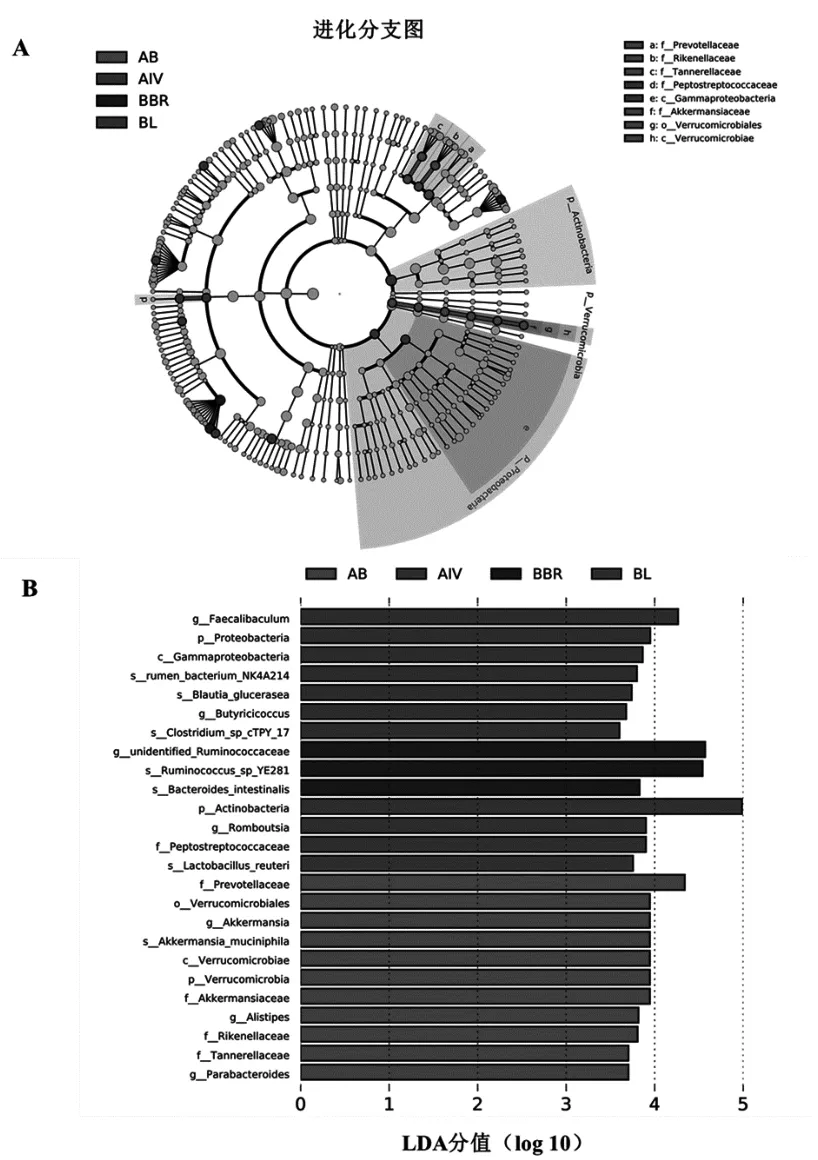
图5 黄芪甲苷(AIV)、小檗碱(BBR)及联合用药(AB)组造成的差异菌属进化分支图(A)和线性判别分析(LDA)得分(B)图
3.4 代谢功能预测
为了进一步分析肠道菌群的功能信息,使用PICRUSt软件进行功能预测,富集到的通路见图6。根据聚类结果可见,其中Metabolism of Cofactors and Vitamins(辅酶和维生素的代谢)、Nucleotide Metabolism(核苷酸代谢)、Metabolism of Other Amino Acids(其他氨基酸代谢)等功能在黄芪甲苷给药组中呈上调趋势;Metabolic Diseases(代谢性疾病)、Amino Acid Metabolism(氨基酸代谢)、Metabolism of Terpenoids and Polyketides(萜类化合物和多聚酮类的代谢)等功能在小檗碱给药组中呈上调趋势和Glycan Biosynthesis and Metabolism(聚糖生物合成代谢)、Metabolism(代谢)等功能在联合用药组中呈上调趋势。

图6 黄芪甲苷(AIV)、小檗碱(BBR)及联合用药(AB)组2型糖尿病大鼠肠道菌群功能通路预测图
4 讨论
本文发现黄连的主要活性成分小檗碱和黄芪的主要成分黄芪甲苷联合使用比各自单独使用能更好地降低2型糖尿病大鼠的空腹血糖,但由于其生物利用度很低,肠道菌群可能是其治疗2型糖尿病的作用靶点之一。本研究从肠道菌群结构分析入手,筛选丰度显著差异分类单元并预测其代谢通路,探究服用小檗碱、黄芪甲苷对2型糖尿病大鼠肠道菌群调节的生物学意义,从而推测黄连与黄芪配伍使用的作用机制。
在服用小檗碱、黄芪甲苷后,2型糖尿病大鼠门水平肠道菌群结构发生改变,Bacteroidetes平均丰度上升、Firmicutes平均丰度下降,其中联合用药组的变化尤为明显。目前大部分研究认为Bacteroidetes下降与Firmicutes上升是肥胖发生的标志之一[16-17],由此作者推测含小檗碱与黄芪甲苷联合用药可能具有减缓肥胖及糖尿病等代谢疾病发展过程的作用。
本研究结果所揭示的灌胃黄芪甲苷、小檗碱后2型糖尿病大鼠肠道菌群门、纲、目、科、属、种水平丰度显著差异分类单元中,Proteobacteria菌增加将导致肠道内毒素产量增加,从而扰乱肠道免疫功能,或损伤肠黏膜[18]或引起代谢性内毒素血症,代谢性内毒素血症已被认为是引发肥胖症和肥胖相关功能障碍的主要原因[19]。unidentified_Ruminococcaceae属,主要产丁酸盐菌,丁酸盐是一种短链脂肪酸,在维持肠道屏障功能和抵御病原菌感染上起重要作用,并参与机体的免疫调节[20]。Akkermansia属疣微菌科(Verrucomicrobiaceae),是人体肠道中一种可降解黏蛋白的细菌,帮助维持消化道健康,降低肥胖、糖尿病、炎症等疾病的风险,研究表明,其通过改变脂肪组织的代谢,改善肠道屏障的完整性[21-22]。Parabacteroides属主要代谢终产物为有益的乙酸、琥珀酸,帮助调节肠道菌群[23]。unidentified_Ruminococcaceae属、Akkermansia属、Parabacteroides属均是有益菌,在给药组中丰度增多,而Proteobacteria菌是致病菌,在模型组中的丰度高。
由此可见,黄连、黄芪的主要活性成分小檗碱、黄芪甲苷可使2型糖尿病大鼠致病菌和条件致病菌丰度下降、益生菌和潜在益生菌丰度上升;尤其是联合用药能显著调节肠道菌群结构,表明黄芪甲苷可通过改善肠道菌群促进小檗碱降血糖的发挥。同时受联合用药调节的肠道菌群多与糖尿病病、肥胖等代谢相关疾病有关,通路预测结果中氨基酸代谢、聚糖生物合成代谢等功能均发生了变化,这可为进一步研究黄连、黄芪联合用药改善胰岛素抵抗、抗糖尿病[24]的作用机制提供新的思路。

