纳米复合佐剂的抗肿瘤免疫调控作用及效果研究
赵佳琦,Khattak Sameena Noor,董晓筱,胡张可,韩卢,邓雄威,安东妮娜,胡秦,盛望
1.北京工业大学 生命科学与生物工程学院,北京 100124;2.国家纳米科学中心,北京 100190;3.首都师范大学 附属中学,北京 100037
富含未甲基化胞嘧啶-鸟嘌呤二核苷酸的DNA(CpG DNA)是一种可以刺激多种免疫细胞活化或增殖,具有强烈免疫激活功能的核酸。研究发现,人工合成的含有CpG基序的寡核苷酸序列(CpG ODN)具有相同的刺激效果[1]。Toll样受体9(Toll like receptor 9,TLR9)是CpG ODN发挥免疫激活作用的受体[2-3],主要表达在B淋巴细胞、树突状细胞(dendritic cell,DC)和自然杀伤细胞等免疫细胞的内吞小体膜上[4]。TLR9刺激将增强DC捕获死亡肿瘤细胞释放的抗原的能力,这些DC可以迁移到局部淋巴结,在那里遇到并激活肿瘤特异性细胞毒性T细胞,因此这一机制依赖于CpG ODN增强DC的活化和成熟,从而促进肿瘤抗原的摄取,进而改善随后的免疫应答。研究表明纳米化的CpG能够在更低剂量激活免疫系统[5]。
近年来关于CpG的临床试验不断开展,CpG既可以作为单独药物,也可与放疗、化疗[6]、免疫检查点抑制剂[7]等联合治疗肿瘤。Hofmann等的Ⅰ期临床试验涉及CpG ODN肿瘤内注射治疗恶性皮肤肿瘤有较好的结果[8];布罗迪等研究表明,肿瘤内注射CpG(单独或联合放射治疗)可通过提高肿瘤特异性CD8+T细胞的生成来诱导全身肿瘤消退[9],淋巴瘤和黑色素瘤患者肿瘤内注射CpG联合放疗通过提高肿瘤特异性CD8+T细胞发生而诱发全身肿瘤消退[10]。
β葡聚糖作为抗感染疫苗的佐剂[11]和抗癌免疫治疗的免疫调节剂[12]得到了广泛的研究。在Ⅰ期临床试验中,患者接种结合了β葡聚糖的神经母细胞瘤疫苗,15名患者中有6名患者微小残留病变消失[13],在与生存素疫苗和DC疫苗联合应用中也获得了抗肿瘤效果[14-15],但是单独的β葡聚糖只能产生弱的非特异性肿瘤抑制。
本研究采用自组装纳米递送系统,构建β葡聚糖-CpG复合佐剂纳米颗粒,在体外骨髓来源树突状细胞(dendritic cells derived from bone marrow,BMDC)及体内黑色素瘤模型中进行抗癌研究,拟为肿瘤的免疫治疗探索一种新的纳米佐剂治疗思路。
1 材料与方法
1.1 材料
SPF级C57BL/6N雌性小鼠50只(体重12~14 g,6~8周龄)购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],饲养于中国科学院过程工程研究所动物房[SYXK(京)2019-0004],严格按照中国科学院过程工程研究所伦理要求进行动物实验(IPEAECA2019016)。
B16F10细胞存储于北京工业大学生命科学与生物工程学院;CpG 1826由生工生物工程(上海)有限公司合成;羧甲基β葡聚糖(carboxymethyl β-glucan,CMG)、鱼精蛋白硫酸盐(protamine sulfate,PS)购自Sigma公司;粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素4(IL-4)购自Peprotech公司;小鼠γ干扰素(IFN-γ)ELISA试剂盒、CD11c抗体(FITC标记)、CD86抗体(PerCPCy5.5标记)、CD3抗体(FITC标记)、CD4抗体(APC标记)、CD8抗体(PE标记)购自BioLegend公司;RPMI-1640、胎牛血清(FBS)、PBS(pH7.4)购自Gibco公司;青霉素-链霉素、DNA酶购自索莱宝公司;胶原酶Ⅴ购自Sigma Aldrich公司;70 μm细胞筛网、EDTA抗凝管购自BD Biosciences公司;淋巴细胞分离液购自北京达科为生物技术有限公司;透射电镜Tecnai G2 F30 S-TEIN(EFI公司);动态光散射激光粒度仪(马尔文仪器有限公司);FACS流式细胞仪(BD公司)。
1.2 CpG纳米颗粒制备
用去离子水制备1 mg/mL的羧甲基β葡聚糖溶液和1 mg/mL的鱼精蛋白硫酸盐溶液,将后者逐滴加到前者中,持续搅拌30 min后离心,去除上清液,分散,用超纯水复溶,即得到葡聚糖纳米颗粒(NP)。将CpG-ODN溶于上述羧甲基β葡聚糖溶液中,再按上述方法制备,即得到CpG纳米颗粒(CNP)。
1.3 体外骨髓来源树突状细胞成熟实验
取C57BL/6N小鼠胫骨和股骨,将完整的骨骼在70%乙醇中消毒2~5 min,PBS清洗;用RPMI-1640和直径0.45 mm的注射器冲洗骨髓,收集骨髓细胞,静置30 min后收集非贴壁细胞,以5×106/mL的浓度铺6孔板,RPMI-1640培养基中加入20 ng/mL GM-CSF和1 ng/mL IL-4培养7 d;在培养的第3、5 d更换培养基,补充血清及细胞因子;第7 d收集悬浮细胞,在含20 ng/mL GMCSF、1 ng/mL IL-4的培养基中以1×106/mL的浓度铺24孔板,分为5组进行处理,分别为PBS组、β葡聚糖(200 μg/mL)组、NP(β葡聚糖 200 μg/mL)组、CpG(4 μg/mL)组、CNP(CpG 4 μg/mL)组,每组3个复孔,每孔加入10 μL药物溶液,培养24 h后收集细胞待用。
1.4 动物模型构建及分组
取C57BL/6N雌性小鼠,实验前饲养观察1周。标准细胞培养条件下培养B16F10细胞至对数期,胰酶消化后,PBS重悬调整细胞浓度为2×106/mL。小鼠右后肢皮下接种2×105/100 μL B16F10细胞,接种当天记为第0 d,接种后第6 d筛选肿瘤大小相对一致的24只小鼠,随机分为4组进行给药,分别为PBS(对照)组、NP(β葡聚糖2.5 mg)组、CpG(50 μg)组、CNP(CpG 50 μg,β葡聚糖2.5 mg)组,给药体积均为100 μL,给药方式为后颈部皮下注射,共给药4次,给药间隔3 d,剩余小鼠安乐死。
1.5 取材
实验期间监测小鼠肿瘤生长情况。测量肿瘤最大直径(l)和最小直径(d),用公式(l×d2)/2计算肿瘤体积。实验结束后麻醉小鼠,眼眶取血,小鼠安乐死后分离肿瘤组织及主要内脏器官。
1.6 ELISA检测IFN-γ
最后一次给药后第3 d,麻醉小鼠后眼眶取血置于EDTA抗凝管中,4000 r/min离心10 min,取上清,ELISA测定血浆中的IFN-γ含量。
1.7 肿瘤处理
分离肿瘤后立即放入PBS溶液中,将肿瘤切成小块,转移到含RPMI-1640、胶原酶Ⅴ(41.75 μg/mL)和DNA酶(2 μg/mL)的培养皿中,37℃下摇晃30 min,所有与肿瘤接触的培养基以及肿瘤组织都被转移到细胞筛网,研磨组织,PBS冲洗收集细胞悬液,重新悬浮在淋巴细胞分离液中,分离的淋巴细胞在染色前用PBS润洗2次。
1.8 脾脏处理
取出脾脏放入预先加入4 mL淋巴细胞分离液的平皿中,细胞筛网置于平皿上进行组织研磨,收集细胞悬液,缓慢加入1 mL RIPM-1640,水平离心30 min,取淋巴细胞层溶液,PBS润洗2次,染色。
1.9 流式细胞术
用CD11c、CD86荧光抗体对DC染色,用CD3、CD8、CD4荧光抗体进行淋巴细胞染色,并用BD-FACS流式细胞仪进行分析。
1.10 统计学分析
用FlowJo软件分析流式细胞结果;用SPSS 17.0软件进行统计学分析,用GraphPad Prism 8.0软件绘制图表。组间比较采用方差分析和t检验,所有分析中差异的显著性表示为*P<0.05、**P<0.01、***P<0.001。
2 结果
2.1 纳米颗粒物理表征
如图1所示,制备的纳米颗粒形态完整,接近球形。如图2所示,NP颗粒粒径约为186.8 nm,包载CpG之后的纳米颗粒粒径约为201.3 nm。
2.2 体外DC成熟实验结果
DC是功能最强的抗原提呈细胞,成熟DC能够有效激活T细胞,诱导特异性的肿瘤毒性T淋巴细胞生成,成熟DC表面高表达黏附因子CD11c和共刺激因子CD86。体外培养BMDC后的实验结果表明,除CNP外的其他实验组对DC成熟的刺激效果无明显差异,CNP能显著提高DC成熟比例,约为其他实验组的2.8倍(图3),实验结果还表明纳米状态的β葡聚糖并没有表现出比游离葡聚糖更好的DC激活效果。
2.3 肿瘤模型小鼠肿瘤体积随时间变化曲线
建立黑色素肿瘤模型后,4次给药期间隔天测量肿瘤大小。生长曲线显示CpG组、CNP组、NP组与对照组相比肿瘤体积均有减小,其中CpG组和CNP组肿瘤显著减小,表明NP、CpG和CNP均表现出抗肿瘤活性,但CpG和CNP的抗肿瘤活性显著高于NP。与CpG相比,CNP组肿瘤体积进一步减小,但本次实验没有表现出统计学显著性差异(图4)。

图1 纳米颗粒透射电镜图
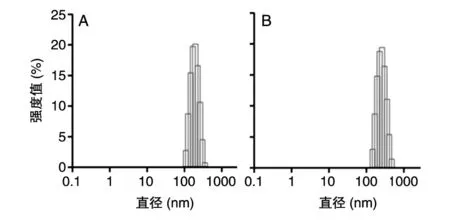
图2 纳米颗粒粒径分布

图3 体外BMDC成熟
2.4 小鼠血浆IFN-γ含量
小鼠麻醉后眼眶取血至EDTA抗凝管中,离心取血浆,ELISA测定血浆中IFN-γ的含量,结果见图5。NP组与对照组的IFN-γ含量没有差异,CpG组小鼠血浆IFN-γ含量约为对照组的2.3倍,CNP组为对照组的4倍,与其他实验组相比,IFN-γ的含量均显著升高。
2.5 小鼠瘤内浸润性T淋巴细胞百分比
处死小鼠后分离肿瘤,研磨后用淋巴细胞分离液分离瘤内淋巴细胞,进行表面染色后,用流式细胞仪分析肿瘤组织内浸润性T淋巴细胞含量,结果见图6。CpG与CNP组瘤内的CTL细胞含量与对照组相比均明显上升,其中复合佐剂组与单独佐剂组相比CTL升高具有显著性差异。CpG组瘤内CD4+T淋巴细胞约为对照组的1.2倍,CNP组约为对照组的3.5倍,表明CNP能显著提高肿瘤内浸润性淋巴细胞比例,具有更好的抗癌效果。
2.6 小鼠脾脏内T淋巴细胞百分比
图7结果表明,CNP组脾脏中CD4+、CD8+T淋巴细胞比例均有所上升,表明CNP给药组小鼠的机体免疫状态有所改善,但实验组间并没有显示出显著性的T细胞比例差异,后续须通过改变给药剂量、增加组内样本数等方法进一步探究。

图4 各组肿瘤体积
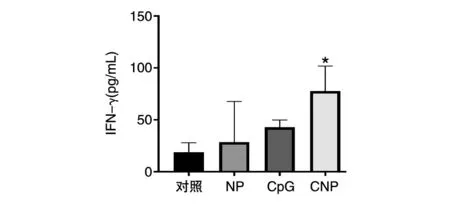
图5 小鼠血浆中的IFN-γ含量
3 讨论
随着科学的发展和技术的进步,肿瘤诊断和治疗技术都取得了很大的飞跃,肿瘤免疫疗法,即利用激活病人的免疫系统去识别并杀死肿瘤细胞的治疗手段,被视为未来肿瘤治疗的重要突破口。
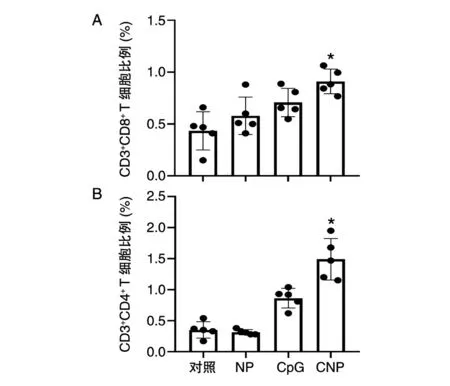
图6 肿瘤内浸润性T淋巴细胞比例
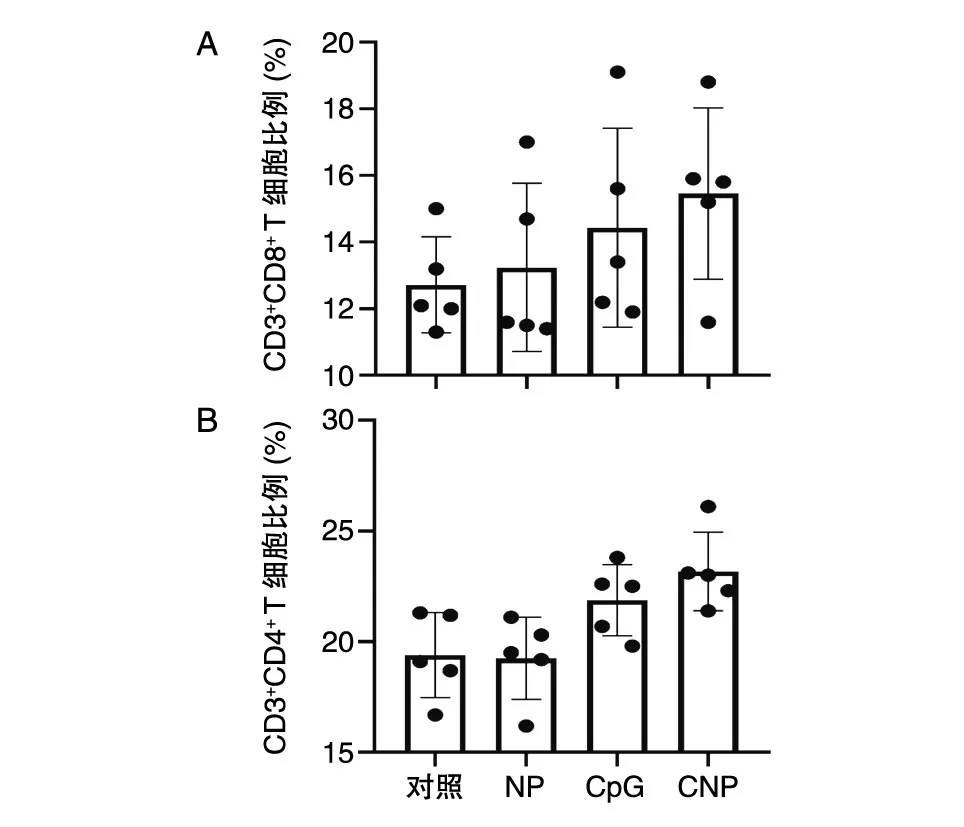
图7 小鼠脾脏内淋巴细胞比例
作为单独的治疗药物,CpG临床试验全身给药的效果较差,所以目前多为瘤内注射[16-17],一定程度上限制了其在实体瘤上的应用。CpG ODN与利妥昔单抗联合治疗复发/难治性非霍奇金淋巴瘤(NHL)患者的临床疗效较好[18],临床前研究表明CpG ODN与anti-CTLA4或anti-PD-1结合治疗可促进肿瘤的根除[19]。因此,CpG-ODN与anti-CTLA4或ant-PD-1正被考虑用于联合治疗肾、乳腺、胃肠道、卵巢、肺、皮肤等癌症。此外,CpG纳米化后作为佐剂联合放疗或单抗在临床前研究中也取得了较好结果[20]。
本研究构建了葡聚糖-CpG纳米复合佐剂。在体外BMDC刺激成熟实验中,CNP与CpG相比表现出更优秀的激活效果,DC激活后,通过抗原提呈和分泌多种细胞因子,进一步促进体液免疫和细胞特异性免疫的发生。在小鼠体内黑色素瘤模型中采用后颈部皮下给药方式,与单独CpG给药组相比,CNP表现出更好的抗肿瘤效果,尽管统计学上并没有显著性差异,但CNP显示出比CpG具有更强抗肿瘤活性的潜在趋势。后续可以通过增加每组实验鼠数量和尝试不同剂量做进一步探究。IFN-γ作为重要的抗肿瘤细胞因子,在CNP组小鼠血浆中的含量与其他组相比显著升高,瘤内CD3+CD8+和CD3+CD4+T细胞浸润也显著增加。
综上所述,本实验构建的纳米复合佐剂能有效激活DC,促进DC成熟,促进后续体液及细胞免疫发生;体内肿瘤模型中通过皮下注射全身给药方式,纳米复合佐剂表现出良好的抗肿瘤效果,能显著提高肿瘤内浸润性T淋巴细胞比例,改善肿瘤微环境,为肿瘤的免疫治疗提供新的纳米递送给药方式,同时为之后佐剂与肿瘤相关性抗原共包载递送或与单抗药物的联合抗癌研究提供新思路。

