雷奈酸锶在高糖诱导的成骨细胞损伤中的保护作用
张辉 ,冉磊 ,窦群立
1.陕西中医药大学,陕西 咸阳 712046;2.陕西省中药资源产业化协同创新中心,陕西 咸阳 712083;3.陕西中医药大学 附属医院,陕西 咸阳 712000
糖尿病性骨质疏松(diabedic osteoporosis,DOP)是糖尿病在骨骼系统中的重要慢性并发症之一,其患病率约占糖尿病患者的33%,且呈逐年上升的趋势[1-2]。DOP作为一种全身代谢性疾病,主要表现为骨量降低、骨质下降、骨脆性增加、骨强度降低,常伴有腰背髋部疼痛、持续性肌肉钝痛等症状。DOP患者骨折风险较非糖尿病患者显著增高,而一旦出现骨折,由于患者的特殊机体状态,大大增加了致残率和致死率,严重威胁患者的生命健康,并给患者和社会带来了巨大的经济负担[3-4]。崔冉等[5]指出,对于DOP的治疗不能单纯降低血糖,还应结合抗骨质疏松药物等方面的干预才能最大程度地提高骨密度,预防骨折的发生。
雷奈酸锶(strontium ranelate,SR)是一种兼具促进骨形成和抑制骨吸收双重作用的抗骨质疏松类药物,凭借其良好的临床药效和生物利用度被临床推广使用[6-7]。研究表明,成骨细胞活性的抑制及其凋亡的增加是导致DOP发生发展的重要原因,而SR的促成骨机制与其对成骨细胞增殖和分化的促进作用息息相关[8]。基于此,本研究通过体外实验建立高糖环境诱导的成骨细胞损伤模型,通过对SR作用后成骨细胞的生物学活性、细胞凋亡水平、细胞形态以及骨形成相关基因与蛋白表达水平等进行探究,旨在系统评估SR对高糖诱导的成骨细胞损伤中的保护作用,以期为SR在治疗DOP中的临床应用提供科学合理的实验依据。
1 材料与方法
1.1 材料
MC3T3-E1成骨细胞系保存于陕西中医药大学附属医院骨科实验室;胎牛血清购于杭州四季青公司;青/链霉素、α-MEM培养基、胰蛋白酶购于Gibco公司;MTT检测试剂盒购于Sigma公司;SR购于Servier公司;细胞凋亡检测试剂盒购于Beyotime公 司 ;TRIzol、PrimeScript RT 试 剂 盒 、SYBR Premix Ex TaqⅡ试剂盒购于TaKaRa公司;骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)、胰 岛 素 样 生 长 因 子 1(insulin-like growth factor 1,IGF-1)酶联免疫试剂盒购于上海酶联生物科技有限公司。
1.2 成骨细胞培养
体外培养MC3T3-E1成骨细胞系,细胞生长于含10%胎牛血清、1%青/链霉素的α-MEM培养基中,于37℃、5%CO2的细胞培养箱中培养,隔天换液。待细胞密度达到80%后,用0.25%的胰蛋白酶传代,取对数期细胞进行后续实验。
1.3 高糖环境细胞模型构建
取对数生长期的成骨细胞制成细胞悬液,以1×105/mL接种于96孔板,待细胞充分贴壁后,分别换为含 0、10、30、50、80、100 μmol/L葡萄糖的完全培养液,每组设置6个复孔,于细胞培养箱中培养3 d;随后,每孔加入5 mg/mL MTT溶液20 μL,在37℃细胞培养箱中培养4 h;每孔加入150 μL DMSO溶液并充分振荡以促进晶体溶解,测定D570nm值,以明确能够造成成骨细胞活性显著降低的最优葡萄糖浓度。细胞活性=[(加药组D570nm-空白组D570nm)/(加药组D570nm-空白组D570nm)]×100%。
1.4 SR对成骨细胞活性的影响
将成骨细胞以1×105/mL接种于96孔板,待细胞充分贴壁后,分别加入 0.00、0.05、0.50、5.00、50.00、500.00 mmol/L SR溶液,每种浓度设置6个复孔,于37℃细胞培养箱中培养3 d,用MTT法检测细胞增殖能力。实验重复3次。
1.5 SR对高糖环境诱导的成骨细胞增殖能力的影响
实验分为3组,即对照组、高糖(HG)组、高糖+雷奈酸锶(HG+SR)组。HG组细胞使用含80 μmol/L葡萄糖的完全培养液于细胞培养箱中培养3 d;HG+SR组细胞在用含相同浓度葡萄糖的完全培养液进行孵育的同时,分别加入0.05、0.50、5.00、50.00、500.00 mmol/L SR 溶液,于细胞培养箱中培养3 d;对照组细胞培养于相同环境下,不施加任何干预。每组均设置6个复孔,实验共重复3次。
1.6 细胞凋亡水平检测
采用细胞凋亡检测试剂盒对成骨细胞的凋亡水平进行检测分析。将对照组、HG组和HG+SR组细胞配置为1×106/mL浓度,分别加入500 μL结合缓冲液、5 μL AnnexinⅤ-FITC溶液和5 μL碘化丙啶(PI)溶液,充分混匀并避光反应20 min,用流式细胞仪对各凋亡阶段的成骨细胞数量进行定量分析。
1.7 细胞形态学观察
采用倒置光学显微镜(Olympus CKX31型)观察对照组、HG组和HG+SR组成骨细胞的细胞形态。每组随机选择5个视野,用20倍镜采集图像,并对每个视野中的细胞数量进行定量分析。
1.8 RNA提取及qRT-PCR检测
将对照组、HG组和HG+SR组成骨细胞以2×105/mL接种于6孔板,待细胞密度达到80%后,用TRIzol试剂裂解各组细胞并提取总RNA,以2.5 μg上样量,采用PrimeScript RT试剂盒将RNA反转录为cDNA。随后以β-actin为内参基因,用SYBR Premix Ex TaqⅡ试剂盒和CFX Connect型qRT-PCR仪对样本进行基因扩增,采用 2-ΔΔCt法分析目的基因的表达水平。引物相关序列见表1。
1.9 酶联免疫法(ELISA)检测
采用ELISA试剂盒对各组成骨细胞的BMP-2和IGF-1蛋白分泌情况进行检测。收集各组成骨细胞的培养液,向酶标板的样本孔中分别加入稀释至1/5的上清液各50 μL,同时向标准品孔中依次加入 0、12.5、25、50、100 pg/mL 的标准品各 50 μL,并向每孔加入100 μL酶标试剂,每组样本设置3个复孔。用封板膜封板后将酶标板置于37°C细胞培养箱中孵育1 h,使用洗涤液对样本和标准品孔进行漂洗。随后分别依次加入显色剂A、B液各50 μL,充分混匀后避光孵育15 min。最后,向每孔加入50 μL终止液终止反应,用酶标仪检测各样本的D450nm值。

表1 qRT-PCR引物及序列

图1 不同浓度高糖环境对成骨细胞活性的影响
1.10 统计学分析
所有实验数据均以x±s表示,用SPSS19.0软件对实验数据进行统计分析,采用单因素方差分析检测组间差异,两两比较采用Dunnett-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 高糖环境对成骨细胞活性的影响
不同浓度的葡萄糖对成骨细胞活性的影响如图1所示。方差分析结果表明差异具有统计学意义(F=22.046,P<0.001),说明不同浓度的葡萄糖对成骨细胞活性的抑制作用不同。Dunnett-t检验结果表明,10、30 μmol/L的葡萄糖对成骨细胞活性无显著抑制效果(P>0.05);而用50、80及100 μmol/L的葡萄糖对MC3T3-E1成骨细胞诱导3 d后,成骨细胞活性较对照组均显著降低,抑制率分别为39.66%±4.89%(P=0.001)、66.89%±8.66%(P<0.001)、76.89%±4.70%(P<0.001)。
2.2 不同浓度SR对成骨细胞活性的影响
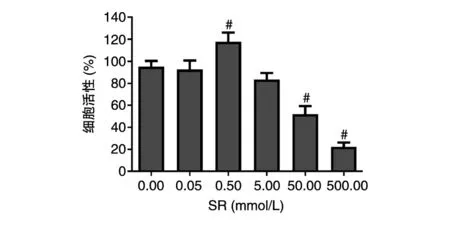
图2 不同浓度SR对成骨细胞活性的影响
不同浓度的SR对成骨细胞活性的影响如图2所示。方差分析结果表明差异具有统计学意义(F=26.303,P<0.001),说 明 不 同 浓 度 的 SR 对MC3T3-E1成骨细胞活性的作用效果不同。Dunnett-t检验结果表明,0.05和5.00 mmol/L的SR对MC3T3-E1细胞活性的促进作用较对照组均无明显差异(P=0.406),50.00和500.00 mmol/L的SR则对MC3T3-E1细胞活性表现出显著的抑制作用(P<0.001)。
2.3 不同浓度SR对高糖环境诱导的成骨细胞增殖能力的影响
研究表明,MC3T3-E1细胞在含80 μmol/L葡萄糖的完全培养液的高糖环境下细胞活性较对照组均被显著抑制(F=21.051,P<0.001);而用不同浓度的SR对高糖环境下的MC3T3-E1细胞进行3 d干预后,0.50与50.00 mmol/L的SR对高糖损伤的成骨细胞具有显著的保护作用(P<0.001,P=0.016),0.05与500.00 mmol/L的SR对高糖作用后的成骨细胞则无显著保护作用(P>0.05),且高浓度SR作用后会加重高糖对成骨细胞活性的损伤作用。
2.4 SR对高糖环境诱导的成骨细胞凋亡水平的影响

图3 不同浓度SR对高糖诱导的成骨细胞活性的保护作用
SR对高糖环境诱导的MC3T3-E1成骨细胞各凋亡细胞分布图及其对应的统计结果如图4所示。当用含80 μmol/L葡萄糖的完全培养液对成骨细胞进行孵育后,HG组细胞的凋亡率(28.92%±1.27%)较对照组(7.49%±0.86%)显著增加(P<0.001)。当用能够对高糖环境诱导的成骨细胞活性具有显著保护效果的0.50 mmol/L的SR对细胞进行孵育后,HG+SR组细胞的凋亡率(20.05%±1.38%)较HG组显著降低(P=0.006),与对照组相比具有统计学差异(P=0.012)。实验结果表明SR能够有效降低高糖环境对MC3T3-E1细胞的损伤,对细胞具有一定程度的保护作用。
2.5 SR对高糖环境诱导的成骨细胞形态学的影响
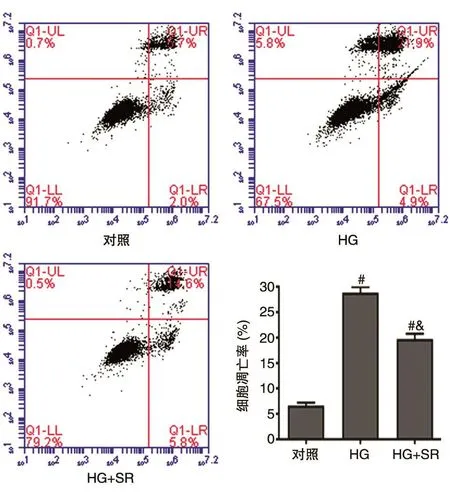
图4 SR对高糖诱导的成骨细胞凋亡水平的影响
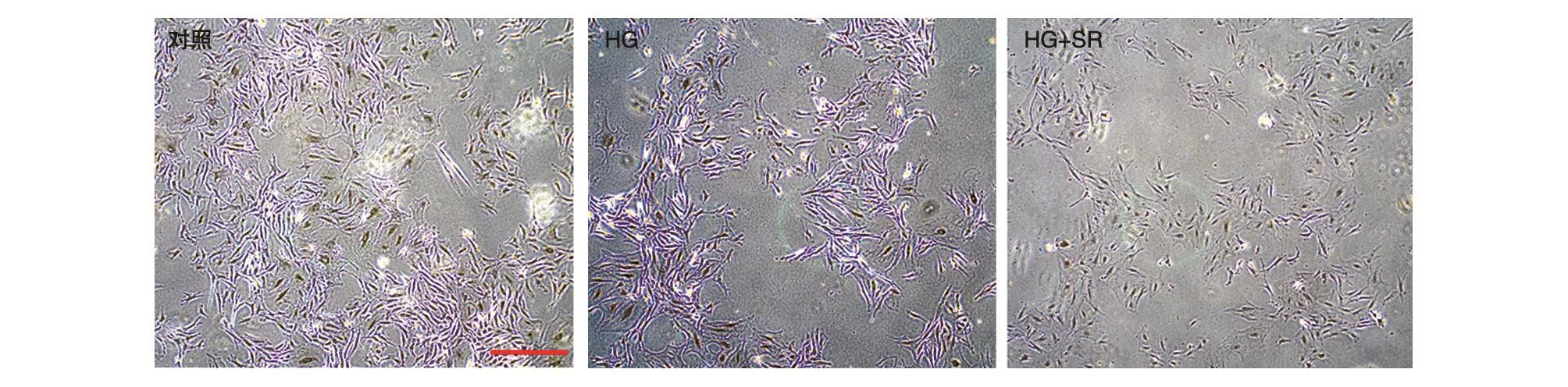
图5 SR对高糖诱导的成骨细胞形态结构的影响
对MC3T3-E1细胞的形态学观察结果如图5所示。对照组细胞形态较完整,细胞密度较大,多呈星型,多数细胞的延展性较好。当用含80 μmol/L葡萄糖的完全培养液对细胞进行损伤后,HG组细胞密度降低,细胞皱缩,细胞表面积缩小;而当用0.50 mmol/L的SR对高糖环境下生长的细胞进行保护后,HG+SR组细胞形态较HG组明显改善,细胞延展性有一定程度的恢复,细胞表面积增大,但细胞密度较对照组仍明显降低。
2.6 SR对高糖环境诱导的成骨细胞相关基因表达水平的影响
SR对高糖诱导的成骨细胞相关基因表达水平的影响如图6所示。80 μmol/L葡萄糖的高糖环境显著降低了MC3T3-E1成骨细胞的Runt相关转 录 因 子 2(Runt-related transcription factor 2,Runx2)、骨钙素(osteocalcin,OCN)和Ⅰ型胶原蛋白(collagen-1,COL-1)的mRNA水平(P=0.016,P=0.038,P=0.012);而用0.50 mmol/L的SR对细胞进行保护后,HG+SR组细胞的Runx2、OCN和COL-1的mRNA表达水平均较HG组显著增加(P=0.008,P=0.022,P=0.040)。
2.7 SR对高糖环境诱导的成骨细胞相关蛋白分泌水平的影响
SR对高糖诱导的成骨细胞BMP-2和IGF-1蛋白分泌水平的影响如图7所示。80 μmol/L葡萄糖能够使BMP-2和IGF-1的蛋白分泌水平被显著抑制(P=0.002,P=0.035),而0.50 mmol/L的SR则能够显著逆转BMP-2和IGF-1蛋白分泌水平的降低(P=0.002,P=0.035)。
3 讨论
DOP是严重的糖尿病并发症,患者的骨量显著减少,骨微结构被破坏,骨折风险大大增加。据报道,1型糖尿病患者骨量减少和DOP发病率为48%~72%,2型糖尿病患者DOP发病率为20%~60%,且骨质丢失速率显著增加[9-10]。因此,积极探索合理有效的DOP治疗手段,对于改善DOP患者生存质量、降低其致残率和致死率具有重要的临床意义。目前治疗糖尿病的药物主要包括胰岛素及各种降血糖药物,而一些降血糖药物如磺胺类药物、噻唑烷二酮类药物等还能够造成骨质的流失[11-12],因此对于DOP的治疗还应结合抗骨质疏松类药物进行。SR是一种具有促骨形成和抗骨吸收双重作用的骨质疏松治疗药物,大量体内实验均证实SR加速新骨形成、促进不同状态大鼠/小鼠的骨质增加[13],体外实验也表明SR能够有效降低破骨细胞分化,同时加速成骨细胞表型的获得[14-15]。此外,大量临床实验证实SR绝经后骨质疏松症具有一定程度的治疗作用,从而大大降低了患者髋骨和椎骨的骨折风险[16-17]。然而,有关SR对于DOP作用效果的研究目前国内外尚未见相关报道。本研究中,我们通过对体外培养的成骨细胞进行高糖诱导,探究不同浓度的高糖溶液和SR对成骨细胞活性的作用效果,筛选出能够诱导成骨细胞活性显著降低的高糖浓度(80 μmol/L)以及对成骨细胞活性具有显著促进作用的SR浓度(0.50 mmol/L),并探讨了该浓度SR对高糖诱导的成骨细胞的细胞活性、形态结构及细胞功能的保护作用,旨在为SR在DOP临床治疗中的应用提供科学合理的实验依据。

图6 SR对高糖诱导的成骨细胞相关基因表达的影响
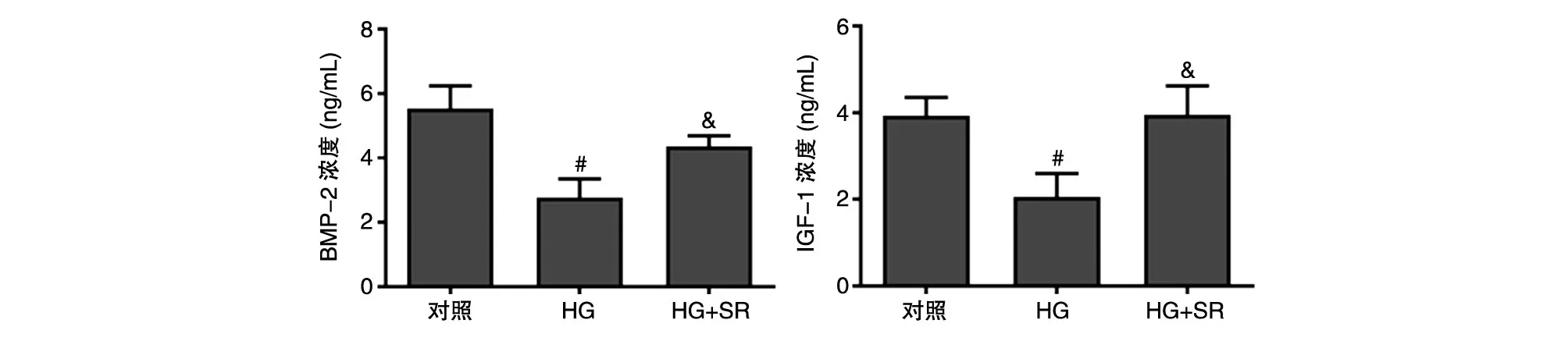
图7 SR对高糖诱导的成骨细胞相关蛋白分泌水平的影响
研究表明,糖尿病患者体内的高血糖环境对骨骼细胞具有重要影响。长期处于高血糖状态的机体,其骨代谢平衡被打破,高浓度的葡萄糖能够抑制成骨细胞的增殖和分化[18]。在本研究中,我们发现高糖环境能够显著抑制成骨细胞增殖水平,而SR则能够显著促进高糖诱导的成骨细胞增殖水平的降低。此外,长期的高血糖环境能够引发机体晚期糖基化终末产物(advanced glycation endproducts,AGEs)的形成和累积,从而促进成骨细胞凋亡并抑制其分化,增加骨胶原的糖化和骨脆性,进而降低骨强度[19]。本研究发现的高糖环境显著增加成骨细胞的凋亡水平也证实了这一点,而SR对高糖诱导的细胞凋亡具有显著的抑制作用,并且SR能够显著改善高糖诱导的成骨细胞形态学的退变,增加细胞延展性和细胞面积,表明SR对高糖诱导的成骨细胞损伤具有一定程度的保护作用。
Runx2、OCN和COL-1是骨发育过程中重要的转录调节因子,对骨形成和骨重建具有重要的调节作用。Runx2作为骨形成的关键调节因子,能够促进早期成骨细胞的增殖和分化,并能影响其他骨形成相关细胞因子的分泌[20];OCN是成骨细胞分化成熟的标志[21],而COL-1参与胶原纤维的形成,同样是骨形成的典型调节者[22]。本研究表明,高糖环境下成骨细胞的Runx2、OCN及COL-1的基因表达水平显著降低,SR干预则显著上调了三者的mRNA表达水平,而OCN和COL-1的表达上调很可能与Runx2的高表达有关。以上结果表明SR干预能够通过促进骨形成相关细胞因子的表达而发挥对高糖诱导的成骨细胞损伤的保护作用,进而促进成骨细胞的分化与矿化,并对高糖环境下的骨形成产生一定程度的促进作用。BMP-2也是骨形成和骨伤愈合过程中重要的细胞因子之一,据报道BMP-2能够显著增加去势大鼠的骨密度,改善骨骼的力学属性[23-24]。IGF-1是骨骼中最丰富的生长因子,具有保护骨量、促进骨祖细胞和成骨细胞增殖与分化、加速骨矿化结节形成、抑制细胞凋亡的作用[25]。本研究发现SR能够有效促进高糖诱导的成骨细胞BMP-2和IGF-1的分泌,进一步表明SR在改善成骨细胞活性、抑制细胞凋亡、促进骨形成的过程中发挥重要作用。
综上所述,本研究增加了科学界对于SR在高糖诱导的成骨细胞损伤中的保护作用及相关机制的认识,从而为SR在糖尿病机体中骨形成的促进作用提供了新见解,并为其在DOP临床治疗中的应用提供了合理的实验依据。

