抗GM-CSF纳米抗体的筛选与鉴定
郭鹏利,周鹏,尚雨寒,周斌,张蕾,李紫晨,李山虎,季艳伟
1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2.北京大学 化学与分子工程学院,北京 100871;3.军事医学研究院 生物工程研究所,北京 100850
集落刺激因子(colony stimulating factor,CSF)家族主要与哺乳动物骨髓细胞如单核细胞、巨噬细胞、树突细胞(dendritic cells,DC)和多形核吞噬细胞(如嗜中性粒细胞和嗜酸性粒细胞)的生成有关[1-2]。该家族的3个主要成员分别为粒细胞集落刺激因子(granulocyte CSF,G-CSF)、巨噬细胞集落刺激因子(macrophage CSF,M-CSF)和粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage CSF,GM-CSF)。其中,GM-CSF作为第一个被鉴定为可诱导粒细胞和巨噬细胞增殖分化的生长因子,在机体细胞免疫和体液免疫中都发挥着重要作用[3]。GM-CSF不仅能够增强MHCⅠ、Ⅱ类分子及协同刺激分子的表达,促进抗原呈递,还可以促进DC的增殖分化和成熟,在提高DC数量的基础上调节其在体内的分布和抗原的呈递等功能,激发机体的抗肿瘤免疫应答[4];此外,GM-CSF还能诱导抗肿瘤抗体的产生[5]。临床上,GM-CSF已被美国食品药品管理局(FDA)批准用于与干细胞移植相关的中性粒细胞减少症的治疗[6]。同时,GM-CSF也是一种炎症因子,促进类风湿关节炎(rheumatoid arthritis,RA)和多发性硬化症(multiple sclerosis,MS)等炎症疾病的发生[3,7]。Taylor等研制的用于RA治疗的抗GMCSF抗体药物Namilumab(AMG203)在临床Ⅱ期研究中表现出巨噬细胞活性抑制作用,治疗效果存在显著的量效关系[8]。此外,一些其他抗GM-CSF抗体药物也被广泛用于前列腺癌、黑色素瘤及胰腺癌等癌症的治疗[9],而抗体实现药物化的关键是抗体本身应具有很强的亲和力。
抗体小型化近年来一直是研究热点,而纳米抗体(nanobody,Nb)因具有相较于其他类型抗体更强的抗原结合能力而备受关注[10]。这是一种仅存在于骆驼科动物(羊驼、单双峰骆驼及美洲驼)和一些软骨鱼(鲨鱼和银鲛)体内,天然缺失轻链的单域重链抗体(variable domain of heavy chain of heavy-chain antibody,VHH),其晶体结构为椭圆形,是最小的功能性抗原结合片段[11],体积仅为4×2.5×3 nm3,故又称纳米抗体[12-13]。相比于应用广泛的传统单克隆抗体,纳米抗体在理化和功能方面具有以下优势:纳米抗体的分子小,其相对分子质量仅为传统单克隆抗体的1/10左右,且可实现在微生物体内的可溶性表达,从而大大降低制备成本[14-15];受体与配体相结合的区域是抗体作用的重要靶位,纳米抗体较传统单克隆抗体具有更长的CDR1和CDR3区,有更强的柔韧性和凸面性[16],使其可更好地与受体表面的裂缝和腔隙相结合,从而表现出更强的亲和力[17-18]。
本研究中,我们通过免疫羊驼构建纳米抗体初始文库,用噬菌体展示技术从文库中筛选出5株不同氨基酸序列的纳米抗体,原核表达纳米抗体G1,并用Octet RED96系统测定其亲和力。
1 材料和方法
1.1 材料
羊驼由南昌大佳生物科技有限公司提供;GM-CSF由中国食品药品检定研究院提供;pHEN1噬菌体展示系统质粒载体,大肠杆菌TG1、ER2738、BL21(DE3)均由本实验室保存;牛血清白蛋白(BSA)和脱脂奶粉购自上海生物工程技术服务有限公司;限制性内切酶SifⅠ和NotⅠ、DL2000 DNA marker、T4DNA连接酶和辅助噬菌体M13KO7购自TaKaRa公司;辣根过氧化物酶(HRP)标记的M13单克隆抗体购自Santa Cruz公司;卵清蛋白(OVA)购自Sigma公司;酵母膏和蛋白胨购自Oxoid公司;淋巴细胞分离液(1.077)、低分子质量蛋白质marker、IPTG、卡那霉素、四环素和氨苄青霉素购自北京索莱宝公司。
1.2 免疫及效价测定
1.2.1 动物免疫 采集免疫前的羊驼血液用作阴性对照。以GM-CSF为免疫原,采用颈部多点注射方式对羊驼进行4轮免疫。溶解750 μg GMCSF于500 μL PBS溶液中,再与等体积弗氏完全佐剂乳化后进行第1轮免疫,免疫剂量为750 μg/只。3周后进行第2轮免疫,之后每隔2周加强免疫 1次,将 375 μg GM-CSF 溶于 500 μL PBS溶液中,与等体积弗氏不完全佐剂乳化后分别进行第2、3、4轮免疫,免疫剂量为375 μg/只。每次免疫后第7 d,采集羊驼颈静脉血液。
1.2.2 免疫效价测定 采用间接ELISA法测定每轮免疫后羊驼抗血清效价。用PBS溶液稀释GM-CSF至 10 μg/mL,加入 96孔酶标板中,100 μL/孔,4℃包被过夜;PBST洗板3次,加入3%脱脂奶粉,300 μL/孔,37℃封闭 2 h;PBST 洗板 3次,用PBS溶液倍比稀释每一轮免疫后的羊驼抗血清,分别加入 96 孔酶标板中,100 μL/孔,37℃孵育30 min,以第1次免疫前采集的羊驼血清作为阴性对照;PBST洗板3次,加入稀释至1/10 000的鼠抗羊驼多克隆抗体,100 μL/孔,37℃孵育45 min;PBST洗板3次,加入TMB显色液,100 μL/孔,37℃孵育10 min;加入2 mol/L硫酸溶液,50 μL/孔,终止反应,立即用酶标仪读取D450nm值。
1.3 噬菌体展示纳米抗体文库的构建
1.3.1 总RNA提取和VHH目的基因扩增 取第4轮免疫后的羊驼颈静脉血液,用淋巴细胞分离液分离淋巴细胞,TRIzol总RNA抽提试剂盒提取淋巴细胞中的总RNA,紫外分光光度计ND-1000测定其含量。以RNA为模板进行RT-PCR,获得VHH目的基因,再通过巢式PCR扩增VHH基因片段,并经1%琼脂糖凝胶电泳对PCR产物进行验证,用凝胶回收试剂盒回收VHH目的基因。1.3.2 初始文库的构建 用SfiⅠ/NotⅠ对回收得到的VHH基因和pHEN1噬菌粒载体分别进行双酶切,再通过T4DNA连接酶连接,构建重组载体。通过电击将重组载体转化大肠杆菌TG1感受态细胞,共转化12次,每次电转后加入1 mL 37℃预热的SOC培养基,37℃、250 r/min复苏1 h,将复苏的菌液混合后梯度稀释,涂布于含100 μg/mL氨苄青霉素的LB平板,计算文库库容量。
在库容量测定的平板上随机挑取24个单菌落,进行菌落PCR,鉴定初始文库VHH基因插入率。另随机挑选15个单菌落扩大培养后送公司测序,分析初始文库的多样性。
1.3.3 初始文库的拯救 取至少10倍库容活细胞数的初始文库接种于200 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、250 r/min培养至D600nm约0.5,按20∶1(感染复数)加入M13KO7辅助噬菌体,静置15 min,37℃、220 r/min培养1 h;4℃、5000 r/min离心5 min,去上清,用等体积的含 100 μg/mL 氨苄青霉素、50 μg/mL卡那霉素的 LB 培养基重悬,30℃、220 r/min培养 5~8 h;4℃、8000 r/min离心10 min,取上清,加入1/5体积的PEG/NaCl溶液,4℃静置过夜;4℃、12 000 r/min离心20 min,弃上清,加入2 mL PBS溶液重悬噬菌体沉淀,即得到噬菌体展示纳米抗体文库。取10 μL测定滴度,剩余文库加入甘油,终浓度为50%,-80℃保存,用于后续生物淘选。
1.4 噬菌体展示纳米抗体文库的生物淘选与鉴定
1.4.1 噬菌体展示纳米抗体文库的生物淘选 按照结合、洗涤、洗脱、扩增的方式,对上述噬菌体展示纳米抗体文库进行亲和淘选,采用3%BSA和3%OVA交替封闭的方法降低非特异性吸附,GM-CSF的包被浓度逐轮降低,依次为100、50、25、12.5 μg/mL。淘选的具体步骤:向96孔酶标板中加入相应浓度的 GM-CSF,100 μL/孔,4℃包被过夜;弃上清,0.05%PBST洗板3次,加入3%BSA溶液(或3%OVA溶液),300 μL/孔,37℃封闭2 h;弃封闭液,0.05%PBST洗板3次,加入噬菌体悬液,100 μL/孔,37℃振荡孵育 2 h;弃上清 ,0.1% PBST洗 板 10~15次 ,加 入 0.1 mol/L Gly-HCl洗脱缓冲液(pH2.2)进行洗脱,100 μL/孔,室温振荡10 min,加入1 mol/L Tris-HCl缓冲液(pH8.8)进行中和,15 μL/孔,混匀,吸出中和后的洗脱液,取10 μL测定滴度,剩余的进行扩增后用于下一轮淘选。
1.4.2 阳性克隆的鉴定 从测定滴度的平板上随机挑取单菌落进行噬菌体的拯救纯化,之后采用间接ELISA法鉴定阳性克隆。用PBS溶液稀释GM-CSF 至10 μg/mL,加入 96孔酶标板,100 μL/孔,4℃包被过夜;PBST洗板3次,加入3%脱脂奶粉,300 μL/孔,37℃封闭 2 h;PBST 洗板 3 次,加入扩增后的噬菌体悬液,100 μL/孔,37℃孵育45min;PBST洗板6次,加入HRP标记的抗M13噬菌体单克隆抗体,100 μL/孔,37℃孵育 45 min;PBST 洗板 3次,加入 TMB 显色液,100 μL/孔,37℃孵育 10 min;加入 2 mol/L硫酸溶液,50 μL/孔,终止反应,立即用酶标仪读取D450nm值。
1.5 抗GM-CSF纳米抗体G1的表达纯化及鉴定
将阳性克隆纳米抗体G1的pET26b重组质粒载体转入大肠杆菌BL21感受态细胞,涂布于含50 μg/mL卡那霉素的LB平板,37℃静置培养12 h;挑取单菌落接种于5 mL含50 μg/mL卡那霉素的LB液体培养基,37℃、250 r/min培养过夜;按1%的接种量接种于含50 μg/mL卡那霉素的LB液体培养基,37℃、250 r/min培养至D600nm约0.5,加入终浓度1 mmol/L的IPTG,30℃、250 r/min诱导表达8 h;4℃、5000 r/min离心8 min,弃上清,收集菌体;加入PBS重悬菌体沉淀,冰浴超声波破碎菌体,破碎液于4℃、12 000 r/min离心15 min,分离上清和沉淀。用Ni2+-NTA亲和层析柱纯化重组蛋白,SDS-PAGE分析纯化后的纳米抗体纯度,Octet RED96系统测定抗体的亲和力。
2 结果
2.1 4轮免疫效价测定
共进行4轮免疫,以免疫前的血清作为阴性对照,采用间接ELISA法测定每一轮免疫后的羊驼抗血清效价。结果如图1,羊驼抗血清效价逐轮升高,但第4轮免疫较第3轮免疫效果提高不明显,故收集第3、4轮免疫后的血清用于后续噬菌体展示纳米抗体文库的构建。
2.2 噬菌体展示纳米抗体文库的构建
2.2.1 总RNA提取和VHH基因扩增 分离羊驼血清淋巴细胞,提取总RNA,采用ND-1000测定其浓度为408.6 ng/μL,RT-PCR和巢式PCR扩增VHH基因,1%琼脂糖凝胶电泳验证PCR产物,结果如图2,经过巢式第1、2轮PCR,最终得到约500 bp的VHH基因。
2.2.2 初始文库的构建与鉴定 经酶切、连接后的质粒载体转入大肠杆菌TG1后即构建得到初始文库,经测定,其库容量为1.37×109cfu。在文库计数的平板上随机挑取24个单菌落,通过菌落PCR鉴定VHH基因插入率,结果见图3,24个克隆全部在500 bp处出现目的条带,表明VHH基因成功转入大肠杆菌TG1,克隆效率达100%。另挑取15个单菌落扩增后测序,用于分析文库的多样性,其氨基酸序列比对结果如图4,除1号和12号克隆氨基酸序列完全相同外,其他克隆序列差异性大,表明初始文库呈现较好的多样性。初始文库库容量大、多样性好,是后续淘选出生物性能良好的纳米抗体的关键。本研究构建的纳米抗体初始文库有着较好的多样性和较高的库容量,为后续筛选出高亲和力的纳米抗体奠定了良好的基础。

图1 羊驼抗血清效价测定结果

图2 琼脂糖凝胶电泳验证VHH基因扩增结果

图3 菌落PCR验证VHH基因克隆效率
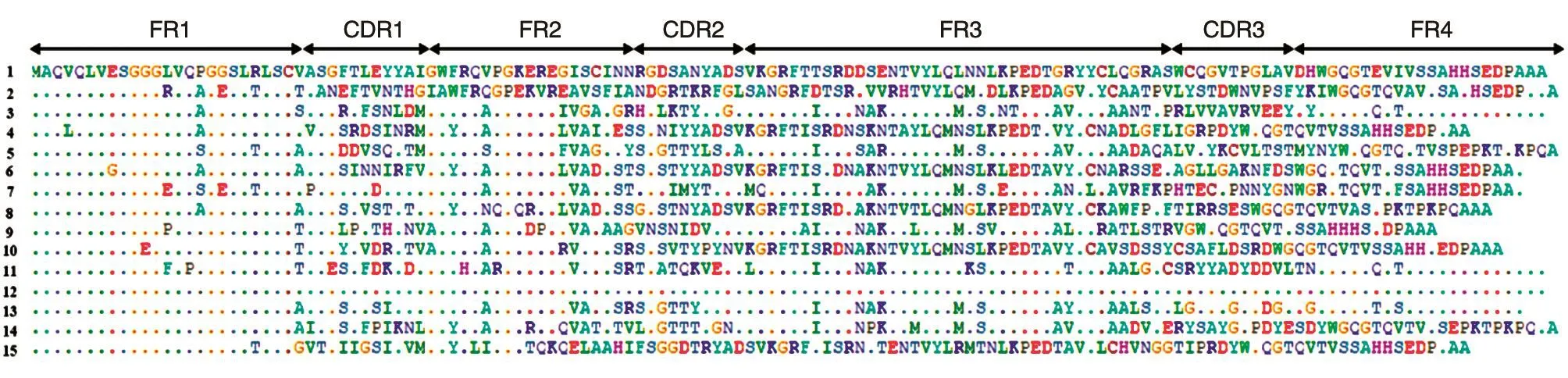
图4 初始文库的氨基酸序列比对结果
2.3 噬菌体展示纳米抗体文库的生物淘选
经过3轮淘选,随着GM-CSF包被浓度的降低,抗GM-CSF的特异性噬菌体得到有效富集。从第3轮淘选洗脱物滴度测定平板上随机挑选39个单克隆进行阳性克隆的鉴定,结果如图5。取阴性对照D450nm值的3倍以上为阳性克隆,共有20个克隆呈阳性,将其全部测序,结果经BioEdiet软件比对分析后,共筛选到5株氨基酸序列差异性较大的纳米抗体,图6所示为其中一株的氨基酸序列,将该株纳米抗体命名为纳米抗体G1。
2.4 纳米抗体G1的表达纯化
将纳米抗体G1的载体转入大肠杆菌BL21后进行表达,细胞经超声波破碎后,采用Ni2+-NTA亲和层析柱纯化,SDS-PAGE分析纯化后的蛋白,结果如图7,蛋白相对分子质量约15×103,与理论值相符,且纯化后的条带无明显杂带,表明纳米抗体G1纯度较高。
2.5 纳米抗体G1亲和力测定
采用Octet RED96系统测定纳米抗体G1的亲和力,结果如图8,其解离平衡常数KD为2.95×10-8mol/L,表明纳米抗体G1与GM-CSF的结合力达到了纳摩尔级,具有较强的亲和力。
3 讨论
GM-CSF已逐渐成为炎症疾病的新型治疗靶点,制备相应的抗体对于相关炎症疾病的治疗具有重要意义。目前针对GM-CSF的特异性抗体多为传统单克隆抗体,纳米抗体的制备尚未见报道。本研究制备得到抗GM-CSF纳米抗体,且呈现较强的亲和力,为后续推进体外细胞和体内水平上炎症治疗的应用奠定了坚实的基础。
纳米抗体的分子大小仅为传统单克隆抗体的1/10,具有独特的优势,如体积小、稳定性高,能够穿过血脑屏障并持续稳定地发挥作用;纳米抗体还可实现在原核生物中大量表达,可以大大降低生产成本,且免疫原性低[19],在细胞中容易被清除,从而保证对人体无害。更重要的,纳米抗体有着更长的抗原结合互补区CDR1和CDR3,具有比传统单克隆抗体更强的抗原结合能力,并且依据纳米抗体易改造的特点,还可通过点突变等基因工程技术进一步提高纳米抗体的亲和力[20]。而单克隆抗体由于组织渗透性差,体内不易被清除且制备成本高,从而限制了其临床应用。

图5 噬菌体阳性克隆的鉴定

图6 纳米抗体G1的氨基酸序列
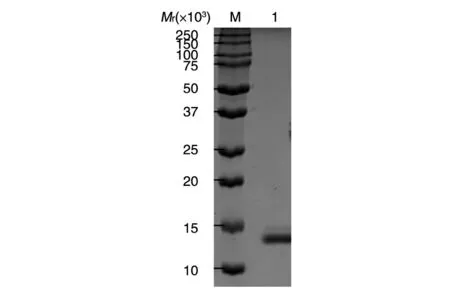
图7 纳米抗体纯化后的SDS-PAGE分析
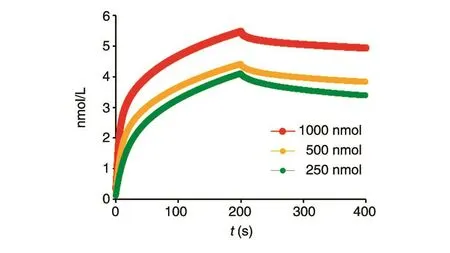
图8 纳米抗体G1亲和力测定结果
纳米抗体文库的库容量和多样性是淘选出高特异性、高亲和力纳米抗体的关键。为了克服大肠杆菌BL21感受态细胞转化率低的问题,本研究进行了12次电击转化,最终文库库容量达1.37×109cfu,保证了文库的多样性。本研究采用固相淘选的方式对噬菌体展示纳米抗体文库进行生物淘选,淘选过程中,GM-CSF的纯度和包被浓度、封闭液的种类和浓度、PBST的浓度、噬菌体投入量、结合时间及洗脱时间等因素都会影响噬菌体颗粒的富集[21]。本研究采用3%BSA和3%OVA交替封闭、逐渐加大洗涤强度等方式提高生物淘选的特异性,还可进一步优化淘选条件以期获得具有更高特异性、更高亲和力的纳米抗体。
综上,本研究制备的高亲和力抗GM-CSF纳米抗体可用于进一步的炎症抗体药物开发。不同疾病或同一疾病不同阶段,患者体内的血清GM-CSF含量不同[22],可通过监测抗GM-CSF纳米抗体相关反应强度,实现临床疾病诊断、患者危险分层及疾病进程和治疗反应的预测。

