利用CRISPR/Cas9基因编辑技术构建CDH1基因敲除的人乳腺癌MCF-7稳定细胞系
高伟健,朱一超,郑幽,张波,王征旭,孙强
1.解放军医学院,北京 100853;2.军事医学研究院 生物工程研究所,北京 100071;3.空军军医大学,陕西 西安 100038;4.解放军总医院第七医学中心 生物治疗中心,北京 100700
CDH1基因的功能是编码上皮钙黏蛋白(epithelial cadherin,E-钙黏蛋白)。E-钙黏蛋白是相对分子质量为120×103的跨膜蛋白,由5个串联重复序列的胞外区、胞内区和跨膜区组成[1-2]。其胞外区与相邻细胞上的钙黏蛋白结合并形成细胞间黏附,而胞内区与连环蛋白结合并激活Wnt信号通路[3]。E-钙黏蛋白的缺乏造成细胞间黏附系统的功能障碍,细胞与细胞黏附丧失,β连环蛋白释放和Wnt信号传导增加,最终导致肿瘤侵袭性增强[4]。研究显示,E-钙黏蛋白的缺失与多种肿瘤的发生、发展和预后不良相关,如胃癌、头颈部鳞癌和乳腺癌等[5-7]。Sun等[8]研究发现,在缺乏内源性表达E-钙黏蛋白的人乳腺癌细胞中,外源性E-钙黏蛋白的表达会诱导cell-in-cell结构形成。Wang等[9]研究显示,与E-钙黏蛋白免疫组化染色阴性的乳腺癌患者相比,阳性患者的PD-1-肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)更多。而与PD-1+TILs相比,PD-1-TILs能够产生更多的白细胞介素2和γ干扰素,因此具有更强的免疫活性[10]。
CRISPR/Cas9基因编辑技术从细菌抵御外来噬菌体和质粒入侵的免疫防御机制演变而来[11]。与锌指核酸内切酶(zincfinger endonuclease,ZFN)和类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)等经典的基因打靶技术相比,CRISPR/Cas9具有操作简单、精确高效和制备周期短等优点[12]。为了进一步研究E-钙黏蛋白表达与肿瘤免疫治疗之间的关系,我们在本实验中采用CRISPR/Cas9技术构建CDH1基因敲除的MCF-7细胞系,为后续研究奠定基础。
1 材料与方法
1.1 材料
MCF-7细胞、lentiCRISPR v2质粒由军事医学研究院生物工程研究所保存并提供;感受态大肠杆菌Trans10购自全式金公司;BsmBⅠ限制性内切酶、氯化钙、2×HBS、嘌呤霉素、Phalloidin染料购自Thermo Fisher公司;T4DNA连接酶购自NEB公司;琼脂糖凝胶DNA回收试剂盒、无内毒素质粒小提中量试剂盒、基因组DNA提取试剂盒和PCR试剂盒购自天根生化公司;胎牛血清购自PAN-Biotech公司;高糖DMEM培养基、磷酸缓冲盐溶液(PBS)、化学发光检测盒、0.25%-EDTA胰酶购自迈晨科技公司;Alexa Fluor 488标记的山羊抗鼠二抗购自Invitrogen公司;4',6-二脒基-2-苯基吲哚(DAPI)封片剂购自北京中杉金桥公司;鼠源E-钙黏蛋白抗体购自BD Biosciences公司;鼠源GAPDH抗体购自ABclonal公司;辣根过氧化物酶标抗鼠IgG购自CST公司;单链向导RNA(sgRNA)寡核苷酸的DNA序列合成及基因测序由中美泰和生物技术公司完成。
1.2 设计识别靶位点的sgRNA序列
根据NCBI查询的CDH1基因序列,应用在线sgRNA设计工具(http://chopchop.cbu.uib.no/),根据CRISPR-Cas9靶点设计原则,设计出符合实验要求的sgRNA序列,进行筛选及脱靶效应评估,比对排除其余同源序列后,得到sgRNA干扰序列。在序列正义链与反义链的5'端添加BsmBⅠ酶切位点(CACCG/AAAC)。sgRNA正向序列为5'-CA CCGAAGATTGCACCGGTCGACAA-3',反向序列为5'-AAACTTGTCGACCGGTGCAATCTTC-3'。设计的单链sgRNA由公司合成,并经梯度降温PCR退火形成双链sgRNA。
1.3 重组质粒的构建及鉴定
将lentiCRISPR v2空质粒载体用限制性内切酶BsmBⅠ酶切后通过琼脂糖凝胶电泳回收,用T4DNA连接酶将退火磷酸化后的sgRNA产物与酶切回收产物连接得到连接产物,将连接产物转化大肠杆菌Trans10感受态细胞,均匀涂在氨苄霉素抗性平板上,37℃培养箱中培养12 h,隔天挑取生长良好的5个单克隆菌落,在500 μL含氨苄青霉素的液体培养基中摇3~4 h,将500 μL菌液装入无菌的1.5 mL EP管中,送至中美泰和生物技术公司测序,提取序列正确的重组质粒,获得纯化的重组表达载体lentiCRISPRv2-CDH1-KO。
1.4 病毒包装、感染
取HEK293T细胞按1.0×106/孔的密度接种于6孔板内,加入含10%胎牛血清的高糖DMEM培养基,在37℃、5%CO2条件下培养过夜;当细胞汇合度为80%~90%时,取500 ng lentiCRISPRv2-CDH1-KO质粒、500 ng VSVG包装质粒、500 ng Pax2包装质粒、19 μL 1 mol/L氯化钙共同稀释在 129 μL ddH2O中,与 152 μL 2×HBS混合转入HEK293T细胞,孵育6 h后换成DMEM培养基继续培养48 h;收集含病毒上清,用0.45 μm孔径的滤器过滤,收集滤液;将人乳腺癌细胞系MCF-7按3.0×105/孔的密度铺于6孔板中,每孔加入0.5 mL DMEM培养基、1 mL病毒上清、1.5 μL聚凝胺,48 h后用嘌呤霉素(1 g/L)筛选3~4 d,获得稳定表达lentiCRISPRv2-CDH1-KO的MCF-7细胞株。
1.5 CDH1缺失的MCF-7细胞基因组的提取及CDH1基因测序
将获得的稳定表达lentiCRISPRv2-CDH1-KO的MCF-7细胞与对照MCF-7细胞以5.0×105/孔的密度铺于6孔板中,当细胞密度达到80%后进行消化,收集细胞,用基因组DNA提取试剂盒提取基因组。扩增CDH1基因进行测序,检测CDH1基因是否敲除成功,PCR上游引物序列5'-GAGAA AGAAATCAGAGCACAAGGAAG-3',下游引物序列为5'-GTGTTCAGGCCTTTACCACTCTTCTAC-3'。测序验证后挑选单克隆细胞继续培养,待细胞密度达到70%时,收集部分细胞提取蛋白。
1.6 Western印迹鉴定稳定转染细胞系中E-钙黏蛋白的表达
分别选取对照MCF-7细胞与表达lentiCRISPRv2-CDH1-KO 的 MCF-7细胞以 5.0×105/孔的密度铺于6孔板中,12 h后吸走培养基,PBS清洗后用RIPA裂解细胞,提取细胞的总蛋白并用BCA法进行蛋白定量,每个样各取50 μg总蛋白,与上样缓冲液混合后煮沸5 min变性,完成蛋白样本的制备。将样本进行SDS-PAGE,电泳结束后将蛋白转至PVDF膜上,用5%脱脂奶粉室温封闭。一抗、二抗孵育,加入曝光底物进行曝光。以GAPDH为内参,Western印迹检测E-钙黏蛋白的表达水平。
1.7 免疫荧光染色检测稳定转染细胞系中E-钙黏蛋白的表达分布
分别将lentiCRISPRv2-CDH1-KO、对照组MCF-7细胞各2.0×105/孔接种在含盖玻片的12孔板内,37℃恒温孵育箱培养12 h;弃上清培养基,PBS清洗后加入1 mL 4%多聚甲醛,室温固定15 min;移除多聚甲醛,用1 mL PBS清洗3次;用1 mL 0.15%的Triton X-100室温透膜3 min,加入PBS清洗3次;加入5%的牛血清白蛋白室温封闭1 h,封闭结束后加入鼠抗人E-钙黏蛋白抗体(1∶200),4℃孵育过夜;次日用PBS洗涤3次;加入Alexa Fluor 488标记的山羊抗鼠二抗(稀释比为 1∶200),Phalloidin(1∶200)室温染色 1 h,PBS清洗3次,每次5 min;加入封片剂,避光30 min。
1.8 统计分析
用SPSS 22软件进行统计学分析,t检验比较样本均数之间的差异,以P<0.05表示差异有统计学意义。
2 结果
2.1 lentiCRISPRv2-CDH1-KO载体的鉴定
重组质粒基因测序结果显示在酶切位点之间插入的片段位置、方向及序列与预期一致(图1),靶向CDH1基因的sgRNA序列成功插入lenti-CRISPR v2载体,证明lentiCRISPRv2-CDH1-KO重组质粒构建成功。
2.2 CDH1敲除的人乳腺癌MCF-7细胞的DNA测序鉴定
将嘌呤霉素筛选后的多克隆细胞提取基因组DNA,通过测序检测CDH1基因敲除是否成功。PCR产物测序显示在PAM序列附近的靶基因位置出现突变(表1)。
2.3 Western印迹检测CDH1敲除的MCF-7细胞中E-钙黏蛋白的表达
以未感染的MCF-7细胞系作为对照,Western印迹显示表达lentiCRISPRv2-CDH1-KO载体的细胞系中的E-钙黏蛋白水平明显降低,表达水平几乎为0,说明CDH1基因敲除成功(图2)。
2.4 免疫荧光染色观察CDH1敲除MCF-7细胞中E-钙黏蛋白的表达分布

图1 lentiCRISPRv2-CDH1-KO重组质粒测序结果

利用免疫荧光染色观察对照MCF-7细胞与表达lentiCRISPRv2-CDH1-KO的MCF-7细胞中E-钙黏蛋白的表达分布。结果显示,表达lenti-CRISPRv2-CDH1-KO的MCF-7细胞胞膜及胞质中均不能明显观察到E-钙黏蛋白的表达(图3)。
3 讨论
E-钙黏蛋白的编码基因CDH1是一种抑癌基因,该基因的突变与多种类型的癌症有关,其功能丧失可以导致癌症进展[13]。研究表明,E-钙黏蛋白可以促进细胞间黏附,并抑制肿瘤细胞的浸润和转移[14]。E-钙黏蛋白低表达是上皮间质转化(epithelial-to-mesenchymal transition,EMT)的一种标志,而EMT与PD-L1和其他免疫检查点的高表达有关[15-16]。Bradley等[17]发现E-钙黏蛋白的转录和表达水平与接受免疫检查点抑制剂治疗的肿瘤患者的生存期密切相关。研究人员根据患者接受抗PD-1治疗前黑色素瘤样本中E-钙黏蛋白mRNA水平的中位数值将患者分为低转录组和高转录组,治疗后2组比较,E-钙黏蛋白高转录组患者的总生存期明显更长(P=0.0029)。Hugo等[18]报道,在经PD-1阻断剂治疗的黑色素瘤患者中,非响应组E-钙黏蛋白的转录水平较低。E-钙黏蛋白有可能作为肿瘤患者进行免疫治疗的筛选指标。
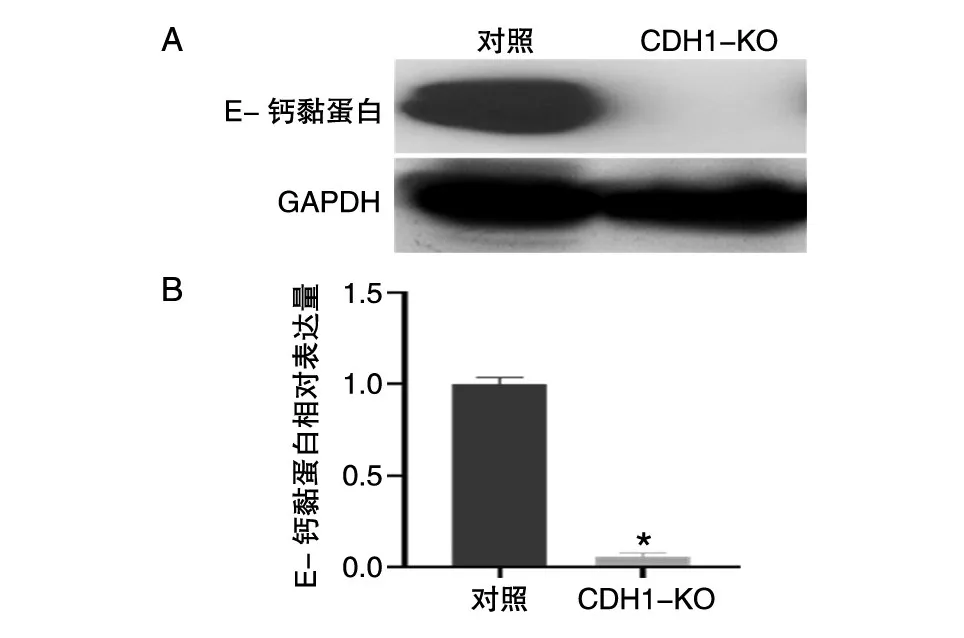
图2 Western印迹验证敲除CDH1的人乳腺癌细胞
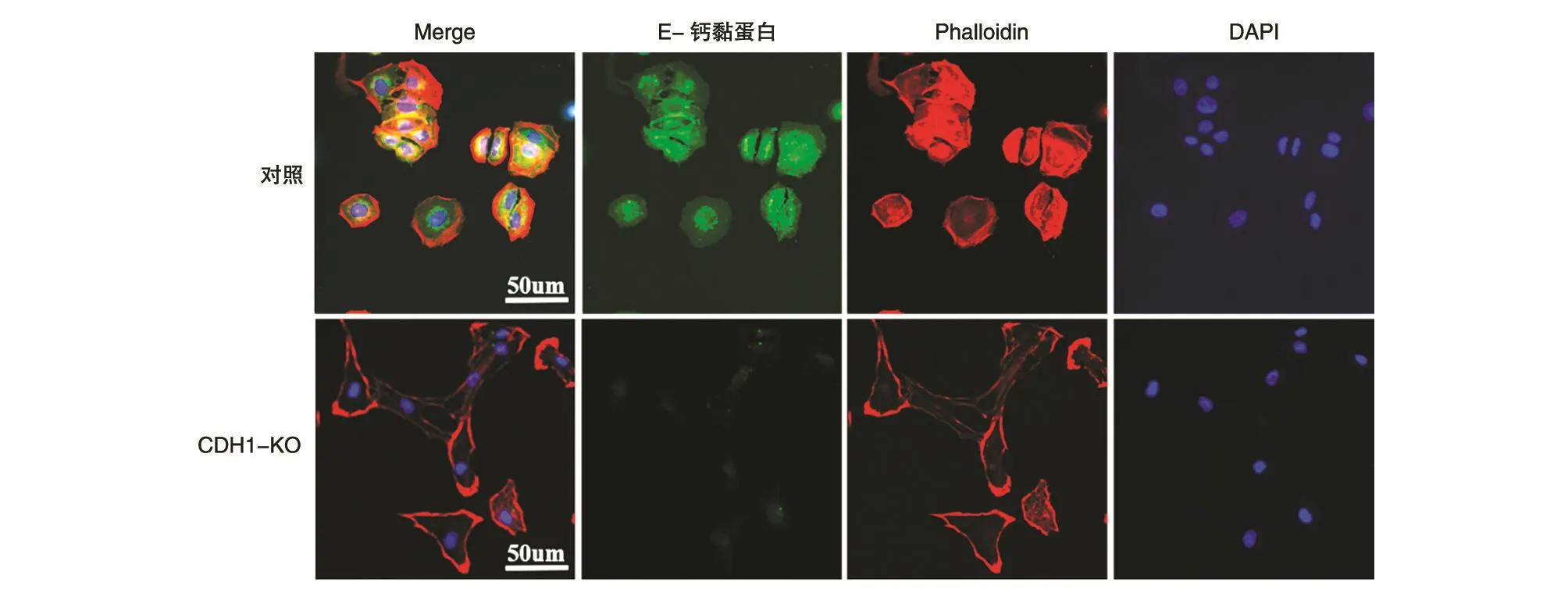
图3 免疫荧光染色观察CDH1敲除的乳腺癌MCF-7细胞中E-钙黏蛋白的表达分布
自2012年首次证明CRISPR/Cas9可以在体外进行DNA切割试验以来,该技术在基因编辑研究中获得了迅速的发展[19],已被广泛用于基因编辑、转录调控、核酸成像和诊断等方面,其多样性、高效和模块化正推动着生物技术革命进程[19-20]。在抗肿瘤免疫治疗研究中,可以通过CRISPR/Cas9技术靶向敲除肿瘤免疫检查点分子或者进行高效的多基因修饰,显著降低了抗肿瘤免疫治疗的技术难度和可操作性[21]。
综上所述,我们采用CRISPR/Cas9技术构建了CDH1基因敲除的稳定细胞系,为深入研究E-钙黏蛋白在肿瘤免疫治疗中的作用及相应机制奠定了实验基础。

