人磷酸葡萄糖变位酶5对肝癌细胞生长和迁移的影响
冉芳,施亚娇,罗沙柳,刘婕,张亚楠,丁丽华,叶棋浓
1.贵州大学 医学院,贵州 贵阳 550025;2.军事医学研究院 生物工程研究所,北京 100850
磷酸葡萄糖变位酶5(phosphoglucomutase 5,PGM5)又称针蛋白(aciculin)或磷酸葡萄糖变位酶相关蛋白(phosphoglucomutase-related protein,PGM-RP),是一种含有567个氨基酸残基的蛋白,属于磷酸葡萄糖变位酶(phosphoglucomutase,PGM)家族,是葡萄糖代谢及糖原代谢过程中的关键酶,可以催化葡萄糖-1-磷酸(G-1-P)和葡萄糖-6-磷酸(G-6-P)的双向转化。一方面,PGM5催化糖原分解代谢产生的G-1-P转化为糖酵解过程的第一个中间产物G-6-P;另一方面,PGM5也促进G-6-P转化为G-1-P,生成合成尿苷二磷酸葡萄糖的底物,该底物是合成多种细胞成分(如糖蛋白)所必需的[1]。1994年,PGM5从人子宫平滑肌中被分离出来,因其氨基酸序列、结构及免疫学特性与PGM1高度相似,因此认为其可能是PGM家族的新成员[2]。1995年Edwards等利用32P标记的PGM1 cDNA的特定基因组文库探针发现了一个与PGM1高度同源的序列,又与其他PGM家族成员有明显区别,因此将其正式命名为PGM5[3],并发现其定位于人类9号染色体(9q21.11)着丝点区域。
PGM5在细胞中分布于正常骨骼肌纤维细胞外周,细胞与细胞、细胞与基质的连接处[2,4];在组织中,主要在肌肉组织中集中表达,如平滑肌、骨骼肌和心肌等[5]。过去的20年里,由于PGM5特殊的分布,关于PGM5的研究主要聚焦于其在肌肉组织中的作用。PGM5分布在细胞与细胞、细胞与基质之间,参与介导或调节细胞粘附[4-5];它与肌营养不良蛋白和抗肌萎缩蛋白相关蛋白相互作用[4,6-8],在细胞骨架维护中发挥作用;PGM5是细丝蛋白C、Xin-肌动蛋白结合重复蛋白B的结合伙伴,细丝蛋白C与PGM5的N端结合,而Xin-肌动蛋白结合重复蛋白B与PGM5的C端相互作用,二者竞争结合,参与肌原纤维的形成、维持和重塑[9]。也有研究发现它的染色体融合位点离端粒位置很近,可能会影响端粒的功能[10-11]。对PGM5在肿瘤中的表达及作用的研究较少,近年才有研究发现PGM5与肿瘤的发生发展有关。对肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库的临床样本分析发现,PGM5在肝癌[12]、结直肠癌[13]中表达下调,与患者预后不良有关;PGM5抑制结直肠癌的生长、迁移和侵袭[13]。但PGM5在肝癌细胞系中的生物学功能未见报道。本研究中,我们拟构建人PGM5基因的真核表达载体,探讨PGM5对肝癌细胞生长、迁移的影响,为进一步研究PGM5在癌症发生发展中的功能奠定基础。
1 材料与方法
1.1 材料
人胚肾293T细胞、肝癌HepG2细胞、pcDNA3.0-Flag载体、人乳腺文库(本实验室保存);限制性内切酶、PCR试剂、DNA连接酶(TaKaRa公司);质粒提取试剂盒(Promega公司);胶回收和PCR回收试剂盒(康为世纪生物科技有限公司);转染试剂VigoFect(威格拉斯生物技术有限公司);DMEM培养基和胎牛血清(Gibco公司);辣根过氧化物酶偶联的Flag抗体(Sigma公司),辣根过氧化物酶偶联的β-actin(SantaCruz公司);大肠杆菌DH5α感受态细胞购买、引物合成及质粒测序(北京博迈德生物技术有限责任公司)。
1.2 pcDNA3.0-Flag-PGM5重组质粒的构建
根据NCBI网站PGM5的编码序列设计并合成上游引物(5'-GGGGTACCATGGAGGGGAGCCC CATCCCGGTGCT-3')和下游引物(5'-GCTCTAGA TCAGGTGATGACAGTGGGTCCCCTCCGG-3'),上、下游引物5'端分别携带KpnⅠ和XbaⅠ酶切位点。以人乳腺文库为模板扩增PGM5基因(95℃预变性5 min,95℃变性30 s,65℃退火30 s,72℃延伸2 min,30个循环,72℃再延伸 5 min),PCR产物用胶回收试剂盒回收,回收的PCR产物和载体pcDNA3.0-Flag分别经KpnⅠ和XbaⅠ双酶切,4 h后回收酶切目的片段和载体,将二者用T4DNA连接酶于16℃连接4 h,连接产物转化大肠杆菌DH5α感受态细胞,涂布于含氨苄西林的LB琼脂板,培养16 h后挑取部分菌落进行菌液PCR,选取阳性克隆菌液转入含氨苄西林的LB液体培养基中,37℃、200 r/min摇床培养12 h,提取质粒,双酶切鉴定,阳性克隆送公司测序。
1.3 转染293T细胞
接种适量293T细胞于6孔板中,至转染时细胞密度40%~60%为宜,培养24 h,转染时提前1 h换液。按照VigoFect转染试剂说明,将空载体和pcDNA3.0-Flag-PGM5质粒分别转染293T细胞。取总量 4 μg的质粒加入 NaCl补足至 100 μL 混匀,再将 2 μL VigoFect试剂与 98 μL NaCl混匀,分别静置5 min,将两者混合制成转染工作液,室温静置15 min,加入293T细胞中,轻轻混匀培养液,37℃、5%CO2常规培养,4~6 h后换液,24 h后收取细胞。
1.4 Western印迹
收集细胞沉淀,加入等量细胞裂解液混匀,冰上裂解30 min,再加入等量2×SDS上样缓冲液,沸水煮样15 min,12 000 r/min离心5 min,取上清液进行SDS-PAGE,电泳结束后,电转移至硝酸纤维素膜上,用5%脱脂奶粉封闭1 h,加入用5%脱脂奶粉以1∶3000稀释的Flag-HRP和β-actin-HRP抗体,室温孵育2 h,TBST洗膜3次,5 min/次,化学发光法显色45 s,压片显影。
1.5 CCK8细胞生长曲线
将空载体和pcDNA3.0-Flag-PGM5分别转染HepG2细胞,培养 24 h后,将细胞以3×103/孔的密度接种于96孔板,每组设3个平行孔。每天同一时间点向各孔加入含10%CCK8试剂的DMEM,37℃、5%CO2培养1 h,取出后用酶联免疫检测仪测定D450nm值。
1.6 细胞划痕实验
接种细胞于6孔板,将空载体和pcDNA3.0-Flag-PGM5分别转染HepG2细胞,培养24 h后,每组用小枪头在融合的单层细胞上划3条直线,PBS洗细胞3次,去除死细胞,换成新鲜的低血清培养基,在划痕处分别选上、中、下三点在显微镜下拍照,记录初始位置,24 h后在初始位置再次拍照。用ImageJ软件计算划痕愈合面积。
1.7 数据分析
采用SPSS 22.0和GraphPad Prism 7.0软件进行统计分析。2组之间数据比较采用非配对独立t检验,不同时间点PGM5对肝癌细胞生长的影响用重复测量资料方差分析(ANOVA)。所有实验均独立重复3次,数据以x±s表示,P<0.05被认为差异具有统计学意义。
2 结果
2.1 pcDNA3.0-Flag-PGM5过表达载体的构建与鉴定
以人乳腺文库为模板扩增PGM5基因,获得约1704 bp的目的片段(图1),与预期大小一致。目的片段酶切后插入pcDNA3.0-Flag载体,构成重组质粒。选取2个菌液PCR鉴定为阳性的克隆,提取质粒进行双酶切鉴定,在1500~2000 bp处可见特异性条带,而空载体则无此条带,初步证明其为阳性克隆(图2A)。将酶切鉴定的阳性克隆测序,测序结果表明插入片段序列与人PGM5基因的编码序列相同(图2B,显示部分测序结果)。
2.2 验证pcDNA3.0-Flag-PGM5介导的PGM5的表达
分别将空载体和pcDNA3.0-Flag-PGM5质粒转染293T细胞,24 h后收取细胞蛋白,Western印迹检测其表达情况。结果显示,过表达组在相对分子质量60×103的位置可见特异性条带,而对照组则没有此条带,表明pcDNA3.0-Flag-PGM5能在细胞中介导PGM5表达(图3)。
2.3 pcDNA3.0-Flag-PGM5对肝癌细胞生长的影响
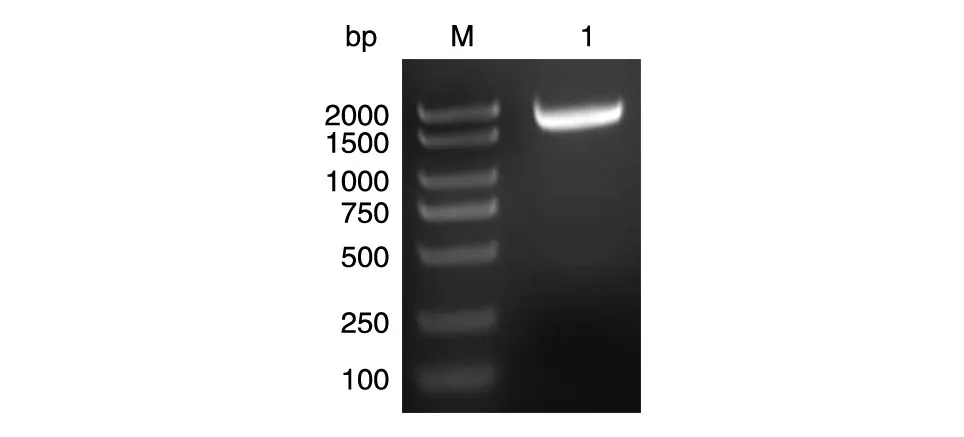
图1 PCR扩增PGM5的编码序列
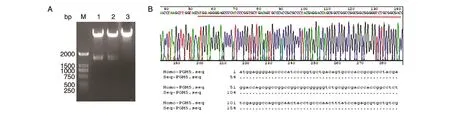
图2 pcDNA3.0-Flag-PGM5质粒鉴定
为了探究PGM5对肝癌细胞生长的影响,分别将空载体和pcDNA3.0-Flag-PGM5质粒转染HepG2细胞,培养24 h后收取一部分细胞进行Western印迹,检测PGM5的表达;另一部分细胞接种于96孔板,待细胞贴壁后,连续6 d于同一时间用CCK8试剂盒检测PGM5表达对细胞生长的影响。结果见图4,与对照组相比,PGM5过表达十分显著地抑制了HepG2细胞的生长。
2.4 pcDNA3.0-Flag-PGM5对肝癌细胞迁移的影响
采用细胞划痕实验研究PGM5对肝癌细胞迁移的影响,设置对照组、PGM5过量表达组,划痕24 h后测量迁移面积。由图5可知,在HepG2细胞中,与对照组相比,PGM5过表达组划痕愈合面积明显较小,表明PGM5抑制了肝癌细胞的迁移。

图3 pcDNA3.0-Flag-PGM5表达鉴定

图4 PGM5对肝癌细胞生长的影响
3 讨论
最初对于PGM5的研究主要集中于其在肌肉组织中的作用。PGM5在肌膜和肌腱交界处集中表达,参与肌原纤维的形成、维持和转换[4,9],PGM5是肌营养不良蛋白的结合伙伴,它与肌营养不良蛋白的N端和C端结合[7],在细胞黏附连接和细胞骨架维护中发挥作用[6,14]。随着对肿瘤研究的逐渐深入,研究者才逐步发现PGM5在肿瘤的发生发展中可能发挥着重要作用。有研究发现透明细胞肾细胞癌中PGM5反义RNA1(PGM5-AS1)表达下调[15]。有学者对TCGA数据库的肝癌临床样本进行分析,发现肝癌组织中PGM5表达低于癌旁正常肝组织,与晚期组织学类型、组织学分级、分期、T分级密切相关[12],且与生存率和总生存期呈正相关[12-13],表明PGM5可以作为一个独立的预后因素。在功能上,PGM5的上调可抑制结直肠癌细胞的增殖、迁移和侵袭,而PGM5的下调则发挥相反的作用[13],提示PGM5是结直肠癌新的肿瘤抑制因子。但PGM5对肝癌细胞生物学功能的影响未见报道,因此我们进一步探究了PGM5对肝癌细胞生长、迁移功能的影响。我们的研究表明,PGM5上调可抑制肝癌细胞的增殖和迁移,提示其是肝癌细胞新的肿瘤抑制因子,与TCGA肝癌临床意义分析结果一致。

图5 PGM5对肝癌细胞迁移的影响
综上所述,我们构建了PGM5表达载体,并发现PGM5具有作为肝癌诊断和预后生物标志物的潜力,同时提示其可能在某些肿瘤中扮演肿瘤抑制因子的作用,为进一步研究其在肿瘤发生、发展、转移机制等方面的作用提供了理论基础。

