HPLC法同时测定地参中3种三萜酸的含量
黄小兰,何旭峰,周 浓,阳文武,杨 勤,王 骞,郭冬琴,*
(1.重庆三峡学院生物与食品工程学院,三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 404100;2.重庆市万州食品药品检验所,重庆 404100;3.重庆三峡医药高等专科学校中医学院,重庆 404100)
地参又名虫草参、地笋,为唇形科植物毛叶地瓜苗(LycopuslucidusTurcz. var.hirtusRegel)的干燥根茎,具有化瘀止血、益气利水之功效,治黄疸,临床上常用于治疗急性黄疸型肝炎、湿热型慢性肝炎[1-2],其地上部分为传统药食同源中药材泽兰,具有活血调经、祛瘀消痈、利水消肿之功效,临床常用于月经不调、经闭、痛经、产后瘀血腹痛、疮痈肿毒、水肿腹水[2]。地参主产于云南、重庆、山东、四川、陕西、河北及东北等地,具有较高的营养保健功能,是药食兼用药用植物,可作为蔬菜食用,其功能与冬虫夏草相似,享有“蔬菜珍品”、“山中之王”等美誉,是我国名贵的中药材之一[3-5]。地参在民间常制作成具有一定保健营养功能的休闲食品,如蜜酥地参、油炸地参、干地参、地参枸杞复合饮料、地参枣茶等[6-7]。因此,在倡导健康饮食潮流的今天,地参作为一种保健蔬菜,在日常食补或疾病康复中扮演着日益重要的角色,与人民健康密切相关。
研究表明,地参主要活性成分为萜类与甾体、酚酸类、黄酮类、挥发油等成分[8-10],具有抗氧化、降血脂、降血糖、增强免疫功能、抗肿瘤、减肥等药理作用[11-14]。前期研究表明,泽兰含有白桦脂酸、齐墩果酸、熊果酸[9,12],而这3种三萜酸具有抗肿瘤、降血糖、降血脂、抗氧化、免疫调节、抗病毒、抗炎、保肝等药理作用[15-18],与地参的药理作用具有一定的关联性,可作为地参品质评价的指标之一。因此,测定地参中白桦脂酸、齐墩果酸、熊果酸具有一定的价值和意义。
目前,对于地参地上部位即泽兰[2]中三萜酸类化合物含量测定的文献多集中在白桦脂酸[19]、熊果酸[20]和齐墩果酸[21]等成分,鲜见同时测定地参中3种三萜酸含量的文献报道。本研究采用高效液相色谱法(HPLC)对不同产地地参中白桦脂酸、齐墩果酸、熊果酸含量进行研究,以期为地参药材的质量标准提高和产品开发利用提供可靠的科学依据。
1 材料与方法
1.1 材料与仪器
地参 自采或委托采集于云南大理州(S1)、广西玉林市(S2)、江苏徐州市(S3)、重庆万州(S4)等4个地参栽培基地,重庆三峡学院生物与食品工程学院周游博士鉴定为唇形科植物毛叶地瓜苗(LycopuslucidusTurcz. var.hirtusRegel)的干燥根茎;白桦脂酸对照品(纯度经HPLC峰面积归一化法计算大于98%) 成都德思特生物技术有限公司;齐墩果酸对照品(纯度经HPLC峰面积归一化法计算大于98%) 成都德思特生物技术有限公司;熊果酸对照品(纯度经HPLC峰面积归一化法计算大于98%) 成都德思特生物技术有限公司;甲醇 色谱纯,迪马科技;三氟乙酸 分析纯,成都科龙试剂化工厂;无水乙醇 色谱纯,成都科龙试剂化工厂。
LC-20AT型高效液相色谱仪 日本岛津公司;Milli-Q Advantage A10超纯水机 美国Millipore公司;Sigma4-16S型高速离心机 德国Sigma公司;IKA MS3型涡旋混合器 德国IKA公司;Sartorius SQP型分析天平 德国Sartorius公司;KH-2000DB型超声波清洗机(功率:2000 W,频率:40 kHz) 昆山禾创超声仪器有限公司。
1.2 实验方法
1.2.1 地参样品中3种三萜酸的提取
1.2.1.1 提取工艺 将干燥的地参根茎粉碎称重,置50 mL离心管中,按比例加入乙醇溶液[22],涡旋30 s,在一定时间和功率下超声提取[21,23],离心转移上清液,用乙醇溶液复提2次,合并提取液,以乙醇溶液定容至刻度,摇匀,过0.22 μm微孔滤膜后,HPLC检测计算白桦脂酸、齐墩果酸和熊果酸的含量。
1.2.1.2 单因素实验 精密称取地参粉末(S1)1.0 g,置100 mL具塞锥形瓶中,固定超声波功率为300 W,提取时间30 min,探究乙醇体积分数(50%、60%、70%、80%、90%、100%)对3种三萜酸提取率的影响;固定提取溶剂为无水乙醇,提取时间30 min,探究超声功率(100、200、300、400 W)对3种三萜酸提取率的影响;固定提取溶剂为无水乙醇,提取功率300 W,探究提取时间(15、30、45、60 min)对3种三萜酸提取率的影响;平行测定3次,研究改变某一因素对地参三萜酸的影响。分别在最佳色谱条件下进样,进行峰面积测定,计算地参中3种三萜酸类化合物的含量。
1.2.2 对照品溶液的制备 分别精密称取减压干燥至恒重的白桦脂酸、齐墩果酸、熊果酸对照品适量,加甲醇溶解并制成质量浓度分别为1.0123、0.9918、0.9918 mg/mL的对照品贮备液,备用。
1.2.3 样品溶液的制备 取地参粉末(过30目筛)1.0 g,精密称量,平行3次,置50 mL离心管中,加无水乙醇15 mL,涡旋30 s,超声提取30 min(超声功率300 W,工作频率40 kHz),4000 r/min离心5 min,取上清液于50 mL棕色容量瓶中,残渣再次加入15 mL无水乙醇复提2次。合并上清液,以无水乙醇定容至刻度,摇匀,过0.22 μm微孔滤膜待测,即得。
1.2.4 色谱条件的优化
1.2.4.1 检测波长的选择 采用二极管阵列检测器分别对3种三萜酸标准溶液在190~400 nm区间段进行扫描,确定3种三萜酸最佳的检测波长。
1.2.4.2 色谱柱的选择 以甲醇-0.03%三氟乙酸水溶液(pH=3.5)作为流动相,在柱温30 ℃,流速0.8 mL/min条件下分别考察含碳量为8.0%、17.0%、27.0%的C18色谱柱对3种三萜酸分离度的影响。
1.2.4.3 流动相体系的选择 在最佳色谱柱条件下,柱温30 ℃,流速0.8 mL/min,以甲醇-水系统为基础,分别用三氟乙酸调节流动相的pH为2.5、3.5、4.5、5.5,考察不同pH对3种三萜酸分离效果的影响。
1.2.4.4 柱温的选择 在最佳色谱柱、pH条件下,流速0.8 mL/min,考察柱温分别在20、25、30、35 ℃时3种三萜酸分离效果。
1.2.4.5 流速的选择 在最佳色谱柱、pH、柱温条件下,考察流速分别为0.6、0.7、0.8、0.9、1.0 mL/min时3种三萜酸分离效果的影响。
1.2.5 方法学考察
1.2.5.1 线性关系、检出限和定量限的考察 分别精密吸取1.2.2项下各对照品贮备液0.025、0.05、0.10、0.20、0.30、0.40、0.50 mL,分别置10 mL容量瓶中,加甲醇稀释至刻度,得到一系列不同质量浓度的3种三萜酸混合对照品溶液,置于4 ℃的冰箱内,临用前以0.22 μm微孔滤膜滤过,按照最佳色谱条件依次进样分析,记录色谱图,以3种三萜酸的保留时间、理论塔板数、拖尾因子和分离度考察方法的系统适用性。以各对照品的峰面积积分值(y)与其相应的质量浓度(x)进行线性回归,绘制标准曲线。检出限(limit of determination,LOD)为3倍信噪比,定量限(limit of quantifification,LOQ)为10倍信噪比,按照信噪比S/N=3和S/N=10确定3种三萜酸的检出限和定量限。
1.2.5.2 精密度试验 取同一混合对照品溶液,连续进样6次,按最佳色谱条件测定各三萜酸的峰面积,分别计算各成分峰面积的相对标准偏差,以考察仪器的精密度。
1.2.5.3 重复性试验 取地参粉末(S4)6份,按1.2.3项下方法制备样品溶液,按最佳色谱条件测定各三萜酸的峰面积,分别计算各成分含量的相对标准偏差,以考察方法的重复性。
1.2.5.4 稳定性试验 取地参供试品溶液(S4),在室温下密闭放置,分别在0、2、4、6、8、12 h按最佳色谱条件测定各三萜酸的峰面积,分别计算各成分含量的相对标准偏差,以考察本样品的稳定性。
1.2.5.5 加样回收率试验 精密称取已知含量的地参粉末(S4)0.50 g,共6份,分别精密加入白桦脂酸、齐墩果酸和熊果酸对照品溶液适量,按1.2.3项下方法制备样品溶液,按最佳色谱条件测定各三萜酸的峰面积,分别计算白桦脂酸、齐墩果酸、熊果酸的加样回收率和相对标准偏差,以验证该方法的准确性。
1.2.6 样品的含量测定 分别取4批地参粉末(过30目筛)1.0 g,精密称量,平行3份,按1.2.3项下方法制备样品溶液,按最佳色谱条件测定并记录色谱图,应用标准曲线法分别计算3种三萜酸的含量。
2 结果与分析
2.1 地参中3种三萜酸的提取条件优化
2.1.1 乙醇体积分数对地参三萜酸提取量的影响 由图1可看出,随着乙醇体积分数的增加,地参中白桦脂酸、熊果酸的含量相应提高,齐墩果酸含量增加趋势不明显,3种总三萜酸含量呈现增加趋势,当提取溶剂为100%乙醇即无水乙醇时,三萜酸总含量最高。因此,本实验选择无水乙醇作为提取溶剂为宜。
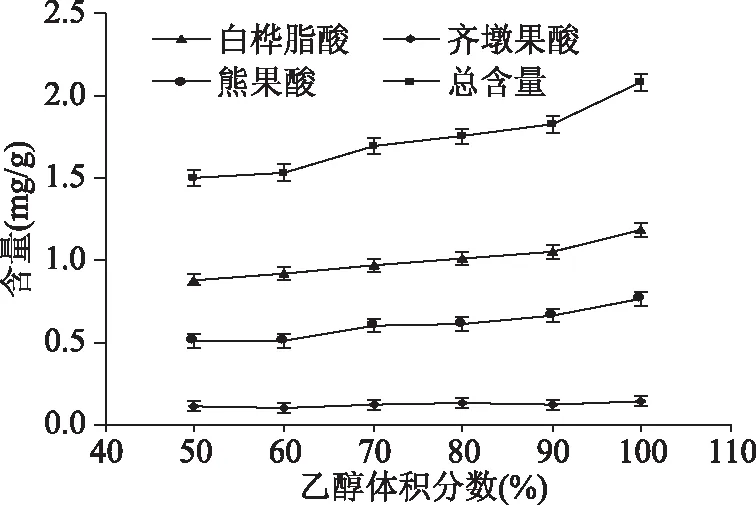
图1 不同的乙醇体积分数对提取效率的影响Fig.1 Effect of different volume fractions ofalcohol on extraction efficiency
2.1.2 超声功率对地参三萜酸提取量的影响 由图2可看出,随着超声功率的增大,地参中白桦脂酸、熊果酸以及总三萜酸含量增加,当超声功率超过300 W时,三萜酸总含量趋于平稳。因此,本实验选择300 W作为提取功率。
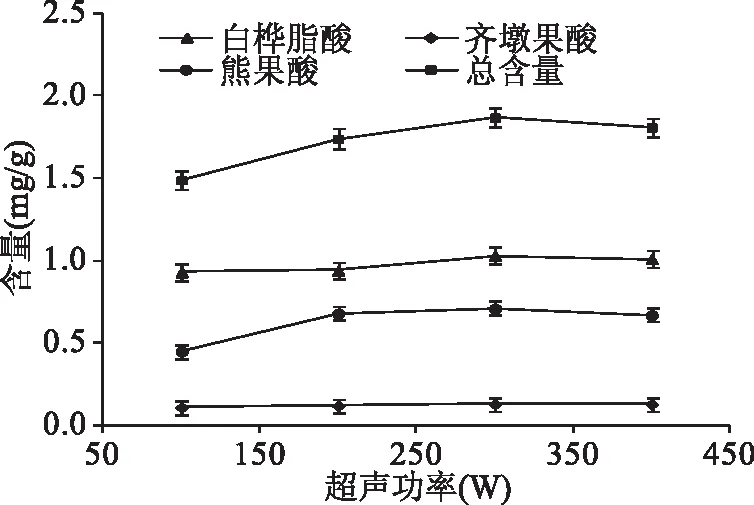
图2 超声功率对提取效率的影响Fig.2 Effect of ultrasonic power on extraction efficiency
2.1.3 提取时间对地参三萜酸提取量的影响 由图3可知,随着提取时间的延长,地参中白桦脂酸、熊果酸以及总三萜酸含量呈现出先增加后减少趋势,当提取时间为30 min时,三萜酸总含量最高。因此,本实验选择提取时间为30 min。
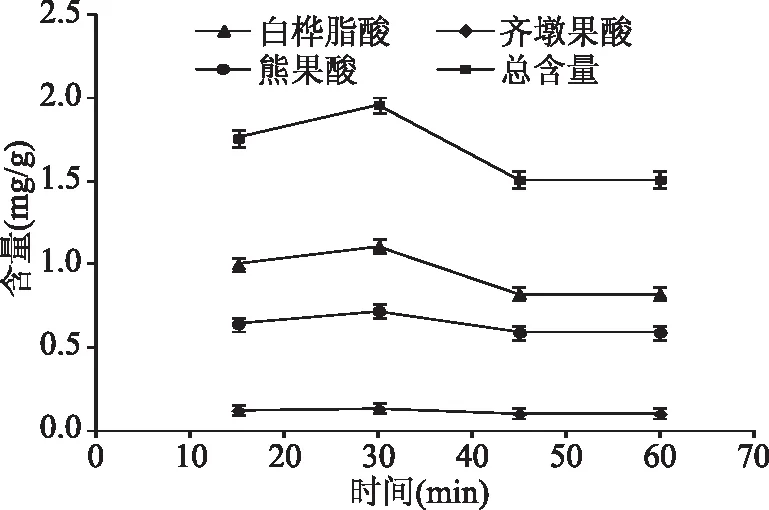
图3 提取时间对提取效率的影响Fig.3 Effect of extraction time on extraction efficiency
2.2 色谱条件的优化
2.2.1 检测波长的确定 通过对白桦脂酸、齐墩果酸和熊果酸标准溶液进行光谱扫描,结果如图4所示,白桦脂酸在204 nm、齐墩果酸和熊果酸在205 nm处有最大吸收峰,考虑到流动相中甲醇的截止波长为205 nm,为了避免干扰[24],本方法确定210 nm为检测波长。
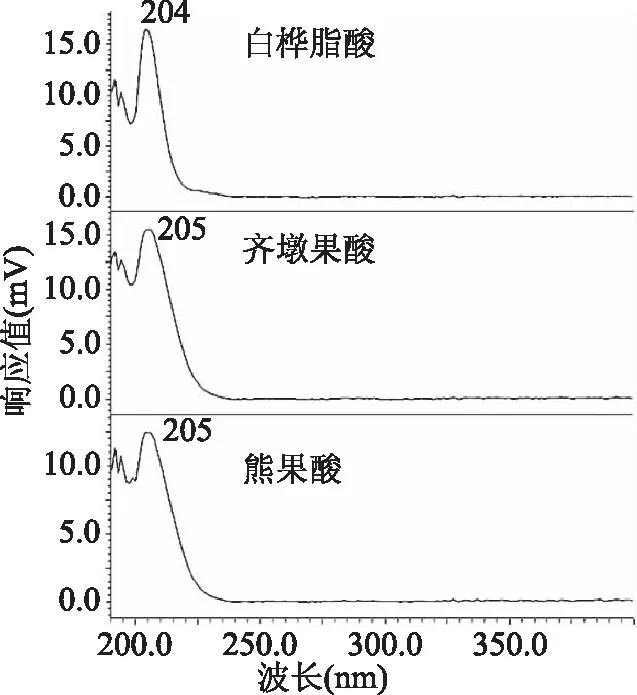
图4 白桦脂酸、齐墩果酸和熊果酸的光谱扫描图Fig.4 The diode array scanning spectrogram ofbetulinic acid,oleanolic acid and ursolic acid
2.2.2 色谱柱的选择 由于被测物质白桦脂酸、齐墩果酸和熊果酸的分子量相当、结构相似、极性差异小、存在同分异构体,比较适合在酸性条件下使用高惰性、全封端的C18色谱柱分析。由图5可知,通过比较不同含碳量的C18色谱柱对分离度的影响,结果表明含碳量为27.0%的色谱柱Diamonsil C18(2)(5 μm,4.6 mm×250 mm)对3种三萜酸化合物具有良好的分离效果,特别是齐墩果酸和熊果酸分离度能达到1.60以上,且色谱柱Diamonsil C18(2)适用于更宽的pH范围(1.5~9.0),耐酸性较强,更有利于3种三萜酸化合物的分离。因此,最终选择本实验室的Diamonsil C18(2)(5 μm,4.6 mm×250 mm)色谱柱,且通过实验验证Diamonsil C18(2)色谱柱的稳定性和重复性较好。
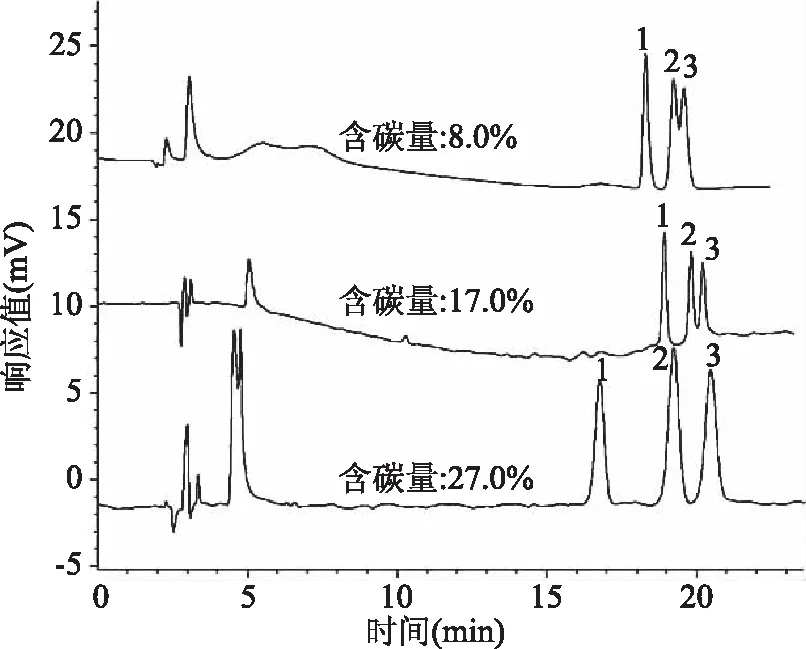
图5 不同含碳量的C18色谱柱对分离效果的影响Fig.5 Effect of C18 column with differentcarbon content on separation result注:1.白桦脂酸;2.齐墩果酸;3.熊果酸;图6、图7同。
2.2.3 流动相体系的选择 由于三萜酸类化合物在水中发生弱电离,呈弱酸性,以甲醇-水为流动相反相分离白桦脂酸、齐墩果酸、熊果酸时,弱酸环境有利于3种物质的分离分析。因此,水溶液的pH和甲醇比例是重要的影响因素[24-25]。由图6可知,当用三氟乙酸将pH调至2.5~3.5时,目标物均能实现峰形尖锐对称且分离效果良好,但pH=2.5时,基线更加平稳,保留时间适中。本方法同时还考察了流动相的比例,结果显示选择甲醇∶三氟乙酸水溶液(pH=2.5)=89∶11 (v∶v)作为流动相效果最佳。
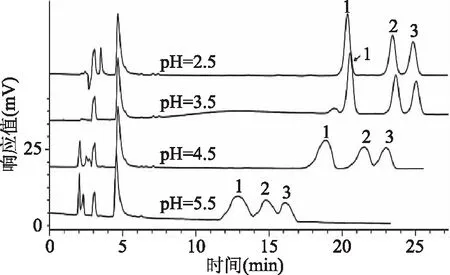
图6 不同pH对峰形和分离效果的影响Fig.6 Effects of different pH valueson peak shape and separation result
2.2.4 柱温的选择 通过比较不同柱温对白桦脂酸、齐墩果酸和熊果酸分离度的影响发现:柱温在20 ℃时,白桦脂酸、齐墩果酸和熊果酸的分离度分别为4.67、4.21、1.88;25 ℃时为4.61、4.08、1.84;30 ℃时为4.14、4.01、1.61;35 ℃时为4.05、3.51、1.43。虽然柱温在20~30 ℃范围内均能实现良好分离,分离度大于1.50,但温度过低会造成系统压力过高,灵敏度下降。本试验选择25 ℃为最终柱温。
2.2.5 流速的选择 通过比较不同流速对齐墩果酸和熊果酸分离度的影响,结果显示:随着流速的降低齐墩果酸和熊果酸的分离度有所提高,但太低会导致峰形不够尖锐,检测灵敏度降低,且延长了分析时间,流速过高不利于齐墩果酸和熊果酸的分离。因此,本试验选择0.8 mL/min为最终流速。
2.3 混合对照品和样品的HPLC色谱测定结果
由图7可见,3种三萜酸能有效分离,峰形良好,且杂质干扰少,混合对照品中白桦脂酸、齐墩果酸、熊果酸的保留时间分别为22.636、26.098、27.529 min;理论塔板数分别为13570、14186、14457,拖尾因子分别为1.009、0.952、0.987;分离度分别为4.61、4.08、1.84。样品中白桦脂酸、齐墩果酸、熊果酸的理论塔板数分别为10619、10838、10760,拖尾因子分别为1.000、0.996、0.958,分离度分别为3.83、3.60、1.62。结果表明,3种三萜酸异构体色谱峰拖尾因子在0.95~1.05,与相邻色谱峰的分离度均大于1.50,各峰的理论塔板数均大于10000,系统适应性良好。
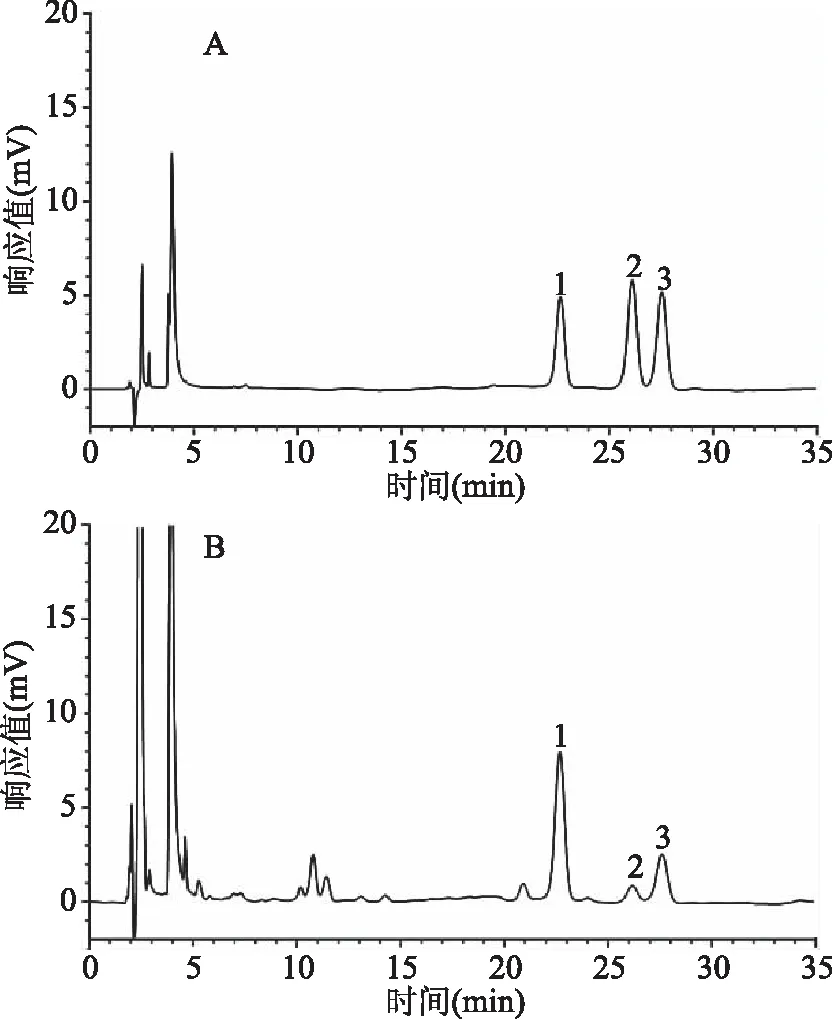
图7 混合对照品(A)、地参样品(B)的HPLC图Fig.7 The HPLC chromatogram of mixed reference substance(A),and sample of Lycopus lucidus Turcz. var. hirtus Regel(B)
分别以白桦脂酸、齐墩果酸和熊果酸峰面积积分值(y)与其相应的质量浓度(x)进行线性回归,得回归方程,相关系数(r)、线性范围、检出限(LOD)和定量限(LOQ),由表1可知:白桦脂酸、齐墩果酸、熊果酸分别在各自质量浓度范围内呈良好的线性关系,相关系数均大于0.9999;检出限为5~7 ng,定量限为16~22 ng,表明方法线性范围宽,仪器灵敏度高。

表1 3种三萜酸化合物的回归方程、相关系数、线性范围、检出限和定量限Table 1 Regression equation,correlation coefficient,linear range,limit of detection(LOD)and limit of quantification(LOQ)of three triterpenic acids by HPLC
2.5 精密度
白桦脂酸、齐墩果酸、熊果酸的平均峰面积(n=6)分别为151035、225848、212479,RSD分别为0.15%、0.34%、0.34%,表明高效液相色谱仪精密度良好。
2.6 重复性
地参(S4)中白桦脂酸、齐墩果酸、熊果酸的平均含量(n=6)分别为1.684、0.312、0.750 mg/g,RSD分别为0.62%、1.79%、0.60%,表明此实验方法的重复性较好。
2.7 稳定性
地参(S4)中白桦脂酸、齐墩果酸和熊果酸平均含量(n=6)分别为1.690、0.310、0.750 mg/g,RSD分别为0.95%、2.77%、1.93%,表明供试品溶液至少在12 h内稳定性良好。
2.8 加样回收率
地参中白桦脂酸、齐墩果酸和熊果酸的平均回收率在100.52%~103.77%范围内,RSD在0.99%~2.42%范围内,符合分析要求,结果见表2。表明上述实验方法具有较高的回收率和准确度,能应用于地参中三萜酸化合物的检测与分析。
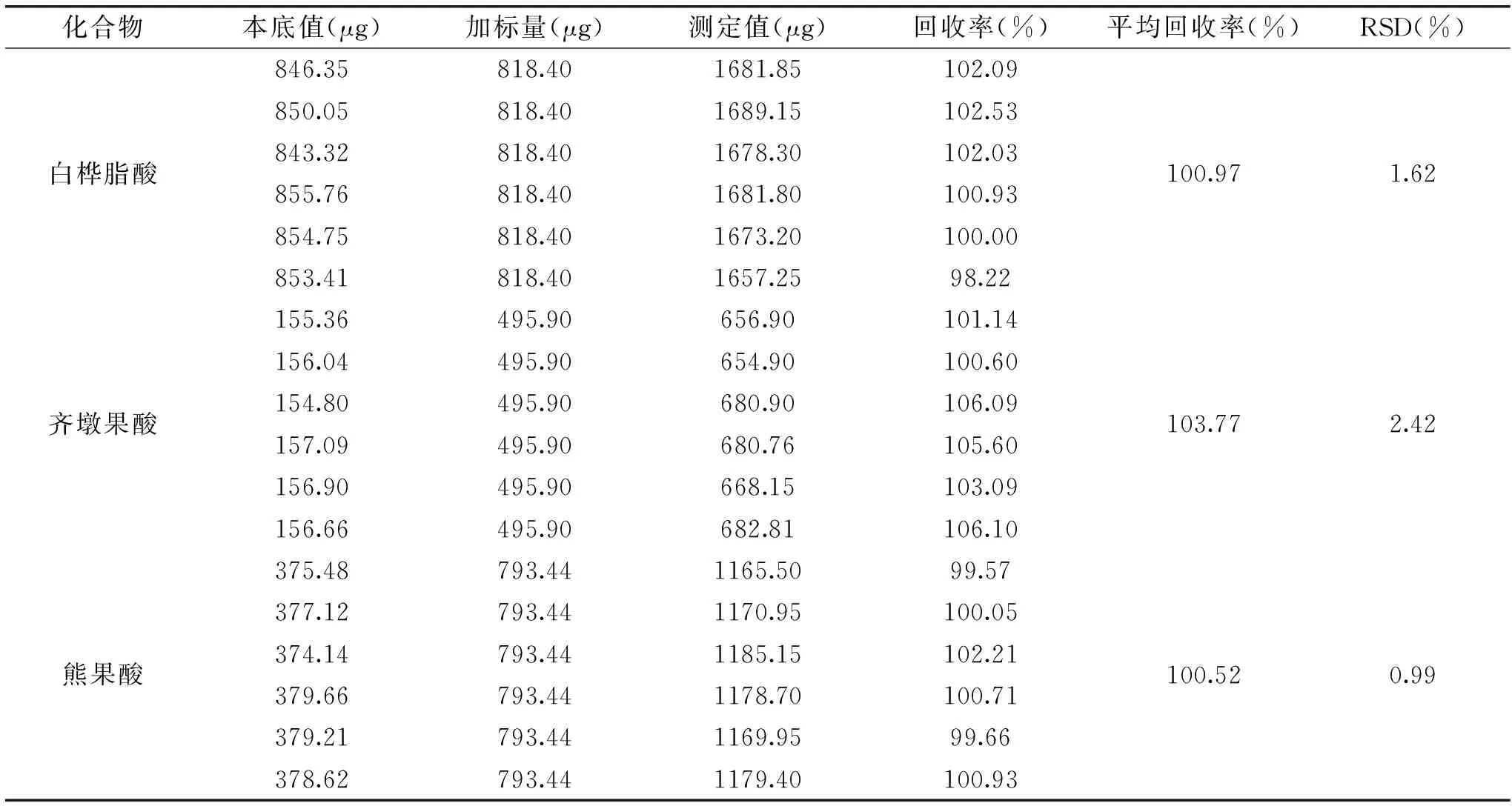
表2 加样回收率实验结果(n=6)Table 2 Average recoveries of three triterpenic acids(n=6)
2.9 地参中三萜酸类化合物含量
按标准曲线法定量,分别计算地参药材中白桦脂酸、齐墩果酸、熊果酸的含量,结果见表3。
表3 不同产地地参中3种三萜酸类成分测定结果Table 3 The content of three triterpenic acids in the
结果表明:4个不同产地地参均含有丰富的白桦脂酸、齐墩果酸、熊果酸,3种三萜酸含量由高到低排序为:白桦脂酸>熊果酸>齐墩果酸,白桦脂酸是其主要活性成分,其含量较高,占到总量的60%以上,这与泽兰[19-21]中3种三萜酸成分的研究结果类似。
不同产地地参中白桦脂酸、齐墩果酸、熊果酸含量存在一定的差异,其中重庆万州、广西玉林的3种三萜酸含量较高,江苏徐州、云南大理的3种三萜酸含量较低;广西玉林(S1)、云南大理(S2)、重庆万州(S3)、江苏徐州(S4)等4个产地地参中白桦脂酸、齐墩果酸、熊果酸3种三萜酸内在的结构比(即成分间量的比)[26]分别为1.000∶0.083∶0.289、1.000∶0.098∶0.350、1.000∶0.183∶0.444、1.000∶0.117∶0.221,平均结构比为1.000∶0.120∶0.326。结果显示同一品种地参药材因产地不同其三萜酸类成分量及结构比均具有一定差异,并没有明显的规律,这与黄瑜等[26]对小根蒜中核苷类含量的研究结果相一致。
3 结论
地参是我国特有的有着诸多独特性的民族民间药材,资源丰富、市场商品价格低,极具开发价值。本研究建立了同时检测地参中白桦脂酸、齐墩果酸、熊果酸含量的HPLC法。通过单因素实验,采用超声波辅助无水乙醇提取地参中的三萜酸,超声功率为300 W,提取时间为30 min,三萜酸的提取含量可达到2 mg/g以上。通过优化,得到最佳色谱条件:色谱柱为含碳量27.0%的Diamonsil C18(2)(5 μm,4.6 mm×250 mm);流动相为甲醇-0.03%三氟乙酸水溶液(pH=2.5)(89∶11,v∶v);检测波长为210 nm;体积流量为0.8 mL/min;进样量20 μL;柱温25 ℃。利用建立的方法对4组地参样品进行HPLC分析,结果显示:不同产地的地参均含有白桦脂酸、齐墩果酸和熊果酸,其中白桦脂酸含量最高占60%以上。
本研究建立的方法前处理简单,专属性强、定量准确、线性关系良好,精密度、稳定性、加样回收率符合要求,可用于准确测定地参中三萜酸类成分的含量,适用于地参药材、饮片及其休闲食品生产过程的品质控制指标,为地参药材资源在保健食品方面的应用提供新的理论依据。

