3种淀粉与大蒜中大蒜素所形成包合物的特征及其抑菌活性研究
张黎明,彭巧玲,金雪芹,闫鹏超,何希宏,郝利民,,*,刘 阳,鲁吉珂
(1.天津科技大学,工业发酵微生物教育部重点实验室,天津 300457;2.军事科学院军需工程技术研究所,北京 100010;3.郑州大学生命科学学院,河南郑州 450001)
淀粉是一种广泛存在于小麦、玉米、薯类等植物中的多糖类化合物,根据分子链上脱水葡萄糖单元的连接方式可分为直链淀粉和支链淀粉。在一定条件下,直链淀粉可以被一些疏水性分子诱导形成左手单螺旋结构,即V型结构[1-3]。这种螺旋结构外部由淀粉羟基组成,内部由葡萄糖骨架组成,其内径大约0.54~0.85 nm,外径1.36~1.62 nm[1]。客体分子进入螺旋结构内部,通过疏水作用结合形成包合物[2]。具有疏水性的风味物质分子与直链淀粉的这种包结络合作用(Complexiation)相当于将风味物质微胶囊化[3]。
近年来,由于淀粉具有价格低廉、来源广泛且实用性较强等优点,使淀粉对风味物质的微胶囊化成为研究热点。不同的淀粉因其直链淀粉的含量和结构不同而表现出不同的包结络合作用,常用来包合风味物质的淀粉有玉米淀粉[4]、马铃薯淀粉[5-6]、木薯淀粉[1]、大米淀粉[6]等。影响淀粉与风味物质包埋效果的因素主要有:直链淀粉含量(最主要因素)[4,6]、淀粉分子的聚合度[7]、淀粉来源[1]、糊化特性[6]、颗粒大小形态等[8]。例如Gelders等[7]采用不同链长的直链淀粉与脂质分子进行包埋处理,发现淀粉聚合度越高,与客体分子包埋效果越好;Jouquand等[8]研究了马铃薯淀粉和玉米淀粉对C6芳香化合物的包埋特性,结果发现马铃薯淀粉较玉米淀粉具有更好的包埋效率。
大蒜素(Allicin)是多年草本生葱属植物大蒜(AlliumsavitumL.)在细胞组织遭外界破损时,细胞中的蒜氨酸经酶解产生的[9],是大蒜的主要的风味物质,也是主要的活性物质,具有杀菌力强、抗菌谱广,对大肠杆菌、沙门氏菌等病原菌有显著的抑制或杀灭作用,被誉为“天然广谱植物抗菌素”。因此,有关大蒜素制剂的研究愈来愈引起人们的重视,成为研究的热点[10]。但由于其热稳定性差,通常在大蒜深加工过程中将其微胶囊化以掩蔽其气味增加其稳定性[11-13]。如潘艳等[11]采用绿豆分离蛋白为壁材,利用喷雾干燥法制备大蒜素微胶囊,实际包埋率可高达93.4%。Piletti 等[12]以β-环糊精为壁材制备了大蒜油微胶囊,实验表明该大蒜油微胶囊的热稳定性得到了改善。辛露露等[13]以大蒜素为模型药物,采用复凝聚法制备了海藻酸钠/明胶/壳聚糖复合微球,载药量最高为24.3%,包埋率最高为69.4%。这些制备方法的缺点是大蒜油和大蒜素的前期提取工艺较为复杂,成本高,且所得成分不稳定。天然淀粉来源广泛,价格低廉,是作为大蒜素微胶囊化的理想壁材,因此,本文选用玉米淀粉、马铃薯淀粉和高直链玉米淀粉分别作为包埋壁材,新鲜大蒜中所生成的大蒜素为客体分子,采用常温高速剪切混合法制备了淀粉大蒜素包合物,考察这3种淀粉对大蒜中的大蒜素的原位包结络合特性,以及所制备的包含物的理化性质和抗菌活性。
1 材料与方法
1.1 材料与仪器
新鲜大蒜 水分含量63.51%±3.62%,河南省开封市杞县;玉米淀粉 直链淀粉含量28.21%±0.56%,天津市中英保健食品有限公司;马铃薯淀粉 直链淀粉含量12.38%±0.78%, 天津市中英保健食品有限公司;高直链玉米淀粉 直链淀粉含量68.11%±1.52%,郑州亿之源化工产品有限公司;大蒜素标准品 CAS:10084,C6H10S6,纯度≥98%,中国药品生物制品鉴定所;甲醇 色谱纯,德国默克公司;蛋白胨、酵母浸膏、琼脂粉 北京索莱宝生物科技公司;其余试剂 均为分析纯;大肠杆菌(Escherichiacoli,G-)、金黄色葡萄球菌(Staphylococcusaureus,G+)、枯草芽孢杆菌(Bacillussubtilis,G+)、沙门氏菌(SalmonellaTyphimurium,G-) 天津科技大学微生物实验室。
PB12Power311型高速剪切搅拌机 广东美的电器股份有限公司;Alpha 2-4 LD plus型冷冻干燥机 德国Martin Christ有限公司;1260型高效液相色谱仪 安捷伦科技有限公司;PhiLips XL-30型扫描电子显微镜 荷兰皇家飞利浦电子公司;Pyris/Diamond TG/DTA 500型热重分析仪 美国珀金埃尔默仪器有限公司;TU-1810PC紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 淀粉大蒜素包合物的制备条件筛选
1.2.1.1 高速剪切搅拌处理时间筛选 称取原淀粉样品100.0 g,置于高速剪切混合仪的容器中,再加入新鲜大蒜(筛选无霉变、无发芽的大蒜鳞茎,去除蒜梗、须根及外层鳞皮,得新鲜蒜瓣,按干基质量称取100.0 g)和100 mL蒸馏水。然后在22500 r/min转速下对混合样品进行高速剪切混合处理至预定时间(20、30、40、50、60和70 min)。将所得混合浆液转移到培养皿中,真空冷冻干燥12 h后得到干燥产物。将该产物研磨过100目筛,再用无水乙醇洗涤3次,以除去未被包合的大蒜素,再在35 ℃下真空干燥12 h后得到不同处理时间的淀粉-大蒜素包合物。
1.2.1.2 淀粉/大蒜(干基)质量比的筛选 称取原淀粉样品100.0 g,置于高速剪切混合仪的容器中,按照淀粉/大蒜(干基)质量比2∶1、1∶1、1∶2、1∶3、1∶6加入新鲜大蒜和适量的蒸馏水,使总体积达500 mL。然后在22500 r/min的转速下对混合样品进行高速剪切混合搅拌处理60 min。将所得混合浆液转移到培养皿中,在35 ℃下真空干燥12 h后得到干燥产物。其余步骤同高速剪切搅拌处理时间筛选,得到不同淀粉/大蒜(干基)质量比制备的淀粉-大蒜素包合物。
1.2.2 样品的制备 分别称取原淀粉、新鲜大蒜各200.0 g以及淀粉/大蒜(干基)质量比1∶2,置于高速剪切混合仪的容器中,加入适量的蒸馏水,然后在22500 r/min的转速下对样品进行高速剪切混合搅拌处理60 min。将所得悬浮液转移到培养皿中,在35 ℃下真空干燥12 h并研磨过100目筛后得到淀粉对照、大蒜粉(GP)和包合物。按淀粉/大蒜(干基)质量比称取淀粉对照和大蒜粉(总质量为20.00 g),置于250 mL的三角瓶中,在振荡器上振荡15 min得到物理混合物。
1.2.3 HPLC法测定淀粉-大蒜素包合物中大蒜素的含量 淀粉-大蒜素包合物中大蒜素的含量测定参考李齐欢等[14]报道的HPLC法,并作适当修改。具体操作如下:精密称取500.0 mg样品,加入25 mL离心管中,加入10.0 mL甲醇,密封,涡旋混匀,于25 ℃下超声处理1 h,然后在4 ℃,10000 r/min的条件下离心分离5 min。将上述上清液过0.22 μm滤膜,然后用HPLC分析仪测定。色谱条件:Agilent ZORBAX Eclipse Plus C18硅胶色谱柱(5 μm,4.6×250 mm);流动相:甲醇/水/甲酸=80/20/0.1;流速0.8 mL/min;柱温25 ℃;进样量20 μL;波长254 nm;线性范围:在浓度范围6.92~173 μg/mL内,峰面积(A)与大蒜素质量浓度(C)的线性关系良好,其回归方程为A=13.84C+64.24,决定系数R2=0.9998。大蒜素含量通过下式计算:
式中:Ac:大蒜素含量,μg/mg;C:质量浓度(μg/mL),V:供试样品溶液体积(mL),M:供试样品质量(mg)。
1.2.4 淀粉-大蒜素包合物的理化性质分析
1.2.4.1 碘结合特性实验 碘结合特性实验参照万芊[15]描述的方法,并稍有改动。具体操作如下:精密称取淀粉对照(10.00 mg)和大蒜粉(10.00 mg),淀粉-大蒜素包含物(使样品中淀粉的质量分数为10.00 mg)。将所有样品置于比色管中,加入1.00 mol/mL的NaOH溶液5.00 mL,然后在100 ℃水浴锅中加热,使淀粉颗粒充分溶胀,悬浮液在0.5 kHz超声波频率下超声5 min后得到样品溶液。待样品溶液冷却至室温后,用稀盐酸HCl溶液调pH到3.5,再加入0.50 mL碘试剂(2% KI+0.2% I2溶液)显色1 min。再将显色液转至50 mL容量瓶中,用去离子水定容。用紫外-可见光分光光度计在450~900 nm的波长范围内对所有显色液进行吸光度扫描。
1.2.4.2 扫描电镜分析 将原淀粉(CS、PS、HAMS)、淀粉对照和淀粉-大蒜素包合物样品固定在SEM样品板上,用毛细管将恒温干燥后的样品转移置导电胶上,去除板面上多余样品,喷金观察。仪器加速电压20 kV,放大2000倍。
1.2.4.3 X射线衍射分析 将原淀粉(CS、PS、HAMS)、淀粉对照、大蒜粉和淀粉-大蒜素包合物样品置于长方形铝片的孔中,随后压紧,用X射线衍射仪按以下方法进行测定:所用波长为0.1542 nm的单色Cu-Kα射线。测试条件为:管压3 kV,管流20 mA,扫描速度4 °/min,扫描区域3~60 °。
1.2.4.4 热重分析 将原淀粉、大蒜粉、物理混合物及淀粉-大蒜素包合物等在35 ℃真空干燥箱中干燥24 h待用。精确称取10~12 mg样品置于铂金坩埚中,按起始温度20 ℃,终止温度600 ℃,升温速率10 ℃/min,氮气流速40 mL/min进样分析。
1.2.5 淀粉-大蒜素包合物的抑菌活性评价 淀粉-大蒜素包合物的抑菌活性测定参考谭才邓等[16]报道的打孔琼脂扩散法,并稍作改动。将淀粉-大蒜素包合物,大蒜粉、淀粉对照于120 ℃条件下干热灭菌20 min,灭菌后冷却备用。量取预先制备好的含菌量为1×106CFU菌悬液50 μL置于培养皿中,趁热倒入50 ℃未凝固的琼脂培养基并混合均匀,冷却凝固后,用打孔器在固体培养基中央打一个直径为1 cm的孔,加入0.10 g无菌样品粉末和100 μL 0.9%的生理盐水,使样品粉末吸附在培养基上,将培养皿放置在37 ℃恒温培养箱中培养1 h,之后倒置培养24 h,观察抑菌情况,并用游标卡尺测量抑菌圈的直径,重复3次,取平均值。用抑菌圈直径大小评价样品的抑菌性能。
1.3 数据处理
数据均为3次重复试验平均值,以平均值±标准误差表示。采用SPSS 19.0软件进行统计学分析,显著性检验采用邓肯氏(Duncan)多重比较,P<0.05为差异显著。
2 结果与分析
2.1 制备条件对淀粉-大蒜素包合物中大蒜素含量的影响
2.1.1 高速剪切混合处理时间 高速剪切混合处理时间对包合物中大蒜素含量的影响结果如图1所示。由图1可以看出,包合物中大蒜素含量随着处理时间的延长表现为先增加后缓慢降低的趋势,包合物中大蒜素含量最高时,CS-A、PS-A和HAMS-A的处理时间分别为40、60、40 min。3种包合物中大蒜素含量高低次序为HAMS-A>PS-A>CS-A。大蒜在高速剪切作用力下随着时间延长,细胞壁被打破,大蒜中的蒜氨酸在相关酶的作用下生成了大蒜素和其他含硫化合物[9]。在此过程中诱导直链淀粉形成单螺旋结构,进而通过主客体相互作用形成包含物[17]。在高速剪切混合过程中形成的HAMS-A的大蒜素含量较CS-A高,这是主要是由于HAMS的直链淀粉含量高的缘故。直链淀粉含量是影响淀粉与大蒜素包合作用的主要因素[4,6]。PS和大蒜在高速剪切处理50~70 min时,PS-A中大蒜素含量相对较高,这可能与马铃薯淀粉颗粒大,分子聚合度高、脂质含量少,结晶结构易被破坏等因素有关[2]。
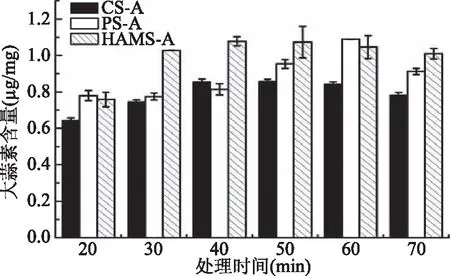
图1 高速剪切混合时间对淀粉-大蒜素包合物中大蒜素含量的影响Fig.1 Effect of high speed blending time on thecontent of allicin in starch-allicin complexes
2.1.2 淀粉/大蒜(干基)质量比 淀粉/大蒜(干基)质量比对包合物中大蒜素含量的影响结果见图2。由图2可知,3种淀粉包合物在不同淀粉/大蒜(干基)质量比的制备条件下所包埋的大蒜素含量不同,CS-A、PS-A和HAMS-A的最优质量比为1∶2、1∶6、1∶2,此时包合物CS-A、PS-A和HAMS-A中的大蒜素含量分别为(1.18±0.05)、(1.28±0.03)和(1.42±0.03) μg/mg。3种包合物中大蒜素含量均随着大蒜(干基)占比增加呈先增加后稳定的趋势,这一结果与Yeo等[3]研究结果一致,直链淀粉在和客体分子进行包合过程中,客体分子占比较低时,包合作用会随着客体分子浓度的增加而增强,但增加到一定阈值后,过多的客体分子将不会被完全包合,包合物中大蒜素的含量不再改变。由于3种淀粉的差异,在相同的淀粉/大蒜(干基)质量比的情况下,HAMS-A中的大蒜素含量明显高于另外两种包合物,PS-A则略高于CS-A。
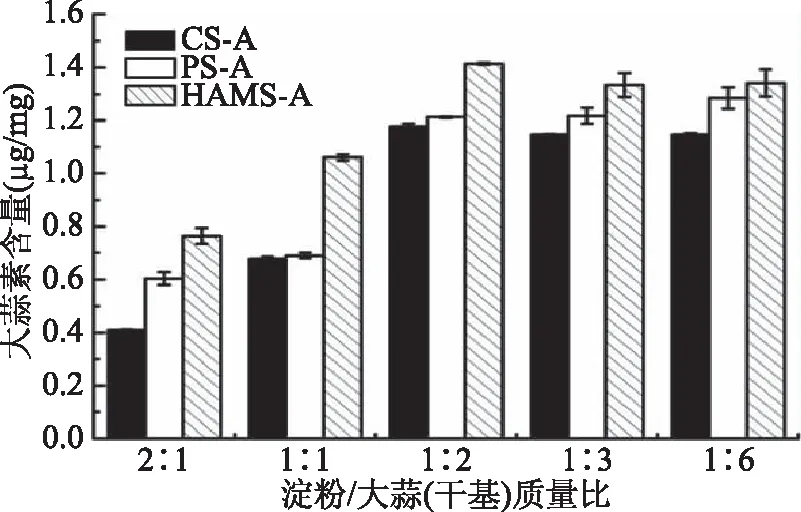
图2 淀粉/大蒜(干基)质量比对淀粉-大蒜素包合物中大蒜素含量的影响Fig.2 Effects of the starch/garlic(dry basis)mass ratioson the content of allicin in starch-allicin complexes
2.2 淀粉-大蒜素包合物的理化性质分析
2.2.1 淀粉-大蒜素包合物的碘结合特性 淀粉对照、大蒜粉和淀粉-大蒜素包合物碘结合特性结果如图3所示。CS、PS和HAMS与碘反应后所得溶液在450~700 nm处均有吸收峰,其最大吸收峰分别出现在605、584、604 nm处。根据吸光度值判断其碘结合能力大小次序为:HAMS>CS>PS。大蒜粉的碘结合实验结果没有出现吸收峰,这表明大蒜粉中的物质不干扰包合物的碘结合测定结果。当淀粉与大蒜素形成包含物后,所得包合物与碘反应后的溶液的吸光值都较原淀粉的低,且最大吸收波长向低波长方向移动。根据3种淀粉-大蒜素包合物与碘结合后所制备的溶液的吸光值判断其碘结合能力大小次序为:CS-A>PS-A>HAMS-A。造成这种结果的原因是,碘分子在淀粉溶液中能诱导直链淀粉形成单螺旋结构,并进入该单螺旋结构的空腔内,形成碘与直链淀粉的蓝色络合物[18];因大蒜中的大蒜素也能进入直链淀粉的单螺旋空腔产生竞争而抑制了碘与直链淀粉的包结络合[19],因此形成包合物后与碘的结合能力下降,包含物中大蒜素的含量越多,与碘的结合力越弱。
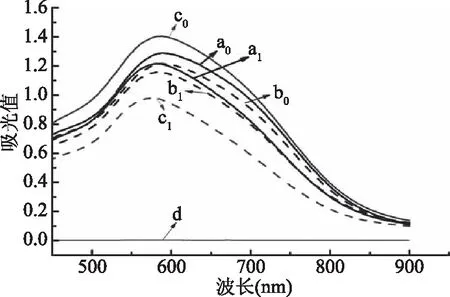
图3 淀粉对照,大蒜粉和淀粉-大蒜素包合物的碘结合能力Fig.3 Iodine-binding capacities of starch control,garlic powder and starch-allicin complexes注:a0,CS;b0,PS;c0,HAMS;d,GP;a1,CS-A;b1,PS-A;c1,HAMS-A。
2.2.2 淀粉-大蒜素包合物的扫描电镜分析 原淀粉、淀粉对照和淀粉-大蒜素包合物的扫描电镜照片如图4所示。由图4可知,玉米原淀粉(CS)颗粒形状为多角形,颗粒表面有许多大小不同的小孔(图4a0)。马铃薯原淀粉(PS)颗粒大小分布较广,呈圆形或卵圆形,表面光滑(图4b0)。高直链玉米淀粉(HAMS)为多面体,部分颗粒呈近似球形或椭圆形颗粒,颗粒表面光滑(图4c0)。原淀粉经高速剪切混合处理后,因颗粒发生溶胀而体积膨胀。对于PS而言,淀粉颗粒结构已经被破坏,并发生部分黏连(图4b1),而其余两种淀粉颗粒结构还保持完整。当淀粉与新鲜大蒜经过高速剪切混合处理后,在玉米淀粉颗粒的表面附着大蒜组织,部分淀粉颗粒破裂;相对于CS,PS或HAMS与大蒜组织的兼容性较好,混合程度高。实验过程中发现对于CS或HAMS而言,经过高速剪切混合处理后淀粉颗粒形貌基本完好,但是当淀粉与新鲜大蒜共处理时,淀粉的颗粒形貌发生了明显的变化,如HAMS的部分淀粉呈扁球形,而大蒜的组织碎片形态基本消失。由此也说明高速搅拌混合处理有利于HAMS和大蒜素形成包含物。

图4 原淀粉,淀粉对照和淀粉-大蒜素包合物的扫描电镜照片Fig.4 SEM pictures of native starch,starch control and starch-allicin complexes注:a0,CS;b0,PS;c0,HAMS;a1,CS对照;b1,PS对照;c1,HAMS对照;a2,CS-A;b2,PS-A,c2,HAMS-A。
2.2.3 淀粉-大蒜素包合物的X射线衍射分析 原淀粉、淀粉对照、大蒜粉和淀粉-大蒜素包合物的X射线谱图见图5。由图5可知,原淀粉CS、PS和HAMS分别呈现为A型、B型和A型的晶型结构[3-4]。大蒜粉(GP)未出现结晶衍射峰,为无定型结构。经高速剪切混合处理后,马铃薯原淀粉的衍射峰的强度明显减弱,相对结晶度明显降低;而CS和HAMS的衍射峰的强度变化不大。当淀粉与新鲜大蒜经过高速剪切混合处理后,包含物CS-A和HAMS-A在2θ角15°、17°、18°和23.5°处出现衍射峰,但其衍射强度明显减弱,表明这些包含物呈现A型结晶;而包含物PS-A则转化成无定形结构,这种结构有利于大蒜素与直链淀粉结合,并形成包含物。通常直链淀粉与疏水性分子形成包合物后呈现V构型结构,即在X射线衍射图2θ角7°、13°和20°附近出现较强衍射峰[20]。直链淀粉与疏水性分子形成包合物也有非V构型结构的情况,本实验所涉及的3种淀粉-大蒜素包含物均未出现V构型晶型衍射峰,可能与新鲜大蒜中大蒜素含量较少,组成成分相对复杂有关。
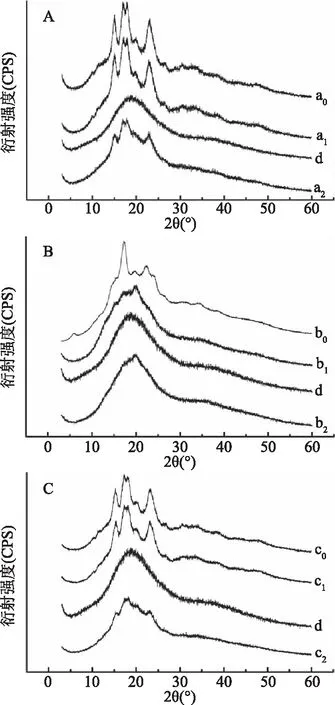
图5 原淀粉、淀粉对照、大蒜粉和淀粉-大蒜素包合物的X射线衍射图Fig.5 X-ray diffraction patterns of raw starch,starch control,garlic powder,and starch-allicin complexes 注:A图:a0,CS;a1,CS对照;a2,CS-A。B图:b0,PS;b1,PS对照;b2,PS-A。C图:c0,HAMS;c1,对照;c2,HAMS-A;d,GP。
2.2.4 淀粉-大蒜素包合物的热重分析 原淀粉、大蒜粉、物理混合物和淀粉-大蒜素包合物的热重分析曲线如图6所示。由图6可知,原淀粉(a0、b0、c0)的失重过程分为2个阶段,第1阶段主要由样品中水分和表面结合水的损失产生(25~100) ℃,第2阶段主要是淀粉分子链断裂和碳化引起(280~350) ℃[20]。大蒜粉的失重过程分为3个阶段(曲线d),第1阶段是由大蒜粉样品中表面水分损失和一些小分子碳氢化合物的分解造成的(50~100) ℃[21],第2失重阶段属于大蒜粉中大蒜素等活性物质的蒸发及热分解引起的(190~260) ℃[22],最后一个失重阶段主要由大蒜中纤维素等物质的碳化产生(280~350) ℃[23]。从DTG图看,3种物理混合物的失重速率和失重温度在前2个阶段与大蒜粉一致,第3阶段与其原淀粉一致,这说明物理混合只是简单的叠加,无相互作用。CS-A的热重曲线(曲线a2)几乎与物理混合物重合,玉米淀粉与大蒜素的相互作用较弱;PS-A(曲线b2)热分解的第2阶段温度范围为225~270 ℃,失重速率在250 ℃左右达到峰值,高于大蒜粉和相应的物理混合物15 ℃;HAMS-A(曲线c2)在此阶段,失重速率达到最高时的温度比大蒜粉和其物理混合物高30 ℃。包合物与大蒜粉相比热稳定性提高了,这说明通过高速剪切混合法制备淀粉和大蒜素复合物,可以提高大蒜中大蒜素的稳定性,3种淀粉对大蒜中大蒜素稳定作用强弱次序为HAMS>PS>CS。
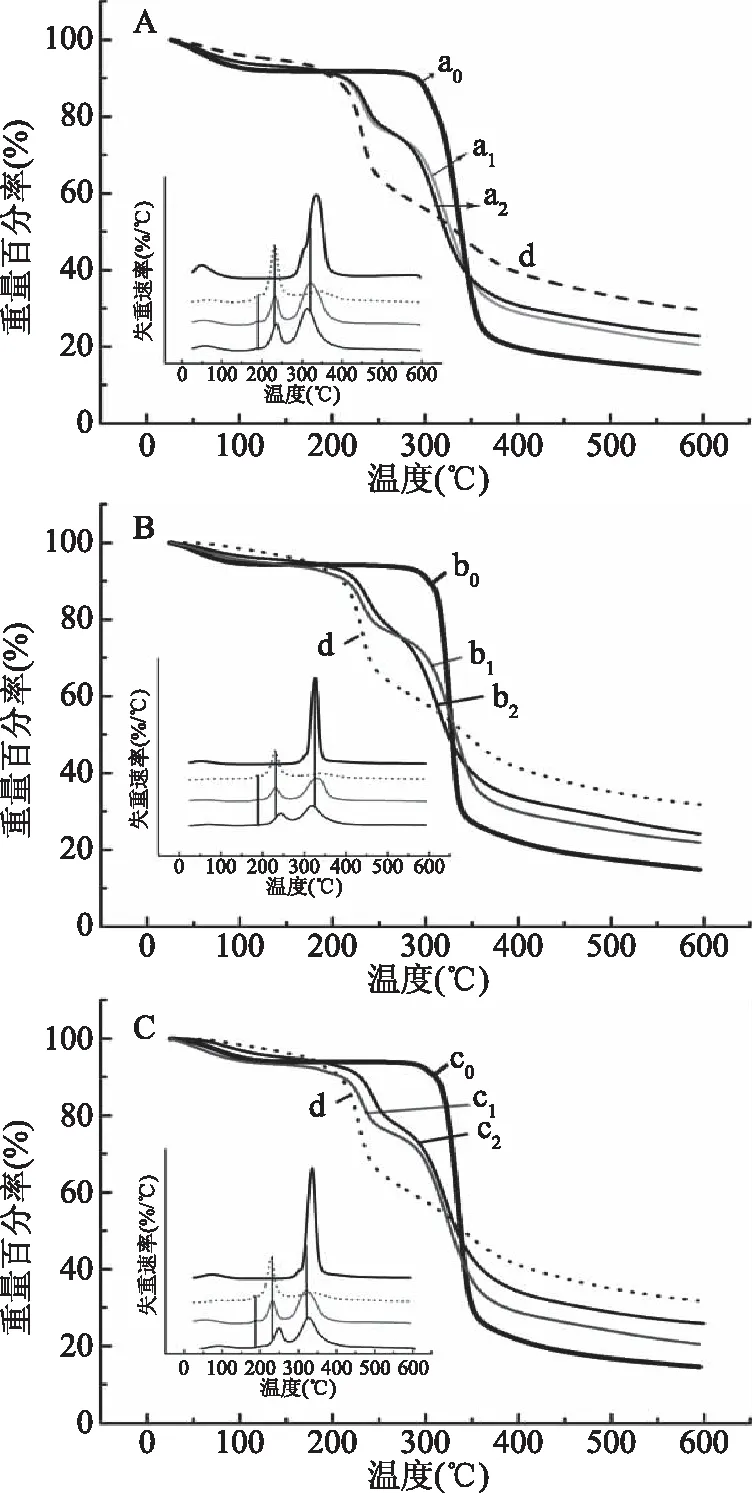
图6 原淀粉、大蒜粉、物理混合物和淀粉-大蒜素包合物的TGA曲线Fig.6 TGA curves of raw starch,garlic powder,physical mixture and starch allicin inclusion complex注:A图:a0,CS;a1,CS和GP物理混合物;a2,CS-A。B图:b0,PS;b1,PS和GP物理混合物;b2,PS-A。C图:c0,HAMS;c1,HAMS和GP物理混合物;c2,HAMS-A。d,GP。
2.3 淀粉-大蒜素包合物的抑菌性能分析
大蒜粉、淀粉对照和3种淀粉-大蒜素包合物对4种细菌的抑菌活性评价结果见表1。由表1中可知,淀粉对照对所有供试菌均无抑菌活性。而大蒜粉对于4种供试细菌显示出较强的抑菌活性,其抑菌活性大小次序为:枯草芽孢杆菌>金黄色葡萄球菌>沙门氏菌>大肠杆菌。文献报道,大蒜中主要的抑菌活性物质是大蒜素[24],它可以对多种巯基依赖性酶系统产生抑制效应,致使细菌内一些与生命活动相关的酶失去活性而抑制细菌的生长和繁殖[25]。从表1可知,3种包合物CS-A、PS-A、HAMS-A对所有细菌都具有抑菌活性,其抑菌活性强度基本没有因为加入淀粉后稀释了大蒜中大蒜素而导致其抑菌活性降低。对于同一种受试菌,3种包合物抑菌效应大小次序为HAMS-A>PS-A>CS-A,这与包合物中大蒜素含量有明显相关性。大蒜素稳定性较差,在储藏或应用的过程中容易发生质量损失,根据前面的分析结果,淀粉与大蒜素所形成的包合物比大蒜粉具有更好的稳定性,因此抑菌活性较好。
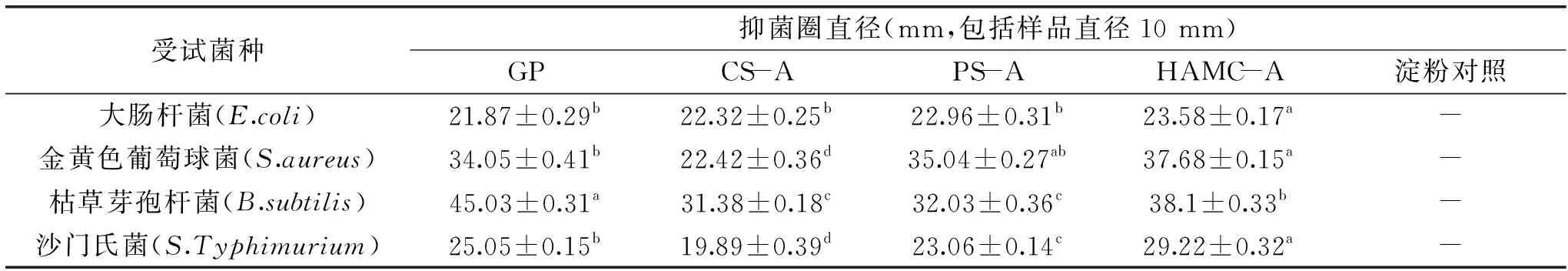
表1 大蒜粉和淀粉-大蒜素包合物对供试菌的抑菌活性Table 1 Antibacterial activities of garlic powder(GP)and starch-allicin complexes against tested strains
3 结论
采用高速剪切混合处理法探讨了CS、PS和HAMS分别与大蒜中大蒜素形成包合物的特异性。结果发现,淀粉-大蒜素包含物中直链淀粉含量是影响淀粉对大蒜中大蒜素包合作用的主要因素,其次,淀粉的种类也影响了淀粉与大蒜中大蒜素的包结络合。HAMS是3种淀粉中较为理想的包合大蒜素的材料。碘结合能力分析发现,3种淀粉与大蒜中的大蒜素均能形成包合物。通过扫描电镜、X射线衍射和热重分析发现,淀粉与大蒜通过高速剪切混合处理后,淀粉的颗粒发生溶胀和变形;淀粉的结晶度降低,但未形成V型结晶结构;形成包合物后提高了大蒜素的稳定性。通过抑菌活性评价说明,淀粉-大蒜素包合物对供试菌均具有良好的抑菌活性。高速剪切混合处理法是一种较好的包埋风味物质并使其微胶囊化的方法,这种方法操作简单,经济环保,未引入有毒有害试剂,是一种较好的包埋风味物质并使其微胶囊化的方法,对大蒜中大蒜素的高效利用具有指导意义。

