不同配料及发酵剂对羊肉发酵香肠滋味及香气成分的影响
孙学颖,辛晓琦,刘建林,靳 烨,赵丽华
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
羊肉属于高蛋白、低脂肪、低胆固醇类食品,一些国家把羊肉列为上等食品[1]。而羊肉香肠成品具有特殊的风味、香气,其风味物质是影响感官特性、质量和消费者行为的重要因素,目前羊肉发酵香肠成品并未实现规模化生产,这可能与羊肉制品特有的膻味、色泽差等问题有关[2]。唐发书等[3]研究发现VC除了发色作用,还可降低亚硝酸盐含量,提高产品安全性。研究表明,乳酸菌作为肉制品发酵剂菌株除了可以产酸抑制腐败菌生长和脂肪氧化[4],还可以增加产品挥发性风味物质含量,赋予产品香气[5]。潘晓倩等[6]研究表明,添加S-SX发酵剂和T-SC-200发酵剂能够显著增加北方风干香肠风味物质含量,尤其是醛类、酮类、酯类物质含量。但目前鲜有研究关于VC和发酵剂及其共同作用下对羊肉发酵香肠风味的影响。
近年来,对包括发酵香肠在内的食品风味的研究越来越多,固相微萃取结合气相色谱-质谱联用(SPME-GC-MS)技术被广泛应用到食品挥发性成分的检测[7-10]。但由于风味阈值和化合物之间相互作用,并不是所有的挥发性成分都是风味活性物质,大量的挥发性成分中仅小部分对食品有风味贡献[11]。王恺等[12]通过SPME-GC-MS分析不同菌种组合的发酵剂作用下发酵香肠中挥发性风味物质的构成与变化,得出主体风味物质为醇类、酸类、酯类、醛酮酚类物质,包括己醛、3-羟基-2-丁酮、愈疮木酚等。龙强等[13]以取自四个不同部位的宁乡花猪肉制成的风干香肠为研究对象,采用SPME-GC-MS共鉴定出35种挥发性风味成分,其中醇类2种、醛类18种、酯类6种、烃类7种及其他类化合物2种。醛类、酯类及烃类是宁乡花猪肉风干香肠的特征风味成分。
电子鼻能够反映样品整体气味信息,电子舌能够反映样品的甜、苦、涩、咸等综合滋味信息,SPME-GC-MS可实现风味物质定性定量分析,三者可从不同角度对食品品质进行检测评定。将三者结合可以实现微观分析与宏观处理相结合的食品香气的综合分析。本研究制作对照组、发酵剂组、VC组及VC+发酵剂组四组羊肉发酵香肠,采用SPME-GC-MS技术结合电子鼻、电子舌进行风味差异分析,通过主成分分析和雷达图分析等对4组羊肉发酵香肠的挥发性风味成分进行鉴定,研究发酵剂和VC对羊肉发酵香肠滋味及香气成分影响情况,为改善发酵香肠风味提供理论依据。
1 材料与方法
1.1 材料与仪器
苏尼特羊羊后腿肉与羊尾脂肪 采于内蒙古乌拉特中旗;26 mm胶原蛋白肠衣 内蒙古博雅科技公司;蔗糖、葡萄糖、硝酸钠、亚硝酸钠、VC内蒙古达音科技有限公司;食盐、孜然粉 内蒙古呼和浩特市华联超市;戊糖片球菌37x-8 内蒙古农业大学肉品微生物实验室筛选于蒙古国风干牛肉中;蔗糖、葡萄糖、硝酸钠、亚硝酸钠 均为国产分析纯。
ZXMP-A1430型恒温恒湿箱 上海智城分析仪器制造有限公司;PEN3型便携式电子鼻传感器 德国Airsense公司;SA402B型电子舌 日本Insent公司;Trace 1300、ISQ型GC-MS联用仪 美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 羊肉发酵香肠的制作工艺
1.2.1.1 工艺流程
1.2.1.2 操作要点 参考盛雅萍[14]方法略作修改:羊后腿肉与羊尾脂肪按4∶1比例,以原料肉为基础计算各配料添加量。原料肉搅碎,脂肪切丁,加入蔗糖0.5%,葡萄糖0.5%,食盐2.5%,硝酸钠70 mg/kg,亚硝酸钠70 mg/kg。除此之外,发酵剂组添加37x-8戊糖片球菌,添加量为107CFU/g;VC组添加VC,添加量为0.05%;VC+发酵剂组添加37x-8戊糖片球菌和VC,添加量分别为107CFU/g和0.05%。各组分别混匀后在4 ℃条件下腌制12~15 h,灌肠后放置于恒温恒湿培养箱中温度25~30 ℃,湿度95%条件下发酵24~48 h,随后在温度14~15 ℃,湿度85%条件下干燥70~72 h,最后在温度13~14 ℃,湿度75%条件下放置70~72 h至成熟。
1.2.2 羊肉发酵香肠的制作及取样 按照以上工艺流程和操作要点,制作以下4组发酵香肠:对照组(自然发酵)、发酵剂组(加入发酵剂)、VC组(加入VC)、VC+发酵剂组(加入VC及发酵剂)。制作以上4组羊肉发酵香肠,于成熟后取样于-20 ℃保存备用,进行电子鼻、电子舌及SPME-GC-MS的分析测定。
1.2.3 发酵羊肠香气成分的测定
1.2.3.1 电子鼻的测定 参照李双艳等[15]的方法并略作修改。样品前处理:将样品切碎后精确称取5.00 g羊肉发酵香肠肉糜于10 mL电子鼻专用顶空瓶中60 ℃处理40 min,平衡10 min。每个样品平行测定三次。
检测方法:25 ℃恒温环境中,运用PEN3型便携式电子鼻传感器对样品进行检测,传感器信号在60 s后基本稳定,选定信号采集时间为200 s。PEN3型电子鼻传感器由10种金属氧化物传导阵列构成,不同传感器性能描述如表1所示。
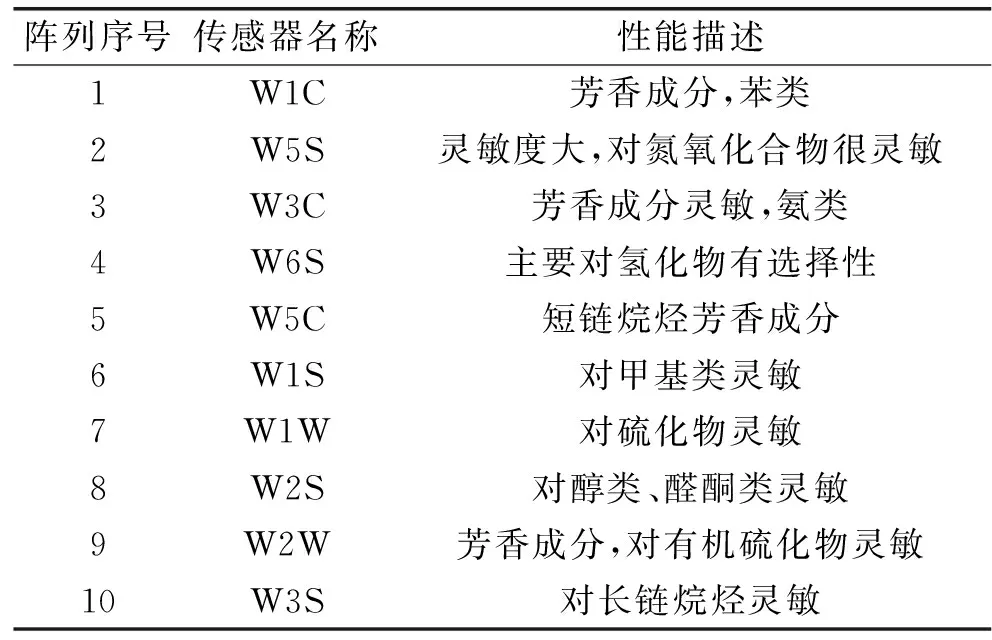
表1 电子鼻传感器阵列Table 1 Electronic nose sensor array
1.2.3.2 电子舌的测定 参照范文教等[16]的方法并略作修改。样品预处理:将样品切碎后,精确称取5.00 g羊肉发酵香肠肉糜于200 mL烧杯中,倒入100 mL去离子水,电磁搅拌浸提20 min后过滤,将滤液倒入电子舌专用烧杯中待测。每个样品平行测定三次。
检测方法:电子舌传感器经活化校准后,将前处理好的样品按顺序放入电子舌样品托盘中进行分析。设定电子舌分析参数:数据采集时间120 s,采集周期1.0 s,采集延迟0 s,搅拌速率1 r/s。SA402B型电子舌传感器由5个测试传感器(人工双分子膜传感器),不同传感器性能描述如表2所示。
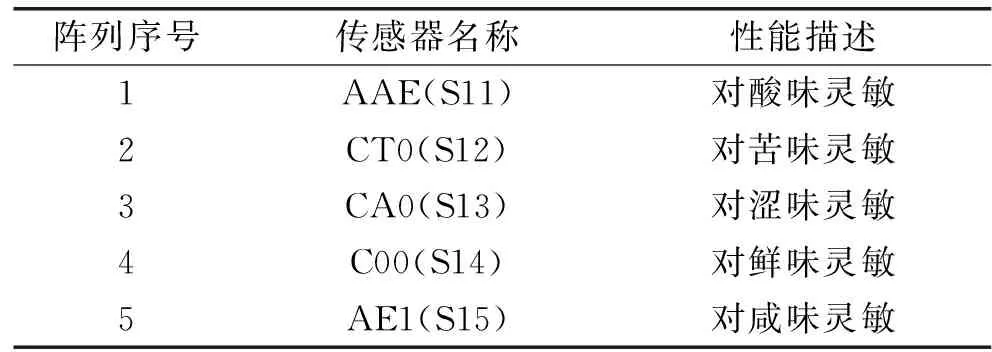
表2 电子舌传感器阵列Table 2 Electronic tongue sensor array
1.2.3.3 SPME-GC-MS测定 参照罗玉龙等[17]的方法并略作修改。样品预处理:将样品切碎后精确称取5.00 g羊肉发酵香肠肉糜于20 mL顶空样品瓶中,在60 ℃条件下吸附40 min后拔出萃取头。拔出后将萃取头即刻插入GC-MS进样口,于250 ℃解析3 min,同时采集数据。
GC条件:TR-5毛细色谱柱(30 m×0.25 mm,0.25 μm);载气He(纯度>99.99%);载气流速1.0 mL/min;传输线温度250 ℃;不分流进样;升温程序:40 ℃保持3 min,以4 ℃/min升温到150 ℃,保持1 min,再以5 ℃/min升温到200 ℃,最后以20 ℃/min升至230 ℃,保持5 min。
MS条件:电离方式EI离子源,离子源温度250 ℃;质量扫描范围30~400 m/z;溶剂延迟时间1.0 min。
1.2.3.4 定性与定量方法 质谱图经与MEANLIB、Nist Demo和Wiley Library检索定性,匹配度大于800作为鉴定依据。物质的定量用峰面积代替,并除以样品质量,最终单位为AU/g[18]。
1.2.3.5 相对气味活度值(ROAV)的计算 采用刘登勇等[19]提出的ROAV法(相对气味活度值法)评价各化合物对样品总体风味的贡献:首先定义对样品整体香味贡献最大的物质:ROAVs=100,则对其他挥发性化合物ROAV值计算公式如下:
式中:ROAVi为某挥发性风味物质的相对气味活度值;Ci为某挥发性风味物质的相对含量;Ti为某挥发性成分的嗅觉阈值;Tstan为气味贡献最大挥发性风味物质的阈值;Cstan为气味贡献最大挥发性风味物质的相对含量。
1.3 数据分析
数据采用Microsoft Excel 2019软件进行处理及雷达图分析并作图,采用SPSS 19.0软件处理数据,并采用单因素方差分析比较均值,P<0.05为差异显著;Origin 2018软件进行主成分分析并作图。
2 结果与分析
2.1 羊肉发酵香肠电子鼻分析结果
2.1.1 电子鼻对羊肉发酵香肠样品的雷达图分析 如图1所示,不同组别发酵香肠样品对电子鼻10个传感器的响应差异均显著(P<0.05),这说明电子鼻对羊肉发酵香肠气味敏感,可区分四组羊肉发酵香肠。传感器W5S、W1S、W1W、W2W和W2S对四组羊肉发酵香肠样品的响应值均显著高于其他传感器(P<0.05),且不同处理组的差异比较大,说明这5个传感器检测出的挥发性成分组成相差较大。而其余5个传感器的信号响应值在不同处理组之间几乎重叠,说明这5个传感器检出的挥发性成分组成基本相似。对比不同处理组发酵香肠数据发现,VC+发酵剂组在W1S、W1W和W2S传感器上的响应值显著高于其他三组,这三个传感器分别对甲基类、硫化物以及醇类、醛酮类灵敏。与其它处理组差异较大,这可能是加工工艺差别所致。
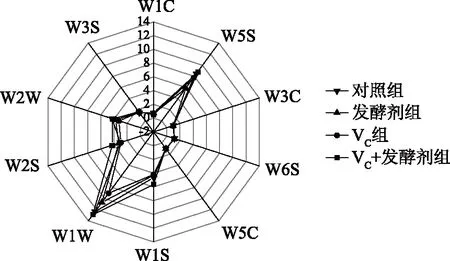
图1 电子鼻对羊肉发酵香肠雷达图分析图谱Fig.1 Radar map analysis of fermentedmutton sausage by electronic nose
2.1.2 电子鼻对羊肉发酵香肠香气成分主成分分析(PCA) 图2是电子鼻检测羊肉发酵香肠样品的PCA图。由PCA图谱可知第一主成分贡献率为52.7%,第二主成分贡献率为34.1%,两种主要成分累积贡献率为86.8%(超过85%),说明两种主成分包括发酵香肠气味物质的大部分信息,且不同发酵香肠之间风味相互独立[20]。图中每个椭圆代表不同香肠样品的数据采集点,可以看出发酵香肠样品电子鼻数据组之间无重叠,表明电子鼻能区分有效地区分不同香肠样品。从PC1角度看,对照组、发酵剂组和VC组位于正向端,而VC+发酵剂组位于负向端;从PC2角度看,对照组和VC+发酵剂组位于正向端,而VC组位于负向端;由上述分析可得,PCA法可将四组发酵香肠的风味物质完全区分开,且VC+发酵剂组和其他三组风味具有明显差异。
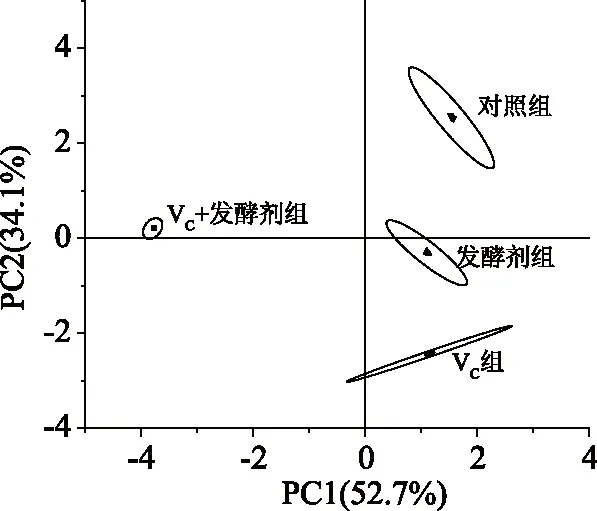
图2 羊肉发酵香肠电子鼻PCA分析图谱Fig.2 PCA analysis of fermented muttonsausage by electronic nose
2.2.1 电子舌对羊肉发酵香肠雷达图分析 如图3所示,从图3中可以看出,传感器酸味、苦味、涩味、后味B(苦的回味)、后味A(涩的回味)、鲜味、丰富度(鲜的回味)、咸味和甜味对羊肉发酵香肠响应信号的强度,传感器咸味、鲜味对各组羊肉发酵香肠样品的响应值较大,但各组羊肉发酵香肠的响应值基本一致,说明四组发酵香肠样品中滋味成分物质含量无明显差异。
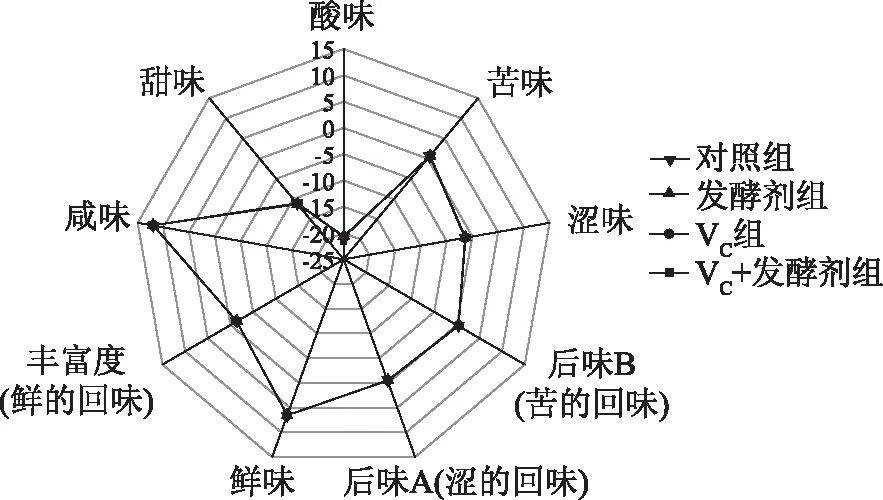
图3 电子舌对羊肉发酵香肠雷达图分析图谱Fig.3 Radar map analysis of fermentedmutton sausage by electronic tongue
2.2.2 电子舌对羊肉发酵香肠滋味物质的主成分分析 图4是电子舌检测羊肉发酵香肠样品的PCA图。由PCA图谱可知第一主成分贡献率为68.0%,第二主成分贡献率为16.2%,两种主成分累积贡献率为84.2%(超过70%),说明两种主成分基本上能够代表发酵香肠滋味物质的大部分信息[21]。从PCA图谱中可以看出,各组香肠样品之间无显著差异,与雷达图结果分析一致。而四组香肠样品电子舌数据重叠,表明电子舌不能区分不同发酵香肠样品滋味。

图4 羊肉发酵香肠电子舌PCA分析图谱Fig.4 PCA analysis of fermented muttonsausage by electronic tongue
2.3 不同羊肉发酵香肠GC-MS分析结果
由表3可知,从四组发酵羊肉肠中鉴定出的挥发性风味成分包括醛类(18种)、醇类(13种)、酯类(5种)、酮类(3种)、酸类(5种)及烃类(5种),共6大类49种。其中对照组、发酵剂组、VC组和VC+发酵剂组分别检测出43、46、48和48种挥发性成分,已有报道显示,这六大类化合物均为肉品中常见的挥发性风味化合物。
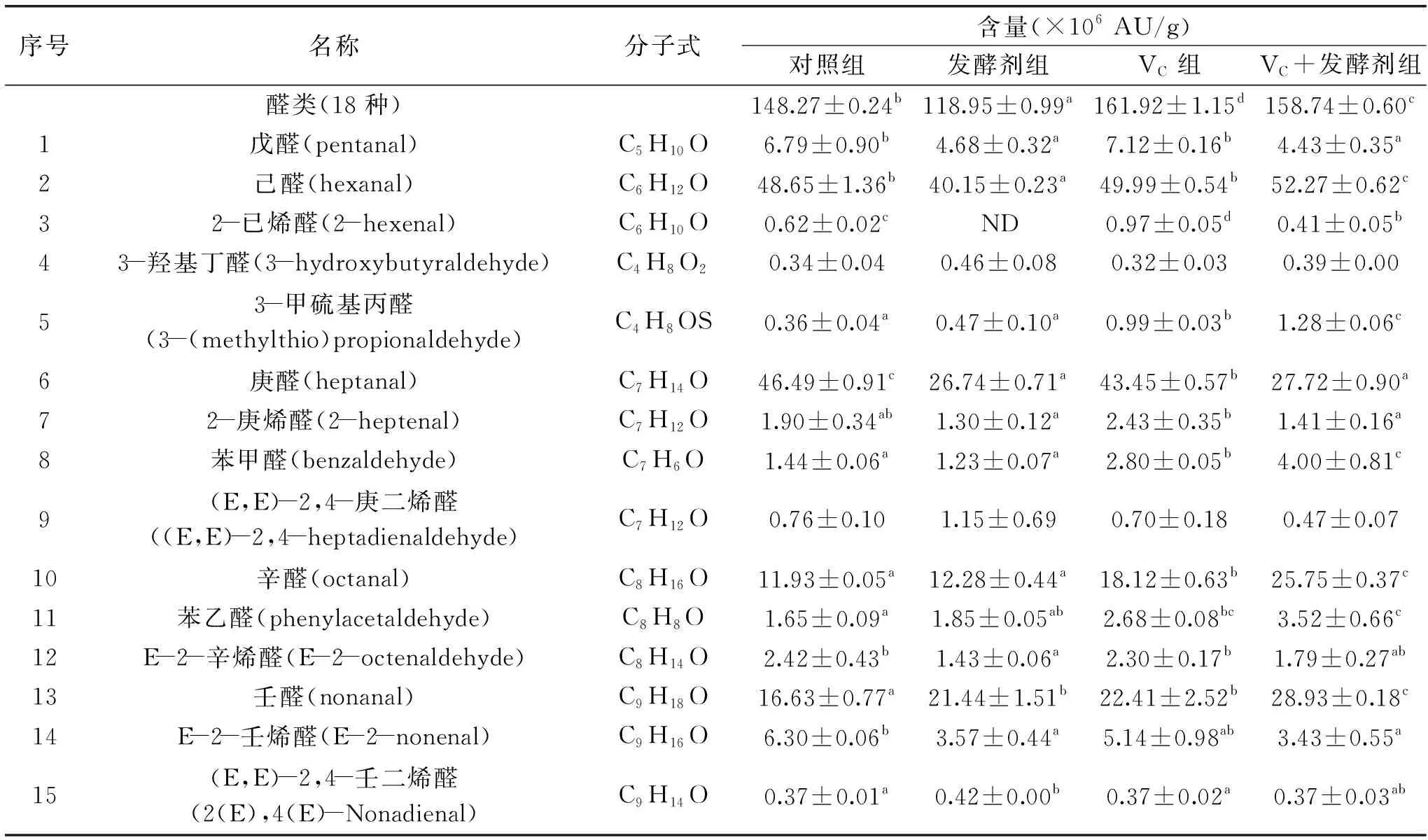
表3 羊肉发酵香肠样品挥发性风味物质相对含量Table 3 Relative content of volatile compounds of fermented mutton sausages
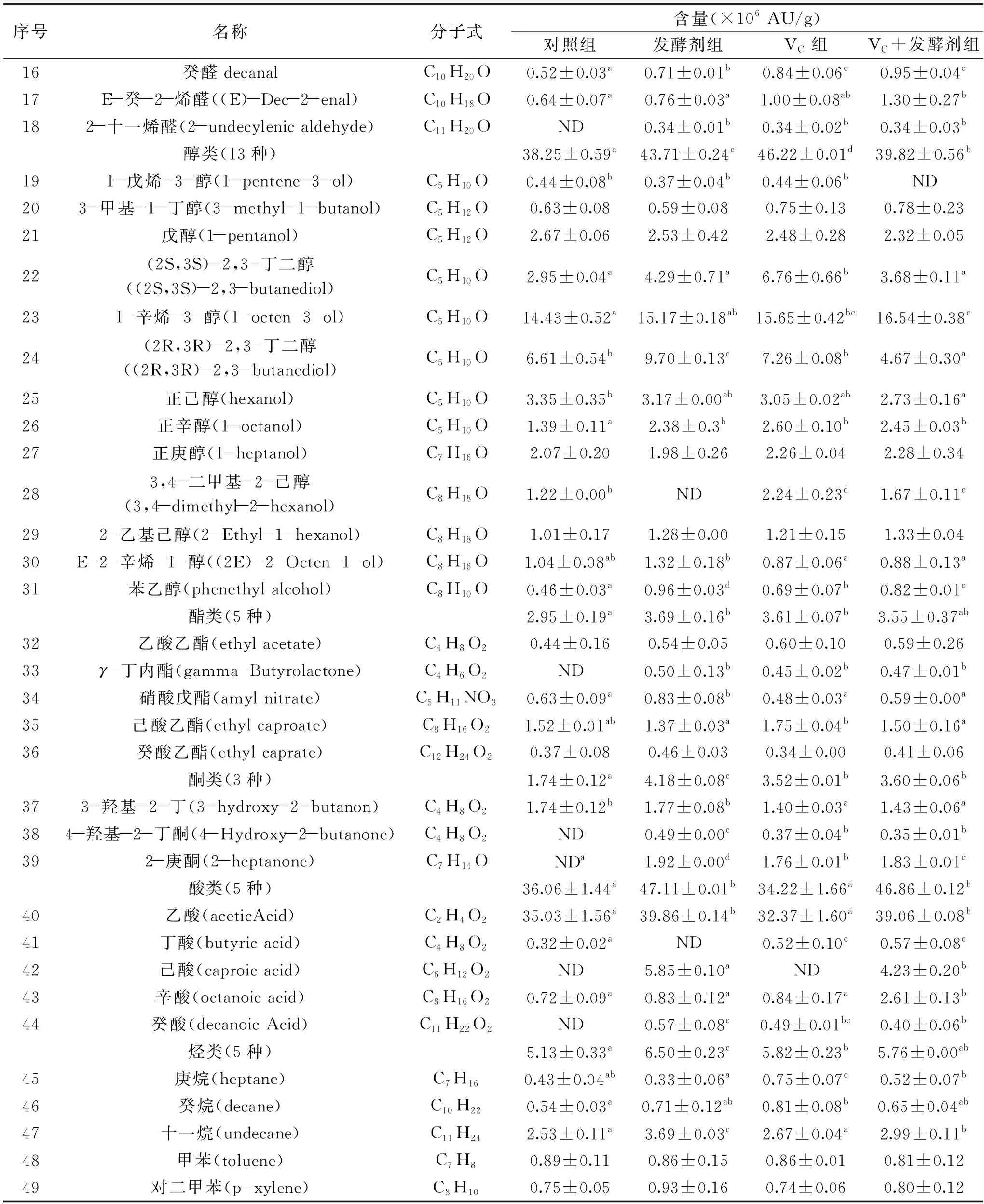
续表
这些化合物在我国的同类产品中也有检出。如醛类中的己醛、庚醛、壬醛,醇类中的2,3-丁二醇、1-辛烯-3-醇、酯类中的己酸乙酯以及烃类中的庚烷、十一烷等均为我国传统香肠制品中常见的挥发性化合物[22-23]。
醛类是发酵香肠羊肉香肠主要的风味物质,其阈值较低,具有油脂和水果香味[24]。主要来源于油酸和亚油酸等不饱和脂肪酸的氧化以及氨基酸降解[25]。由表3可知,从各组发酵香肠中鉴定出的醛类包括戊醛、己醛、庚醛、辛醛、壬醛等饱和直链醛,2-己烯醛、2-庚烯醛、(E,E)-2,4-庚二烯醛、E-2-辛烯醛、E-2-壬烯醛、(E,E)-2,4-壬二烯醛等不饱和直链醛以及苯甲醛、苯乙醛等芳香醛。VC组和VC+发酵剂组总体相对含量均高于对照组(P<0.05),说明VC和发酵剂会对发酵香肠风味具有贡献作用。在4组处理组中检测出的醛类化合物中,相对含量最高的均为己醛,正己醛是亚油酸氧化的基本产物,具有青草气味。研究发现,真空蒸煮羊肉、炭烤羊腿的挥发性化合物中正己醛含量最高[26-27]。四组发酵香肠样品中均有3-甲硫基丙醛和苯甲醛检出,二者相对含量均为VC组和VC+发酵剂组显著高于对照组(P<0.05),3-甲硫基丙醛具有醇厚的酱香,苯甲醛具有苦杏仁味。实验组中均检出2-十一烯醛,而对照组未检出。
醇类含量最高的有(2S,3S)-2,3-丁二醇、1-辛烯-3-醇、2,3-丁二醇含量也较高,该物质在一定情况下可以与3-羟基-2-丁酮生成双乙酰(2,3-丁二酮),改善香肠整体风味[28]。1-辛烯-3醇是一种亚油酸氢过氧化物的降解产物,阈值极低,只有1 μg/kg,具有类似蘑菇的气味,能够改善香肠整体风味[29]。本研究表明,实验组醇类物质含量均高于对照组38.25×106AU/g,可能是因为试验组的乳酸菌代谢碳水化合物的能力较强,导致试验组的醇类相对含量较高。此外,本研究中VC组和VC+发酵剂组的1-辛烯-3-醇的相对含量显著高于对照组(P<0.05),这也表明添加VC有助于改善香肠的整体风味,此结果同曹辰辰等[30]研究结果一致。
酸类物质对生成酯类物质具有贡献作用,本研究发现四个处理组中含量最高的均为乙酸,其中发酵剂组和VC+发酵剂组显著高于对照组(P<0.05),这是因为乙酸主要来源于微生物代谢碳水化合物,发酵剂组和VC+发酵剂组中接种乳酸菌发酵剂,产酸能力强,故乙酸含量高[31]。而VC组的乙酸含量低于对照组,可能是因为乙酸发生酯化反应,生成乙酸乙酯[32]。辛酸也是重要的风味物质,VC+发酵剂组的丁酸含量显著高于其余三组(P<0.05),另外,实验组检出癸酸,而对照组未检出,表明VC和发酵剂共同作用下对香肠的风味形成有一定贡献。
酯类对发酵香肠的典型的风味形成有一定作用,酯类物质是由醇和酸经过酯化反应生成的,多带有芳香味[33]。其中乙酯类物质赋予产品果香味和奶油香味,是促进发酵香肠风味形成的重要物质[12]。其中乙酸乙酯和己酸乙酯在四种香肠中含量较高,能对产品风味形成起到有益作用[34]。γ-丁内酯具有椰子香气,在稀释后还会散发杏子和李子的香气[12],对照组中未检出,其余三组均检出γ-丁内酯,说明发酵剂和VC会影响香肠风味形成,此结果与雷华威等[35]的结果一致。
酮类物质一般来自于美拉德反应,但由于香肠未经过烟熏烘烤处理,所以本研究中检测到的几种酮类物质应该是来自于脂类氧化反应[36]。其中3-羟基-2-丁酮是一种具有强烈挥发性,富有黄油香气的物质[37],但在四组香肠样品中差异不显著。4-羟基-2-丁酮具有芳香气味[38],2-庚酮具有水果气味[39],对照组未检出,其余三组均检出4-羟基-2-丁酮、2-庚酮,说明发酵剂和VC会影响香肠风味形成。而2-庚酮具有较高的阈值,对香肠风味贡献不大[40]。
2.4 发酵羊肉肠特征香气成分分析
结合各挥发性物质的气味特性和气味阈值等对羊肉发酵香肠的特征挥发性风味物质进行分析。根据所测风味物质的相对含量及其感觉阈值,确定辛醛对照组、VC组和VC+发酵剂组在的相对含量分别为11.93、18.12和25.75,其阈值仅为0.7 μg/kg,在发酵剂组中,壬醛相对含量为21.44,其阈值为1 μg/kg。其在各自组分中的总体气味贡献最大,所以定义辛醛、壬醛的ROAV stan为100。0.1
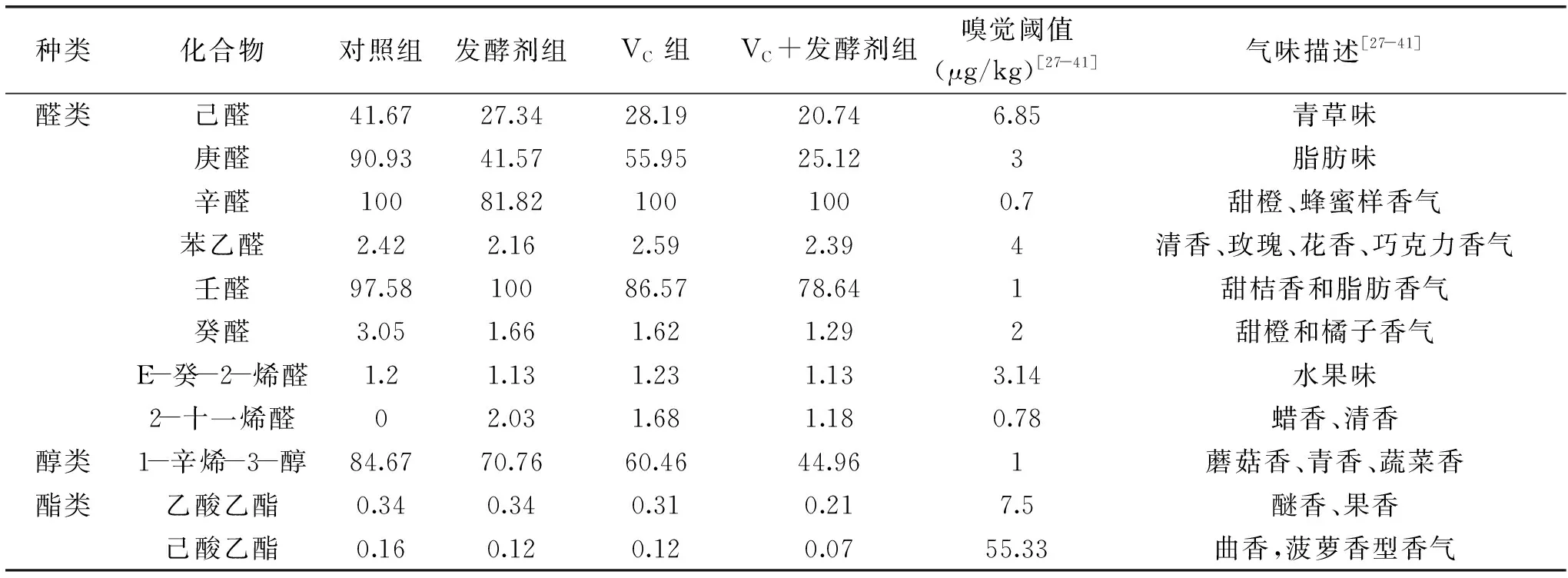
表4 羊肉发酵香肠风味物质ROAVTable 4 ROAVs of volatile compounds in four groups
对9种特征挥发性风味物质进行分析(ROAV>1),己醛、庚醛、辛醛、苯乙醛、壬醛、癸醛、E-癸-2-烯醛、2-十一烯醛具有青草味、脂香味和油脂香味[41],对形成发酵香肠的淡脂香和青草香具有重要贡献。1-辛烯-3-醇具有蘑菇风味和发酵香,对形成发酵香肠的发酵香具有重要贡献。对9种特征挥发性风味物质的风味特性进行总结归纳,得到发酵香肠的风味特征为淡脂香、青草香味、发酵味。
3 结论
本实验对4个不同处理组发酵香肠挥发性风味进行鉴定、分析和区分。基于电子鼻技术可实现对发酵香肠样品快速区分,而电子舌不能明显区分。基于SPME-GC-MS技术分析鉴定出49种挥发性风味物质。其中对照组、发酵剂组、VC组和VC+发酵剂组分别检测出43、46、48和48种挥发性成分,主要以酯类、醇类、醛类、酸类为主。总体来看,加入发酵剂和VC能够明显地提高发酵香肠中风味物质含量,尤其是1-辛烯-3-醇、4-羟基-2-丁酮、γ-丁内酯等醇类、酮类、酯类物质。结合电子鼻结果分析,VC+发酵剂组对醇类、醛酮类等物质更灵敏,说明发酵剂和VC共同作用下为发酵香肠效果更明显。结合ROAV筛选出9种挥发性风味活性物质,己醛、庚醛、辛醛、苯乙醛、壬醛、癸醛、E-癸-2-烯醛、2-十一烯醛和1-辛烯-3-醇,它们被鉴定为发酵香肠中的关键气味活性物质。基于对特征挥发性风味物质风味特性的分析,明确发酵香肠的风味特征为淡脂香、青草香味、发酵味。

