葡萄籽乙醇提取物对玉米淀粉微观结构及回生性质的影响
姜辰昊,高增明,王 伟,孙天颖,余世锋,王存堂
(齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161006)
淀粉资源丰富,是一种可再生和生物降解的天然资源,是食品工业和化学工业重要的原材料[1]。玉米淀粉是可利用的最廉价的淀粉,其具有较好的流变和凝胶特性,通常将其在糊化后被用作增稠剂、黏合剂、稳定剂等[2]。然而,糊化后的淀粉在降温过程中易发生回生现象,导致淀粉类产品在存储期间出现硬度增加、黏度降低、抗酸解、脱水等回生现象,促使其品质变劣、货架期缩短[3]。在工业上,淀粉要经过各种物理或化学改性以防止发生回生现象。物理改性法主要包括湿热处理、挤压、微波和高静水压处理等方法,然而这些物理方法一般成本较高,不适宜大规模应用;化学修饰法主要包括对淀粉进行乙酰化、琥珀酰化以及磷酸化等方法,但是许多用于食品的化学修饰对人体健康不够安全[4]。因此,针对回生问题,研究者大多采用添加抗淀粉回生的食品添加剂,如黄原胶、环糊精、海藻酸钠,与淀粉溶液混合其亲水性端插入直链淀粉分子形成螺旋配合体,影响淀粉分子重排微环境,从而延缓淀粉重结晶,达到抑制回生的目的[3-5]。同时有研究表明将单、双糖在淀粉糊化的过程中添加,因为单双糖的分子较小,能够随水渗透并进入淀粉内部,也可达到抑制淀粉重结晶的目的,从而抑制淀粉回生[6]。此外,将原花青素、茶多酚等多酚类物质添加到淀粉中,也可有效抑制回生作用,其原因可能是淀粉和酚类化合物的羟基形成氢键,从而干扰贮存过程中淀粉多聚物链自身的结合所致[7-8]。
葡萄籽是葡萄加工产业中的副产物之一,富含多酚类等活性物质,具有较强的抗氧化作用[9]。葡萄籽乙醇提取物(Ethanol extract of grape seed,EEGS)是从葡萄籽中提取的一种多酚类物质,其多酚含量在95%以上,EEGS包含单体酚和聚合多酚,单体酚主要是儿茶素、表儿茶素、没食子酸及儿茶素、表儿茶素的没食子酸酯等[10-11]。目前对葡萄籽多酚类物质的研究集中在抗氧化成分结构鉴定、抗氧化活性、抗菌活性评价以及抗慢性退行性疾病方面。然而葡萄籽中原花青素作为主要生物活性成分,其提取物对玉米淀粉回生的影响研究未见报道。葡萄籽作为葡萄加工业的副产品,若能将其开发利用,不仅可以保护环境、节约资源,而且能够增加添葡萄籽的附加值,创造良好的经济与社会效益。
因此,本文欲详细地研究EEGS对玉米淀粉回生的影响,采用扫描电镜(SEM)、傅立叶红外光谱仪(FTIR)X-射线衍射(XRD)、差示扫描量热仪(DSC)、分别测定EEGS与玉米淀粉的相互作用,研究EEGS对淀粉体外消化性的影响,并进一步分析EEGS对玉米淀粉回生的作用机制。
1 材料与方法
1.1 材料与仪器
葡萄籽 甘肃祁连葡萄酒业有限责任公司;玉米淀粉 市售;α淀粉酶(20000 U/mL,)、糖化酶(100000 U/g)、乙醇、无水醋酸钠、冰醋酸、3,5二硝基水杨酸、酒石酸钾钠、重苯酚、氢氧化钠、亚硫酸钠 均为分析纯,天津凯通化学试剂公司。
YB-2500A多功能粉碎机 永康市速锋工贸有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;TG20-WS高速离心机 北京京立离心机有限公司;2.5LfreezePrysystem真空冷冻干燥机 美国Labconco公司;SYJ-4数显示电热恒温水浴锅 天津市欧诺仪器仪表有限公司;MLS-3751-PC高压灭菌锅 长沙市汇虹化玻仪器设备有限公司;STA449F3同步热分析仪 德国耐驰有限公司;Specdrum红外光谱仪 美国PE公司;X射线衍射仪 德国BRUKER-AXS有限公司;UV-5100紫外-可见分光光度计 上海元析仪器有限公司;S-3400扫描电子显微镜 苏州佐藤精密仪器有限公司。
1.2 实验方法
1.2.1 葡萄籽乙醇提取物(EEGS)的制备 称取葡萄籽300 g进行粉碎,加入600 mL 70%乙醇室温下浸提2 h后,过滤取滤液。将滤渣再次进行上述提取过程,合并两次滤液。将滤液在50 ℃真空旋转蒸发,之后经冷冻干燥后得到的粉末即为EEGS,将EEGS储存于-20 ℃冰箱中备用。
1.2.2 淀粉样品的制备取 玉米淀粉10 g,分别加入占淀粉干重0%、2.5%、5%、10%的EEGS混合,并加入20 mL水后在121 ℃下糊化20 min。将糊化后样品放入4 ℃冰箱内分别贮存5、10、15 d后,将样品冻干后研磨,过120目筛后,备用。
1.2.3 回生玉米淀粉颗粒电镜扫描 对回生15 d的玉米淀粉样品进行电镜扫描。扫描电压10.00 kV,电流 64.0 μA。将不同的样品做好记录,平稳地固定于直径1.0 cm的样品台上,喷金镀膜,在扫描电子显微镜下,分别用800、10000的放大倍数、不同角度进行观察拍照[12]。
1.2.4 回生玉米淀粉的红外光谱测定 采用傅里叶红外光谱仪对回生15 d的玉米淀粉样品进行测定。准确称取1 mg样品与150 mg KBr进行混合,充分研磨压片制样,进行红外光谱扫描,测量范围为4000~400 cm-1,扫描次数为16次,分辨率4 cm-1。并通过所得数据计算1047/1022的比值间接代表回生程度的大小[13]。
1.2.5 回生玉米淀粉XRD射线衍射的测定 采用全自动X射线衍射仪对回生15 d的玉米淀粉进行晶型进行扫描,采用铜靶测定[14]。条件电压40 kV,衍射角的旋转范围为5~30 °,扫描速度为2.0 °/min,步长0.02 °,结果用Origin 8.5进行积分计算相对结晶度。
1.2.6 回生玉米淀粉的热力学性质测定 采用差式扫描量热仪法对回生玉米淀粉的热力学性质进行测定[15]。使用前用标准铟对DSC进行校准,取2~3 mg样品放在铝制坩埚中,用微量进样器加入4~6 μL的蒸馏水后压样并平衡24 h,以空坩埚做空白,升温范围为20~200 ℃,载气为氮气,从DSC熔融曲线中读取起始温度T0,峰值温度TP,及终止温度Tc。通过Origin 8.5软件进行积分计算各个样品的糊化焓值。
1.2.7 回生玉米淀粉体外消化能力测定 混合酶液的配制:称取糖化酶(100000 U/g)2 g和α淀粉酶溶液(20000 U/mL)5 mL同时溶于100 mL蒸馏水中离心取上清液即为混合酶液。
称取淀粉样品100 mg,加入pH5.2的醋酸缓冲溶液25 mL,37 ℃水浴5 min,加入5 mL预热好的混合酶溶液,在540 nm下测20和120 min吸光度值,以葡萄糖为标准品,做标准曲线,方程式为y=1.6134x-0.0832,R2=0.9991,根据葡萄糖标准曲线计算淀粉在20和120 min生成还原糖的含量[16]。
快消化淀粉(RDS)%=[(G20-FG)/TS]×0.9×100
慢消化淀粉(SDS)%=[(G120-G20)/TS]×0.9×100
抗性淀粉(RS)%=[(TS-G120)/TS]×0.9×100
式中,G20为酶水解20 min后产生的葡萄糖含量(mg);FG为酶水解处理前淀粉中游离葡萄糖含量(mg);G120为酶水解120 min后产生的葡萄糖含量(mg);TS为样品中总淀粉含量。
1.3 数据处理
所有试验结果均表示为平均值±标准偏差。采用SPSS 11.0软件对所有数据进行方差分析,并进行Duncan’s差异显著性分析和相关性分析。
2 结果与分析
2.1 EEGS对回生玉米淀粉微观结构的影响
通过电镜扫描,可以从微观层面观察EEGS对玉米淀粉颗粒表面结构所造成的影响,如图1所示。由图1a图1c可以看出,在回生15 d后,对照组的玉米淀粉表面是不规则的粗糙多孔结构。而加入2.5%的EEGS的淀粉表面结构平整,粗糙度降低。这可能是由于冷藏条件下的回生玉米淀粉,在冷冻干燥时水分升华,对照组的不规则多孔结构就是由于孔洞内水分损失造成的。而添加EEGS的淀粉分子的羟基与提取物中的含有大量羟基的黄酮类物质的羟基形成氢键,从而在冷冻升华干燥后仍然能够保持较为光滑的表面形态[12]。

图1 EEGS对回生玉米淀粉微观结构的影响Fig.1 Scanning electronic micrographs showing theinfluence of EEGS on microstructure of corn starch注:a,c:对照组;b,d:添加2.5%提取物;a,b放大倍数为800×,c,d放大倍数为10000×。
2.2 EEGS对玉米淀粉红外光谱的影响
糊化后的淀粉储存在较低的温度下,由于其处于热力学不稳定状态,无序的支链淀粉链重新定向排列、内部水分逐渐丧失,从无序结构转变为有序结构,且分子间结构越有序,淀粉回生程度越大[17]。Goodfellow等通过对淀粉结构分析指出可以用红外光谱800~1200 cm-1之间吸光度比值表征淀粉的短程有序性,其中1022 cm-1处与淀粉无定形区域相关,而1047 cm-1与淀粉有序程度相关[18]。Flores等用吸收峰1047/1022处吸光度比值来确定结晶区域的有序性,因此1047/1022吸光度的比值可以代表淀粉回生程度的大小[19]。
EEGS对玉米淀粉回生性质影响的红外光谱如图2所示。
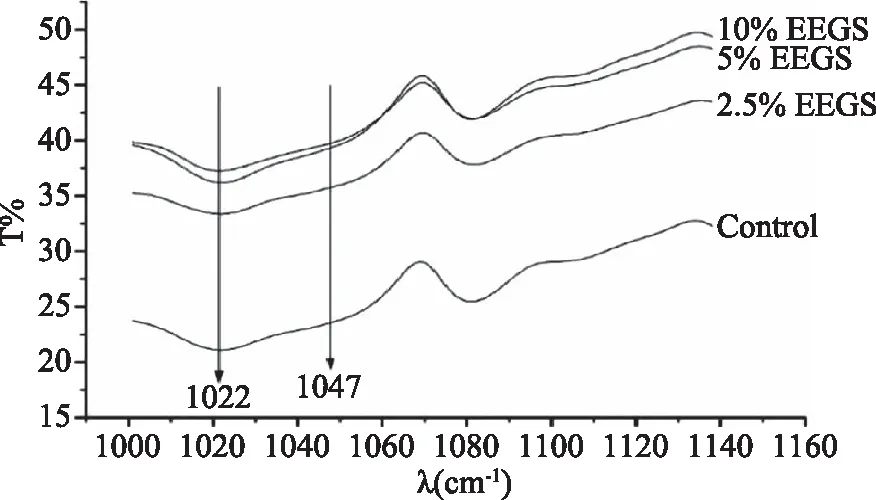
图2 EEGS添加量对玉米淀粉红外光谱的影响(回生15 d)Fig.2 Effects of EEGS concentrations on theFTIR spectra of corn starch after retrogradation for 15 d
从表1可知,在添加不同浓度EEGS的作用下,回生15 d的玉米淀粉在1047/1022处表征的吸光度值均有所下降,表明EEGS可抑制玉米淀粉的回生。而添加2.5%的EEGS玉米淀粉,其1047/1022吸光度的比值从对照组的1.11下降到了1.06,下降幅度较大,说明添加2.5%的EEGS对玉米淀粉回生有最佳的抑制效果。
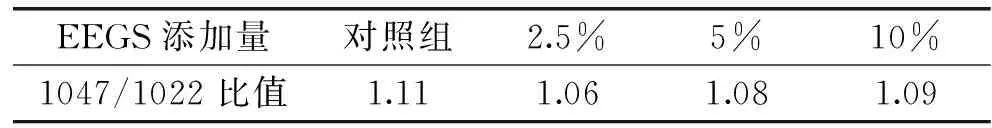
表1 EEGS添加量对1047/1022比值的影响(回生15 d)Table 1 Effects of EEGS concentrations on the 1047/1022ratio values of corn starch after retrogradation for 15 d
2.3 EEGS对玉米淀粉XRD射线衍射图的影响
XRD分析测定的是不同EEGS添加量时玉米淀粉样品在回生后的最终重结晶情况。而当淀粉回生后,16.9 °(2θ)处有很强的吸收峰,这是B-型结晶典型的特征[17]。当添加不同浓度的EEGS后,淀粉回生样品在16.9 °(2θ)处的衍射强度均有所下降,说明EEGS的添加可有效抑制玉米淀粉的的回生。这可能是由于黄酮类物质含有大量的羟基,可以通过非共价相互作用与直链淀粉或者支链淀粉的部分分支之间发生相互作用,限制了淀粉分子之间的重结晶,从而抑制淀粉的回生过程[20]。
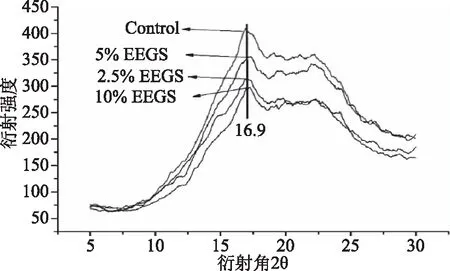
图3 EEGS添加量对回生玉米淀粉XRD射线衍射图的影响(回生15 d)Fig.3 Effects of EEGS concentrations on theX-ray diffraction of corn starch after retrogradation for 15 d
根据表2中淀粉相对结晶度的结果可以看出,添加不同浓度的EEGS的淀粉相对结晶度均有所下降。添加2.5%的EEGS的淀粉相对结晶度比对照组下降了13.15%,但是添加量增大到5%和10%时,回生淀粉样品的相对结晶度反而高于添加量为2.5%时的样品,但是相对结晶度依然低于对照组。说明EEGS的添加量与玉米淀粉相对结晶度下降并没有浓度依赖关系,添加量为2.5%时可达到较好的抑制回生的效果。
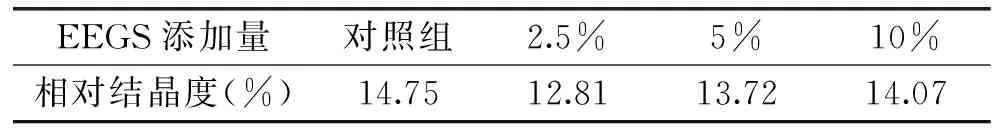
表2 EEGS添加量对玉米淀粉相对结晶度的影响(回生15 d)Table 2 Effects of EEGS concentrations on therelative crystallinity of corn starch after retrogradation for 15 d
2.4 EEGS对玉米淀粉的热力学性质的影响
淀粉的熔融焓值代表在与水共热的条件下,解开淀粉分子中双螺旋结构能量的大小,其本质是亲水性的羟基基团与支链淀粉的侧链相互作用,并在不同程度上结合到淀粉颗粒的无定形区域,从而改变结晶区和无定形基质之间的耦合力[16]。如表3所示,回生5 d,EEGS的添加对淀粉的熔融焓值的影响是显著的,且随着浓度的增加淀粉的熔融焓值呈现先下降后上升的趋势。添加2.5%、5%、10%的EEGS的淀粉的熔融焓值分别比对照组均有所下降,回生10和15 d淀粉的熔融焓值依然呈现先下降后上升的趋势,且随着回生天数的增加熔融焓值也在不断上升。这可能是由于回生程度的增大导致分子间氢键的作用力逐渐增强,破坏分子内部双螺旋结构越来越困难。但不论在5、10、15 d中,添加2.5%的EEGS的淀粉都能保持最低的回生程度。
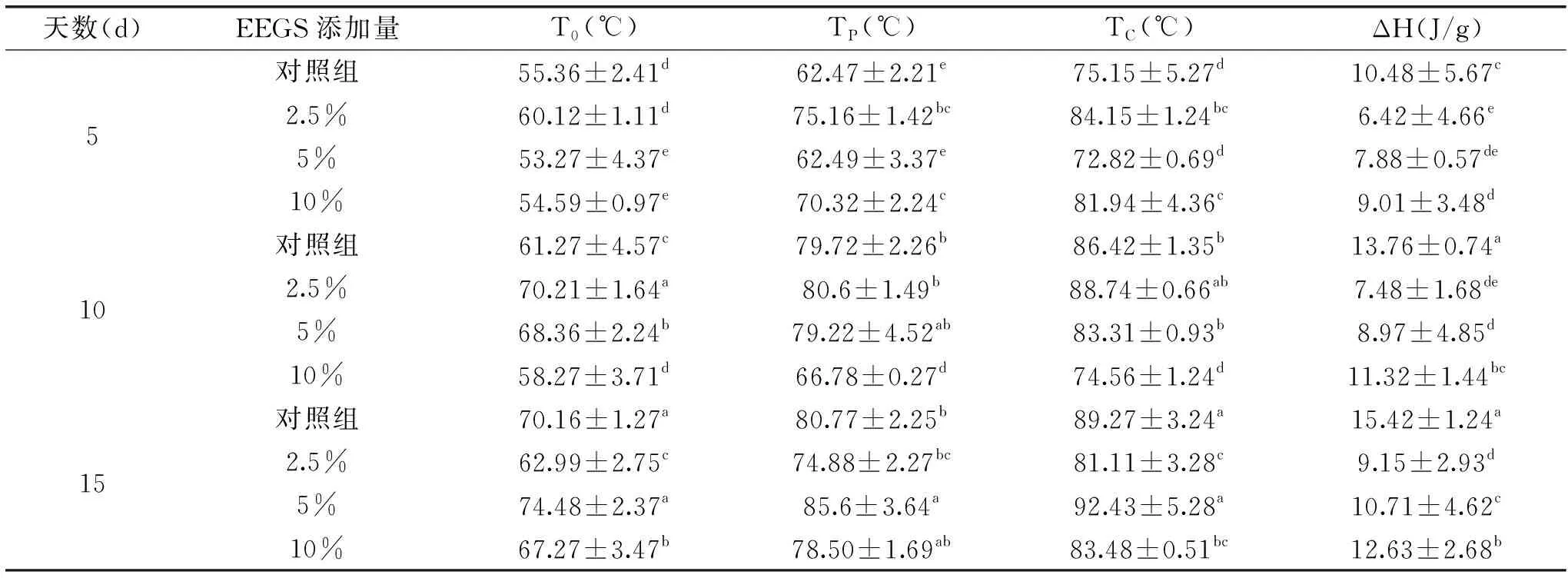
表3 不同浓度的EEGS对回生玉米淀粉的热力学性质的影响Table 3 Effects of EEGS concentrations on the gelatinization thermal properties of corn starch after retrogradation
2.5 EEGS对玉米淀粉体外消化的影响
由表4可知,随着EEGS添加量的增加,玉米淀粉中快消化淀粉(RDS)含量下降,慢消化淀粉(SDS)和抗性淀粉(RS)的含量增加,并呈现浓度依赖关系。当EEGS添加量为10%时,与对照组相比,在4 ℃回生5 d的玉米淀粉中的RDS下降了63.79%,SDS和RS分别增加了约2倍和14倍。此外,随着回生时间的延长,对照组中玉米淀粉中的RDS的含量下降较快,而随着EEGS的添加量增大,玉米淀粉中RDS的含量下降趋势明显减缓,这也说明EEGS的添加抑制了玉米淀粉的回生过程。这可能由于EEGS中原花青素的多羟基结构形成较多的氢键,同时淀粉的颗粒表面被原花青素的多羟基结构紧紧包围,减少了酶对淀粉消化作用的表面积[21]。从而阻止酶对淀粉的水解位点所致,韦冷云也发现向淀粉中添加一定比例的菊糖,淀粉的水解率会有一定程度的降低[22]。
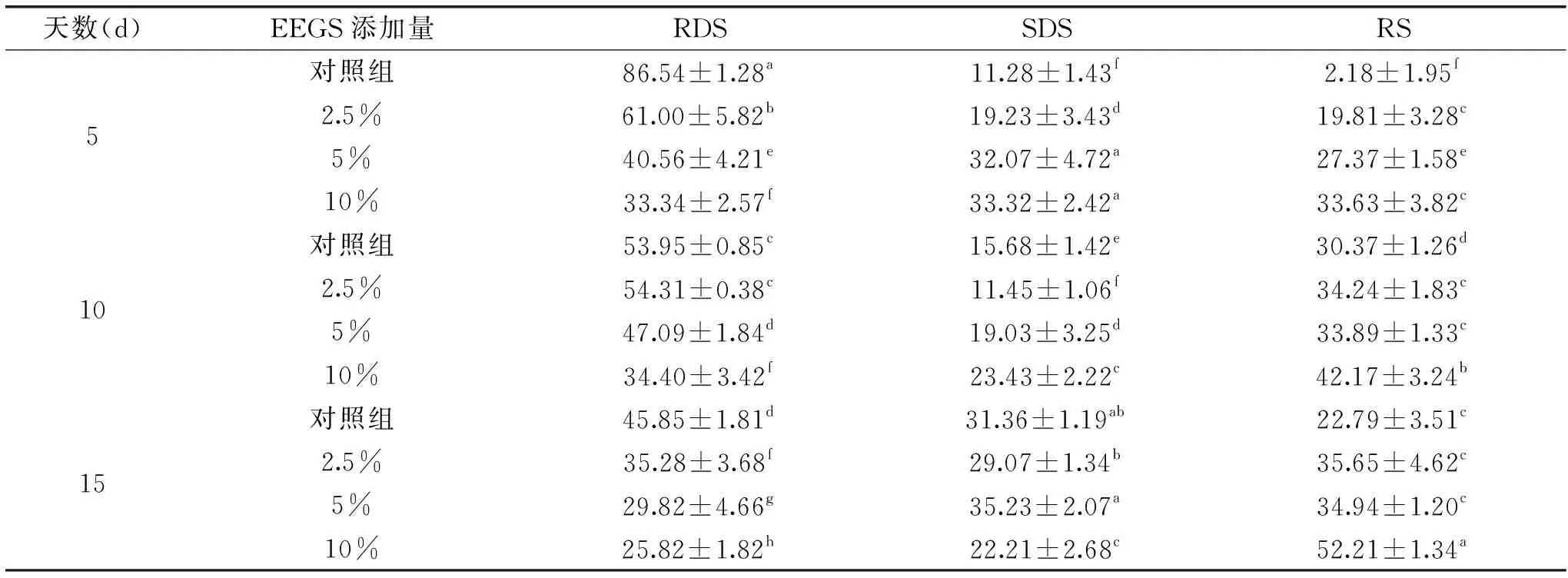
表4 不同浓度的EEGS对回生淀粉的体外消化性质的影响Table 4 Effects of EEGS concentrations on digestive properties of corn starch after retrogradation
3 结论
将EEGS(富含多酚类物质)添加到玉米淀粉中,其回生焓值、相对结晶度、1047/1022的比值均明显降低,回生后的玉米淀粉微观结构发生改变,均说明EEGS对玉米淀粉的回生有抑制作用。EEGS的添加量对回生的抑制程度有明显影响,添加2.5%的对回生的抑制效果较好。此外,EEGS的添加促使玉米淀粉的消化体外消化性能下降,快消化淀粉含量下降、慢消化淀粉、抗性淀粉含量增加。EEGS可作为玉米淀粉回生抑制剂、抗性淀粉生产的添加剂的潜在来源,在食品加工中被开发利用。

