骆驼瘤胃乳酸菌的分离、鉴定及其降解吲哚的功能研究
朱雅琴,黄煦杰,江 岩,李佳雯,刘蔓萩,曾献春,*
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046;2.成都医学院检验医学院,四川成都 610500)
吲哚是吡咯与苯并联的化合物,称苯并吡咯,属于含氮杂环化合物。吲哚分子式为C8H7N,难溶于水,易溶于50%~100%乙醇、异丙醇及二氯甲烷等有机溶剂。吲哚及其衍生物在自然界分布广泛,存在于天然有机物、温血动物肠道、粪便和煤焦油中[1-2]。吲哚作为肠道毒素,当肠道菌群微生态环境被内外因素破坏,腐败菌和致病菌大量繁殖且分解食物、胆汁可以产生吲哚[3],其在体内长期蓄积将导致机体发生病理变化,如引发炎症、损伤结肠、损害中枢神经系统和肝脏[4]。吲哚也可以协同致癌,通过亚硝酸盐促进次生胺的亚硝化作用,起到癌症促进剂的作用,具有致畸、致突变性,对环境和机体造成危害,已日益引起人们的关注[5]。目前获得的降解吲哚的微生物,主要来自被污染的环境,其中以不动杆菌、假单胞菌、铜绿假单胞菌、产碱杆菌、伯克霍氏菌和罗尔斯通菌属微生物最多[6]。罗海恩从焦化厂兼氧池水样分离得到芽孢杆菌L1对吲哚和喹啉的降解率高达74.4%[7],杨冰玉等从近海泥沙样品分离得到的产碱杆菌YBY,其可在14 h内降解100 mg/L吲哚[8]。
乳酸菌(Lactic acid bacteria,LAB)是人及动物肠道中极为重要的菌群之一,对人、畜机体均有益。肠道中的乳酸菌依靠肠道黏附进行营养代谢,发挥重要的生物学功能[9],大量研究证实乳酸菌作为益生菌具有降解有害物质如吲哚[10]、3-甲基吲哚[11]、亚硝酸盐[12-14]、苯并芘[15-16]、杂环胺[17]和多种霉菌毒素[18-19]等功能,其具有降解和转化肠道内有害物质[20]、清除致病毒素、维持肠道平衡的作用。乳酸菌降解有害物质的机制主要是其可产生分解有机物、脂肪酸、亚硝胺、内毒素的特殊酶系[21]。高鹏飞等[22]研究发现,以益生乳酸菌植物乳杆菌P-8饲喂肉鸡,试验组肉鸡粪便中吲哚含量显著低于对照组(P<0.05)。并且有报道研究表明肉鸡盲肠或直肠微生物组成的体外发酵液,随着乳酸杆菌和双歧杆菌数量的增加导致吲哚和粪臭素的水平降低[23]。
骆驼(Camelusbactrianus)是新疆特色养殖家畜,能够在极端干旱、盐碱的环境中生长[24]。作为典型的荒漠动物,骆驼摄入狼毒、骆驼蓬、假木贼等有毒的野生植物却不会中毒,其原因主要依赖骆驼消化道中的微生物能够降解、清除这些植物毒素,前期研究发现植物毒素结构与杂环化合物基本结构相似[25],推测骆驼消化道微生物可以降解含氮杂环化合物。目前,对骆驼瘤胃微生物的研究主要集中在菌落多样性及木质纤维素降解能力方面,而对吲哚降解研究甚少。有研究发现骆驼瘤胃和肠道微生物能够降解杂环化合物[26],从骆驼瘤胃内容物分离得到的乳杆菌属对骆驼蓬有降解作用[27],对杂环化合物吡啶的降解率在108 h内达到100%[28]。Mohammed等[29]也报道了山羊瘤胃微生物对吲哚及其化合物有一定的降解能力。
因此本研究从骆驼瘤胃中分离、纯化菌株,获得乳酸菌,并在体外开展乳酸菌降解吲哚的研究,通过GC-MS定时定量测定乳酸菌对吲哚的降解量,了解其降解能力,获得高效降解吲哚的乳酸菌,为进一步拓展乳酸菌的益生功能奠定基础。
1 材料与方法
1.1 材料与仪器
双峰骆驼瘤胃内容物 乌鲁木齐市屠宰场提供;吲哚标准品 色谱纯,Aladdin试剂有限公司;二氯甲烷 分析纯,天津市致远化学试剂有限公司。
7890A-5975C气相色谱-质谱联用仪(GC-MS) Agilent;U-3010紫外-可见分光光度计 Hitachi公司;PCR反应扩增仪 加拿大BBI公司;凝胶成像系统 Gene Genius公司。
1.2 培养基的配制
MRS固体培养基:葡萄糖20.0 g,牛肉浸膏15.0 g,蛋白胨10.0 g,酵母浸膏5.0 g,无水乙酸钠5.0 g,磷酸二氢钾2.62 g,柠檬酸氢二铵2.0 g,七水硫酸镁0.58 g,四水硫酸锰 0.198 g,琼脂粉 20 g,吐温-80 1.0 mL,无菌水1000 mL,pH6.0~6.5,121 ℃灭菌20 min。
无机盐培养基:磷酸氢二钠4.26 g,磷酸二氢钾2.65 g,硝酸铵1 g,七水硫酸镁0.2 g,氯化钙0.02 g,七水硫酸亚铁0.01 g,七水硫酸锰0.002 g,蒸馏水1000 mL,pH7.0,121 ℃灭菌20 min。
LB液体培养基:蛋白胨10 g,氯化钠10 g,酵母浸出粉5 g,蒸馏水1000 mL,pH7.0,121 ℃灭菌20 min。
1.3 骆驼瘤胃内容物中乳酸菌的筛选
1.3.1 乳酸菌的初筛 无菌采集乌鲁木齐市屠宰场3头骆驼瘤胃内容物,用无菌生理盐水倍比稀释成10-2、10-3、10-4、10-5、10-6、10-7、10-8,分别吸取每个稀释度溶液100 μL,涂布接种于MRS固体培养基,于37 ℃恒温培养箱中培养48 h。挑取表面光滑、凸圆、边缘完整、颜色呈乳白色的单菌落,反复进行分离纯化2~3次后,挑取疑似乳酸菌生长特征的菌落进行后续试验。
1.3.2 乳酸菌的复筛 将初筛得到的菌株进行革兰氏染色、接触酶实验,对革兰氏阳性、接触酶阴性菌株进行分子生物学鉴定。
1.4 乳酸菌的鉴定
1.4.1 提取菌株总DNA、PCR扩增及菌种鉴定 使用OMEGA土壤DNA提取试剂盒提取菌株基因组DNA,根据细菌通用引物16S rDNA 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)设计通用引物[30]。反应体系总体积为50 μL,10×Taq Buffer(含Mg2+)5 μL,DNA模板2 μL,d NTPs 5 μL,上游引物1 μL,下游引物1 μL,Ex-Taq酶0.75 μL,ddH2O 35.25 μL。反应程序:94 ℃ 5 min预变性;94 ℃ 45 s;55 ℃ 45 s;72 ℃ 75 s;35个循环,72 ℃延伸10 min。
1.4.2 建立系统发育树 得到的PCR产物用1.0%琼脂糖凝胶电泳进行检测,再使用SuPrep凝胶DNA提取试剂盒进行纯化后测序。将各菌的16S rDNA测序结果申请登录号后,与GenBank上所提交的细菌序列进行比对,通过Blast功能筛选出同源性较高的菌,用Neighbor-Joining法构建系统发育树[27]。
1.5 骆驼瘤胃乳酸菌对吲哚降解能力的测定
1.5.1 骆驼瘤胃乳酸菌降解吲哚实验 将筛选得到的4株乳酸菌接种至MRS培养基上进行活化。将活化后的乳酸菌接种到LB培养基中,37 ℃,180 r/min振荡培养24 h。将培养的菌液于4000 r/min离心5 min,收集沉淀,用无机盐培养基洗涤3次,收集沉淀,加入无机盐培养基制成吸光度值(600 nm)为2的菌悬液。以接种量5%将菌悬液接种到以吲哚为唯一碳源、氮源的无机盐培养基中,37 ℃,180 r/min振荡培养,每株菌有三个平行实验。每隔12 h取样测定乳酸菌的吸光度值(600 nm)和吲哚残留量,绘制乳酸菌生长曲线和降解曲线。
1.5.2 吲哚的萃取 每隔12 h从无机盐培养基中吸取菌液 5 mL,加入二氯甲烷5 mL,用超声波混匀后,静置过夜,收集下层二氯甲烷萃取液[31]。
1.5.3 吲哚含量的测定
1.5.3.1 GC-MS条件 GC条件:色谱柱:HP-5MS(30 m×0.25 μm×0.25 mm);载气:氦气(99.999%);流速:1.0 mL/min;进样量:1 μL;进样方式:分流进样;分流比:50∶1;进样口温度:250 ℃;程序升温:初始温度40 ℃,保持0.5 min,再以20 ℃/min的速度升温到110 ℃。后运行240 ℃,保持1 min。MS条件:离子源温度:230 ℃;接口温度:280 ℃;四极杆:150 ℃;电子轰击能量:70 eV;溶剂延迟时间:2.1 min;扫描方式:全扫描模式,因排除有杂峰干扰的可能性,定性扫描范围为20~550 m/z。质谱库:NIST2011。
1.5.3.2 定性方法 根据吲哚标准品在色谱图中的出峰时间进行定性。
1.5.3.3 定量方法 吲哚标准曲线的制定:配制吲哚浓度为400 mg/L的标准储备液,加入适量的二氯甲烷,配制25、50、100、300、400 mg/L五个浓度,分别进样后,以浓度为横坐标,定性离子(m/z,117.1)的峰面积为纵坐标,求出标准曲线方程,以此计算被测样品中吲哚的残留量。
1.5.4 吲哚降解率的计算 收集1 μL二氯甲烷萃取液注入GC-MS联用仪,测定无机盐培养基中吲哚残留量,了解菌株对吲哚的降解能力。降解率计算见公式(1)。
式(1)
式中:R1,吲哚降解率,%;A,吲哚初始量,mg/L;B,吲哚残留量,mg/L。
1.6 数据处理
应用Microsoft Excel 2013软件对实验数据进行简单处理后,利用Origin 8.5 软件作图。
2 结果与分析
2.1 乳酸菌初步筛选
挑取MRS固体培养基中表面光滑、凸圆、边缘完整、颜色呈乳白色的单个菌落进行革兰氏染色,于油镜下观察,结果如图1。四株菌染色后均呈紫色,为革兰氏阳性菌,菌体为短杆状,两端钝圆,无芽孢,无鞭毛。过氧化氢酶试验阴性,初步确定为乳酸菌。

图1 显微形态图Fig.1 The morphology by microscope注:A~D分别为GU366027、GU366034、GU366021、GU366019的显微形态图(1000×)。
2.2 乳酸菌的鉴定
对菌的16S rDNA序列进行扩增,得到的片段长度约1500个碱基对,电泳检测扩增片段,结果见图2。将获得的4株乳酸菌的16S rDNA序列向GenBank申请,并获得登录号,登录号为GU366019、GU366021、GU366027、GU366034。将16S rDNA测序结果与GenBank 中BLAST比对,构建系统发育树,见图3。由系统发育树可知,GU366019、GU366027、GU366021、GU366034均归属为乳杆菌属,其中GU366019、GU366027、GU366021为德氏乳杆菌亚种(Lactobacillusdelbrueckiisubsp.),GU366034为驯马乳杆菌(Lactobacillusequicursoris)。

图2 菌株GU366019、GU366021、GU366027、GU366034的PCR产物电泳图Fig.2 PCR amplification of stains GU366019,GU366021,GU366027 and GU366034

图3 菌株GU366019、GU366021、GU366027、GU366034的系统发育树Fig.3 Phylogenetic tree of strains GU366019,GU366021,GU366027 and GU366034
2.3 吲哚的定性
根据GC-MS结果可知标准样品吲哚的保留时间即出峰时间为:3.732 min,见图4。在定性质量范围为(m/z)20~550,参照NIST2011标准谱图库确定吲哚的定性离子质荷比(m/z)为117.1、90.1、63.1,见图5。由图6可知,菌株GU366027、GU366034、GU366021、GU366019在降解吲哚实验中,培养96 h时色谱图中出峰时间分别为3.733、3.738、3.739、3.735 min,与标准物质相近,因此可判定出峰时间3.732 min左右的峰面积为无机盐培养基中吲哚残留量。

图5 吲哚标准品质谱图Fig.5 Mass spectra of indole standard sample
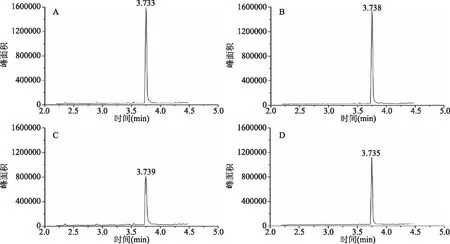
图6 四株菌降解吲哚实验96 h时的色谱图Fig.6 Chromatogram of indole degradation of four strains at 96 h 注:A~D分别为菌株GU366027、GU366034、GU366021、GU366019降解吲哚时的色谱图。

图4 吲哚标准品色谱图Fig.4 Chromatograms of indole standard sample
2.4 吲哚标准曲线的制作及回收率测定
制定吲哚标准曲线,以峰面积为纵坐标,其浓度为横坐标,求出标准曲线方程,曲线方程:y=6473.1x+22254(y是面积,x是浓度),R2=0.9997,见图7。并采用标样加入法测定回收率,将吲哚标准品测定量与吲哚标准品加入量的比值作为回收率结果,平均加样回收率为91.33%~108.48%。

图7 吲哚的标准曲线Fig.7 Standard curve of indole
2.5 骆驼瘤胃乳酸菌对吲哚的降解能力研究
通过紫外分光光度计测定OD600,得到菌株生长曲线;使用GC-MS测定吲哚的残留量,并通过标准曲线计算吲哚的降解率,结果见图8。四株乳酸菌接种到以吲哚(500 mg/L)为唯一氮源、碳源的无机盐培养基后,由于营养物质的缺乏,菌体总体生长缓慢,当菌体逐渐适应培养环境后,GU366027、GU366034、GU366019、GU366021都可以将培养基中的吲哚作为碳源、氮源加以利用,促进菌体生长繁殖,在培养过程中,菌株对吲哚的降解情况详见表1。由表1和图8可知,培养初期(24 h)四株菌就开始利用吲哚,GU366027、GU366019、GU366021对吲哚的降解率达到30%左右,GU366034为17%。随着培养时间的延长,菌株的数量不断增加的同时,吲哚的降解率也不断增加,在培养中期(72 h),GU366019、GU366021降解率超过50%,这两株菌在培养120 h时的降解率超过80%。培养后期(144 h),GU366019、GU366021、GU366027已经将培养基中的吲哚完全降解。总体来说GU366034在整个培养过程中对吲哚的降解速率相对较慢,在120 h时降解率是53%,到156 h时降解率达到100%,其在培养后期降解效率高。GU366019、GU366021、GU366027三株菌对培养基中的吲哚降解速率高,培养前期降解能力强。实验结果显示了四株来源于骆驼瘤胃的乳酸菌对高浓度的吲哚有较强的耐受及降解能力。

表1 GU366027、GU366034、GU366019、GU366021对吲哚的降解率Table 1 Degradation rate of indole by GU366027,GU366034,GU366019 and GU366021

图8 乳酸菌生长曲线及降解吲哚曲线Fig.8 The growth curve and indole degradation curve of lactic acid bacteria注:A~D分别为GU366027、GU366034、GU366021、GU366019的生长曲线和吲哚降解曲线。
目前已经获得了许多具有吲哚降解能力的细菌,主要来源于被污染的环境,例如石油污染的土壤、焦化厂的兼氧池水样、污水处理厂的污泥等[7,32-33],而来源于动物消化道的乳酸菌降解吲哚的相关研究较少。本实验筛选得到的四株乳酸菌来源于骆驼瘤胃,体外可耐受并降解利用高浓度的吲哚。作为乳酸菌与来源于污染环境中的微生物相比,在污染物处理和肠道毒素降解过程中具有一定的安全性。后期实验将对降解菌开展育种和培养条件的优化研究,缩短降解时间,提高降解效率,希望能用于肠道毒素和环境污染物的降解。
3 结论
本研究从骆驼瘤胃中分离筛选得到四株乳酸菌:GU366019、GU366027、GU366021、GU366034均归属为乳杆菌属,其中GU366019、GU366027、GU366021为德氏乳杆菌亚种(Lactobacillusdelbrueckiisubsp.),GU366034为驯马乳杆菌(Lactobacillusequicursoris)。通过体外吲哚降解能力测定,四株乳酸菌对高浓度(500 mg/L)的吲哚降解率达到100%。本研究拓展了动物消化道微生物的应用范围,扩充了降解吲哚的微生物资源,乳酸菌的相对安全性将避免应用过程中对环境和机体产生危害。本研究为后期开展乳酸菌降解吲哚的机制及治理环境污染物的相关研究奠定基础,为乳酸菌降解肠道毒素研究提供实验方法和理论依据。

