妊娠哺乳相关骨质疏松症的诊治进展
刘洋贝 罗敏 马勋龙 黄昶荃 王覃 卢春燕 陈德才*
四川大学华西医院,四川 成都 610041 绵阳市第三人民医院,四川 绵阳 621000
妊娠哺乳相关骨质疏松症是一种罕见的疾病,其特征是在妊娠的晚期或产后早期出现脆性骨折和低骨量,以椎体骨折常见,表现为腰背疼痛、身高变矮、活动受限,易和妊娠期、产后的腰背疼痛相混淆。PLO于1955年首次报道[1],目前全世界正式报道约230例,国内已正式报道28例。文献报道PLO的发病率为0.0004%[2],但由于PLO的罕见性致临床医师对其认识不足,发病率可能远高于文献。其病因、病理生理学和治疗方法尚不清楚,本文通过对PLO的发病机制、临床特点和诊断标准、预防和治疗等进行综述,以提高对PLO的认识和预防。
1 临床特点
1.1 椎体压缩性骨折
典型的PLO患者常在第一次妊娠发病,平均发病年龄31岁、平均哺乳时间4个月,平均产后1~1.5个月发生骨折,且多数患者为多发胸腰椎压缩性骨折,平均3个椎体,可能导致严重的背痛和身高下降,严重降低生活质量,并升高后续骨折的风险[3-5]。PLO椎体骨折的发生是多因素综合作用的结果[6],主要是骨量丢失主要发生在骨小梁部位,以及妊娠对脊柱的机械影响(如体重及腰椎前凸度增加)。少数患者也可发生骶骨及髋部骨折[2,7],表现为下腰痛、臀部疼痛和异常步态。
1.2 BMD下降
双能X线吸收法(dual X-ray absorptiometry,DXA)测定骨密度(bone mineral density,BMD)提示骨量减低。Moller等[8]对153名妇女分别在怀孕前、怀孕期间及产后0.5、4、9、19个月进行了BMD测定,同时对75名年龄匹配的没有怀孕计划的对照组进行了平行跟踪,结果显示与对照组相比,妊娠期腰椎BMD明显下降(1.8±0.5)%,全髋BMD下降(3.2±0.5)%,全身BMD下降(2.4±0.3)%,远端前臂BMD下降(4.2±0.7)%。产后由于母乳喂养的影响,BMD进一步下降。研究[8-10]显示,哺乳期前3个月至6个月骨小梁BMD逐渐减少5 %~10 %,在长时间的母乳喂养中,以小梁骨为主的部位BMD开始恢复,而富含皮质骨的部位BMD进一步下降。
1.3 骨转换标志物变化
从妊娠晚期开始至哺乳期,骨吸收指标(Ⅰ型胶原N-末端交联肽、Ⅰ型胶原C-末端交联肽、血清抗酒石酸酸性磷酸酶)增加[3,11-12],提示哺乳促进了骨吸收,却没有促进骨形成[13]。常合并维生素D不足或缺乏,血生化等指标一般在正常范围。动物实验[14-15]表明,在哺乳期间母体骨骼失去了大量小梁骨量和少量皮质骨量,缺乏1,25(OH)2D则进一步加重了母亲的小梁骨量和皮质骨量丢失,甚至导致严重的组织学骨软化。
2 发病机制
PLO的病理生理机制尚不清楚,可能与妊娠、哺乳状态、遗传因素等相关。
2.1 妊娠期
每个胎儿的骨骼中平均有30 g钙,其中约80%的钙在妊娠晚期从母体中获得[15]。1,25(OH)2D在妊娠期增加2~3倍并且持续到分娩后,在1,25(OH)2D等因素的驱动下,孕妇肠道钙和磷酸盐的吸收在孕期翻倍以满足孕妇和胎儿需要[6]。此外,泌乳素、雌激素等其他激素也可能促进肠道钙吸收的增加[16]。如果钙摄入量不足,母体骨骼会因PTHrP而发生骨吸收增加[17]。乳房和胎盘分泌PTHrP到母体循环中,在妊娠晚期达到最高水平,PTHrP通过PTH/PTHrP受体刺激骨转换,从而模拟PTH(parathyroid hormone,PTH)对同一受体的作用,促进骨吸收,动员骨钙入血[6]。如果孕妇不能摄入足够的钙来满足自己和婴儿的需要,则更有可能发生骨吸收增加和骨量流失[15]。
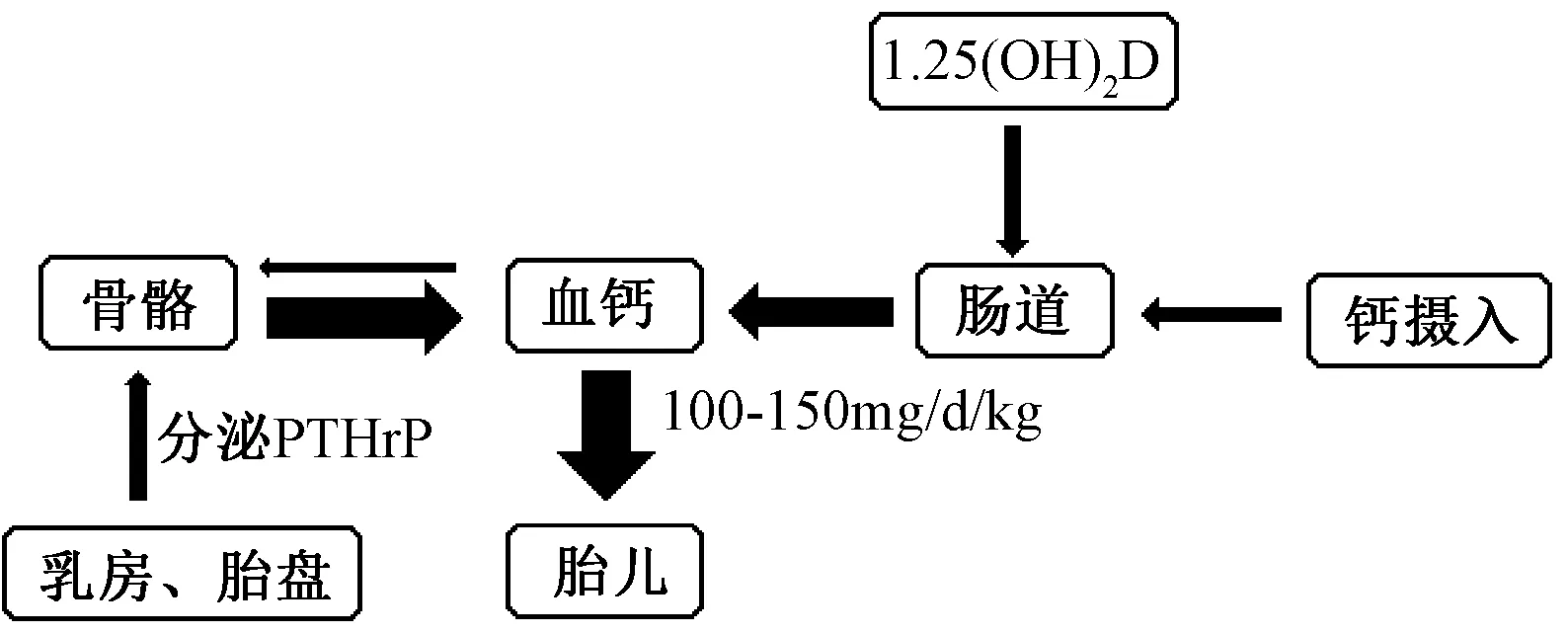
图1 妊娠期通过1,25(OH02D肠道吸收钙加倍,而PTHrP刺激骨转换,动员骨钙入血Fig.1 During pregnancy, the absorption of calcium in the intestine is doubled through 1,25-dihydroxyvitamin D, while PTHrP stimulates bone turnover and mobilizes bone calcium into the blood
2.2 哺乳期
在哺乳期,乳房产生大量的PTHrP,主要通过两种途径促进骨吸收[14,18-19]:一是通过类似PTH的作用,与破骨细胞表面受体PTHr1R 结合,直接作用于破骨细胞,增加破骨细胞的数量并增强破骨细胞的功能,从而促进骨吸收。二是增加骨细胞溶骨,PTHrP结合并激活表达PTHR1受体的骨细胞,骨细胞表达破骨细胞相关基因和酶[包括抗酒石酸磷酸酶(TRAP)和组织蛋白酶K],从其腔隙和周围空间中吸收矿物质,导致骨骼脱矿。骨细胞溶骨可能比破骨细胞对骨小梁的再吸收更快地动员骨骼钙[20]。另一方面,泌乳素在产褥期达到峰值,高水平的泌乳素和哺乳诱导的反馈抑制促性腺激素释放激素的释放,导致低促性腺激素和雌二醇。低雌二醇使成骨细胞增加核因子kappa-B配体(RANKL)的释放,降低骨保护素的生成,进而增加破骨细胞数量并增强破骨细胞功能促进骨吸收[6]。因此高PTHrP和低雌二醇协同骨质流失。动物实验[21]表明,敲除PTHrP基因的小鼠相比较于切除卵巢的小鼠骨质流失更少。因此,PTHrP在导致骨质流失中可能发挥主要的作用。Brembeck等[22]通过HR-pQCT测量胫骨远端结果显示产后骨质明显减少,皮质体积BMD、皮质厚度和胫骨远端超微小梁厚度显著下降,尤其是哺乳时间大于9个月的妇女。动物实验组织形态学研究[15]通过微型计算机断层扫描亦证实了中央椎骨的小梁和皮质内表面的再吸收,骨小梁体积和厚度减少,组织矿化减少,全骨硬度降低。由此,PLO在PTHrP的主导作用下导致骨骼严重脱钙,皮质BMD明显下降,可能倾向为骨软化症。
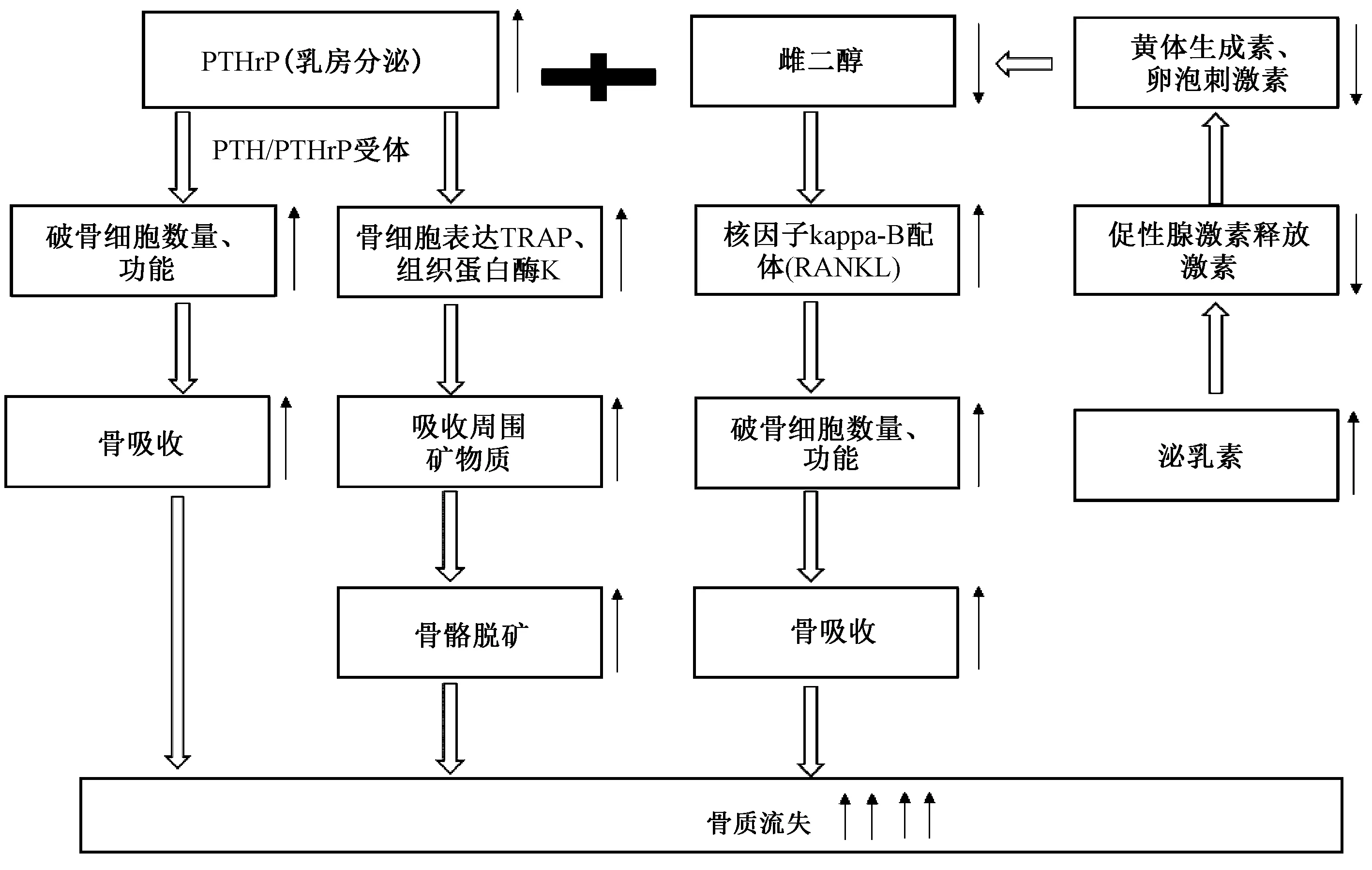
图2 哺乳期骨量丢失的可能机制:高PTHrP和低雌二醇,协同骨质流失Fig.2 Potential mechanism of bone loss in lactation: the synergism of PTHrP at a high concentration and low estradiol leads to bone loss
2.3 遗传因素
Dunne等[23]研究发现,PLO患者母亲骨折患病率明显高于健康对照组,并且大多数在45岁前就发生了骨折。Hardcastle等[4]发现至少40 %的PLO患者的母亲或外祖母有骨折史。说明遗传因素参与了发病,且与母亲骨折史明显相关。
2.4 其他因素
PLO患者经常被发现有其他先前存在的影响骨骼代谢的因素,如低钙摄入、维生素D不足、使用低分子肝素、吸烟、基因突变(如LRP5、COL1A1、COL1A2)、怀孕期间卧床等[4,24-26]。
3 诊断标准
目前PLO尚无统一的诊断标准。结合目前的研究[3,6,27-28],认为在妊娠晚期或产后18个月内发生脆性骨折,DXA提示腰椎、股骨颈、全髋骨密度Z值≤-2.0,除外其他代谢性骨病及继发性骨质疏松,可考虑诊断为PLO。
4 预防与治疗
PLO的防治措施尚无定论,目前尚无随机对照试验或大型队列研究探索药物或外科治疗的疗效。
4.1 预防
应纠正营养缺乏和可能导致骨质流失的其他因素。Cullers等[29]发现钙摄入量充足的妇女与对照组相比,在怀孕期间和产后其Ⅰ型胶原N-末端交联肽明显低于对照组,提示充足的钙摄入可减少骨吸收。Gillies等[30]研究显示,在妊娠期基因敲除Cyp27b1的小鼠,虽然完全缺乏维生素D的作用,通过给予高钙饮食,骨小梁BMD明显增加(+53 %)。因此,补钙是预防与生育有关的暂时性骨量丢失的一种干预措施。若有遗传背景、脆性骨折史等,可考虑避免哺乳以减少骨量丢失。
4.2 治疗
4.2.1终止哺乳:PLO治疗的证据是有限的。研究[16]表明,断奶后PTHrP的突然下降和雌激素水平的恢复诱导破骨细胞广泛快速凋亡,成骨细胞数量显著增加,断奶后6至12个月BMD通常会增加。有观察[31]显示,PLO患者经断奶及补充钙剂及活性维生素D,BMD增加可达10 %~21.4 %。因此,建议PLO患者停止哺乳并补充充足的钙(1 200 mg/d)和维生素D(25OHD水平大于75 nmol/L)。
4.2.2抗骨质疏松药物;目前有较多报道抗骨质疏松药物治疗PLO效果明显,但其病例均不包括未接受抗骨质疏松治疗的对照组,缺乏系统研究。断奶后BMD可自发性升高,因此在断奶后12~18个月不推荐使用抗骨质疏松药物,若之后评估BMD仍明显降低,再考虑使用抗骨质疏松药物,但在育龄期女性中的使用仍有一些顾虑。
双膦酸盐:研究显示[3-5,32],双膦酸盐治疗PLO耐受性好,疗效显著。但使用双膦酸盐存在潜在的问题:PLO骨骼明显脱矿,从机制上更倾向于骨软化,使用双膦酸盐可能是不合适的;其次大多数患者是在第一次妊娠时发病,患者再次妊娠的可能性大,而双膦酸盐在骨骼中的滞留时间很长,它们可以穿过胎盘或间接通过影响母亲血钙和骨骼相关激素影响胚胎骨骼健康。
特立帕肽:使用特立帕肽治疗PLO患者1年后BMD可上升3.0%~34.3 %[5,27]。特立帕肽半衰期短,停用后即可消除对胎儿的影响,但特立帕肽一生中只能使用两年,年轻时使用可能影响未来绝经、老龄后的严重骨质疏松症的治疗。
RANKL抑制剂:Sánchez等[33]报道了2例PLO患者使用迪诺赛麦治疗1年后,HR-pQCT测量骨微结构明显改善。但妊娠期应用迪诺赛麦可通过胎盘,可能降低新生儿体温导致存活率降低[34]。
锶盐:报道显示PLO患者接受雷奈酸锶治疗,腰椎、股骨颈、全髋BMD增加明显[35]。但锶盐被证实可通过胎盘[36],对胎儿可能产生不利影响。
4.2.3椎体压缩性骨折的手术治疗:有报道对产后严重脊柱压缩性骨折患者行椎体成形术治疗[37],但其整体疗效尚不明确。且这些患者年龄比较年轻,骨再生能力强,经卧床休息压缩性骨折基本可自行恢复,因此,一般不推荐手术治疗。
5 总结
PLO是一种罕见的代谢性骨病,在孕前存在低峰骨量或其他影响骨骼代谢的因素下,妊娠哺乳会增加骨吸收导致骨质流失,易致低创伤骨折,但预后良好。断奶后骨量会逐渐恢复,因此建议停止哺乳并补充充足钙剂及维生素D。需充分评估患者临床特点、BMD恢复程度、再发骨折风险及未来怀孕的潜在风险等,权衡利弊,慎重选择治疗方案。目前关于PLO还有很多未知,尚需更多、更大样本、更系统的研究去探讨PLO的机制、临床特点及防治方案。

