EPCs移植对去卵巢大鼠骨质疏松的影响
欧阳利云 唐颖 上官文峰
河南科技大学第三附属医院脊柱外科,河南 洛阳 471003
绝经后骨质疏松症(osteoporosis,OP)的主要特征为全身骨量的逐渐减少,骨组织结构紊乱,骨强度减低,骨的脆性增加,极易发生骨折。其病理机制为骨吸收代谢后,未分化的干细胞不能及时的分化为成骨细胞,导致了骨形成不足[1-3]。近年来对于OP治疗方法有众多的研究,如药物治疗、中医针灸、中药治疗等,但临床治疗效果仍有待进一步提高。干细胞移植治疗为近年来的研究热点[4-5],即通过干细胞移植发挥对骨质疏松的治疗作用。内皮祖细胞(endothelial progenitor cells, EPCs)是一类能够循环、增殖并有着在特定情况下分化为各种细胞的功能[6-7]。本实验通过切除雌性大鼠卵巢,降低大鼠雌激素分泌,从而构建绝经后骨质疏松症大鼠模型,进而通过尾静脉移植同源异体的EPCs,评估该治疗对骨质疏松大鼠TGF-β/Smads通路的影响及治疗效果。
1 材料和方法
1.1 材料及来源
骨密度测定仪器(CHAILENGE双能X线, 法国 GK 公司);胎牛血清(货号16000-044);DMEM培养基(货号11965-092,美国Gibco BRL公司);胰蛋白酶(Amreseo公司);Trizol试剂盒(上海华舜公司);体重计(美国GE公司); BAP酶联免疫测定试剂盒、 CTX-I检测试剂盒、 TRAP5b检测试剂盒(宝生物工程有限公司,大连);TGF-β1、Smad2、Smad3、GAPDH兔抗大鼠多克隆抗体、HRP标记的山羊抗兔IgG(英国Abcam公司);胰蛋白酶、RT-PCR试剂盒(碧云天生物技术有限公司);引物(上海生工);大鼠EPCs(武汉优尔生商贸有限公司)
1.2 方法
1.2.1实验动物与分组:60只Wistar大鼠,均为雌性、未孕,体重220~260 g,由河南科技大学动物实验室提供,生产许可证号:SCXK(豫)2014-0010,实验动物使用许可证号:SYXK(豫) 2014-0014。所有大鼠均在相同条件下进行饲养。随机均分为假手术组、模型组及EPCs组,每组20只。
1.2.2EPCs的复苏及培养:将EPCs恒温水浴箱快速复苏,待细胞完全融化后,离心弃上清,PBS洗涤细胞,以DMEM完全培养液对细胞重悬,调整EPCs浓度至2×l08/L,于37 ℃、5% CO2培养箱内培养,隔2 d换液1次,定期换液及传代,培养1~14 d,观察到细胞的增殖良好。
1.2.3模型的建立:吸入乙醚麻醉后固定大鼠,消毒皮肤后,以腰椎后正中位行皮肤切开,分离腰椎两侧肌肉,暴露并打开腹膜,显露出双侧卵巢。模型组及EPCs组将双侧卵巢完全切除,假手术组同部位、同法切皮,仅切除卵巢周边少许组织,但不行卵巢切除,手术完成后腹腔撒入青霉素粉末,依次逐层缝合组织和皮肤。 1周时进行尾静脉注射治疗,假手术组注射L-DMEM培养液0.5 mL、模型组注射L-DMEM培养液0.5 mL、EPCs组注射EPCs悬液0.5 mL,2×l08个/L,连续注射7 d。
1.2.4测定各组大鼠的体质量:造模后1、4、8、11、13周测定并记录每组大鼠的体质量。过程如下,将体重计置于水平桌面,置“0”后体重计上测定小桶质量并记录,后将各组每只大鼠分别置于小桶中测量并记录,此读数减去小桶质量读数为大鼠体质量,重复3次测定,取均值。
1.2.5ELISA法检测血清 25(OH)D、CTX-I、BAP、TRAP5b的表达变化:13周时,随机取每组各5只大鼠,仰卧位固定后,经大鼠尾静脉通过注射器采血,将血液注入离心管后,离心半径140 mm,离心3 000 r/min,离心15 min。吸取上清液,通过ELISA法行血清25(OH)D、BAP、CTX-I、TRAP5b含量测定,按照试剂盒说明书进行,记录检测结果。
1.2.6骨密度及骨钙含量测定:于造模后第13周,从每组大鼠中随机选5只,通过颈部脱臼法处死。固定后,于无菌条件下取出大鼠的右侧股骨,对大鼠股骨中点进行标记,分别行大鼠右侧股骨中点、远端及近端骨密度检测。经骨密度仪测定并记录结果。取左侧股骨在支架上固定,用手术刀剔除股骨上附着的组织,剔除干净后,用原子吸收法对股骨钙含量进行测定并记录。
1.2.7股骨生物力学检测及HE染色:于造模后第13周,从每组大鼠中随机选5只,通过颈部脱臼法处死。将大鼠在支架上固定,通过手术刀取出大鼠的股骨,用手术刀剔除股骨上附着的组织,然后对股骨的生物力学进行测试,通过三点弯曲实验进行检测,将每组大鼠处理后的股骨放在试验机上测试,加载速度为2.0 mm/min,跨距设置为17 mm,根据结果描绘应力-应变曲线。然后用10%的甲醛行股骨固定,制作股骨组织切片;通过梯度乙醇脱水后,经过石蜡包埋,制作4~ 5 μm厚的连续切片,脱蜡,行HE染色,在光学显微镜下观察。
1.2.8TGF-β1、Smad2、Smad3基因表达检测:将各组剩余大鼠以颈部脱臼法处死,取大鼠椎体组织90 mg,液氮至冻后研磨,按照Trizol 试剂说明书步骤提取椎体组织总RNA,通过紫外分光光度计测定RNA的总含量,通过RT-PCR两步法试剂盒将mRNA反转录为cDNA。TGF-β1上游引物:5′-GTCAGACATTCGGGAGCAG-3′,下游引物:5′-AGACAGAAGTTGGCATGGTAGC-3′,产物长度为558 bp;Smad2上游引物:5′-GACTATACCCTCAATACCAT-3′,下游引物:5′-CGAAAGCCGTACTCCATTCCAG-3′,产物长度为610 bp; Smad3上游引物:5′-ACAATAACTTGGACCTACAGCC-3′,下游引物:5′-GTCAACTGGTAGACAGCCTCA-3′,产物长度为454 bp;内参GAPDH上游引物:5′- GAGGACCAGGTTGTCTCC TG-3′,下游引物:5′- GGATGGAATTGTGAGGGAGA -3′,产物长度为300 bp。PCR反应条件如下:于94 ℃条件下变性,1 min, 55 ℃温度下退火,退火时长为30 s,于72 ℃延伸,延伸1 min,共45个循环。
1.2.9TGF-β1、Smad2、Smad3蛋白表达检测:将RT-PCR提取后的剩余物以1 500 r/min 离心30 min,取上清为粗体蛋白,通过BCA试剂盒行蛋白浓度测定。每组取蛋白40 μg,行10% SDS-PAGE凝胶电泳(条件为65 V,30 min;95 V,90 min),蛋白电泳分离后通过半干法将蛋白电转于硝酸纤维素膜。5%脱脂牛奶室温封闭2 h (或4 ℃过夜);然后加入相应一抗TGF-β1、Smad2、Smad3鼠单抗(1∶100)、GAPDH鼠单抗(1∶800)4 ℃孵育过夜。PBS将未结合的抗体洗去,加入二抗羊抗兔IgG(1∶1 000)孵育1 h,将未结合蛋白洗去,经ECL发光显色后,X线照相后,通过Quantityone 软件行灰度值统计分析。
1.3 统计学处理
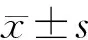
2 结果
2.1 EPCs形态观察
显微镜下观察,培养1周内可见贴壁的EPCs逐渐增多,且体积增大,细胞形态呈纺缍形、多边形或类圆形,见图1 A;继续培养1 周可见贴壁细胞形态呈“铺路石”样的外观,细胞数显著增多,表明细胞增殖良好,见图1B。
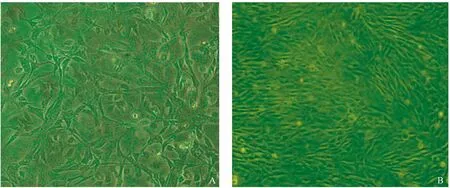
图1 EPCs形态观察 (×100) A:传代1周内的EPCs(×100);B:培养2 周时的EPCs(×100)。Fig.1 Morphological observation of EPCs A: EPCs within 1 week of passage (×100); B: EPCs at 2 weeks of culture (×100).
2.2 各组大鼠的体质量
大鼠的体质量测定结果表明三组大鼠的体重均逐渐增加,符合动物生长规律。于造模后8周起,模型组体质量较假手术组升高(P<0.05),见图2。
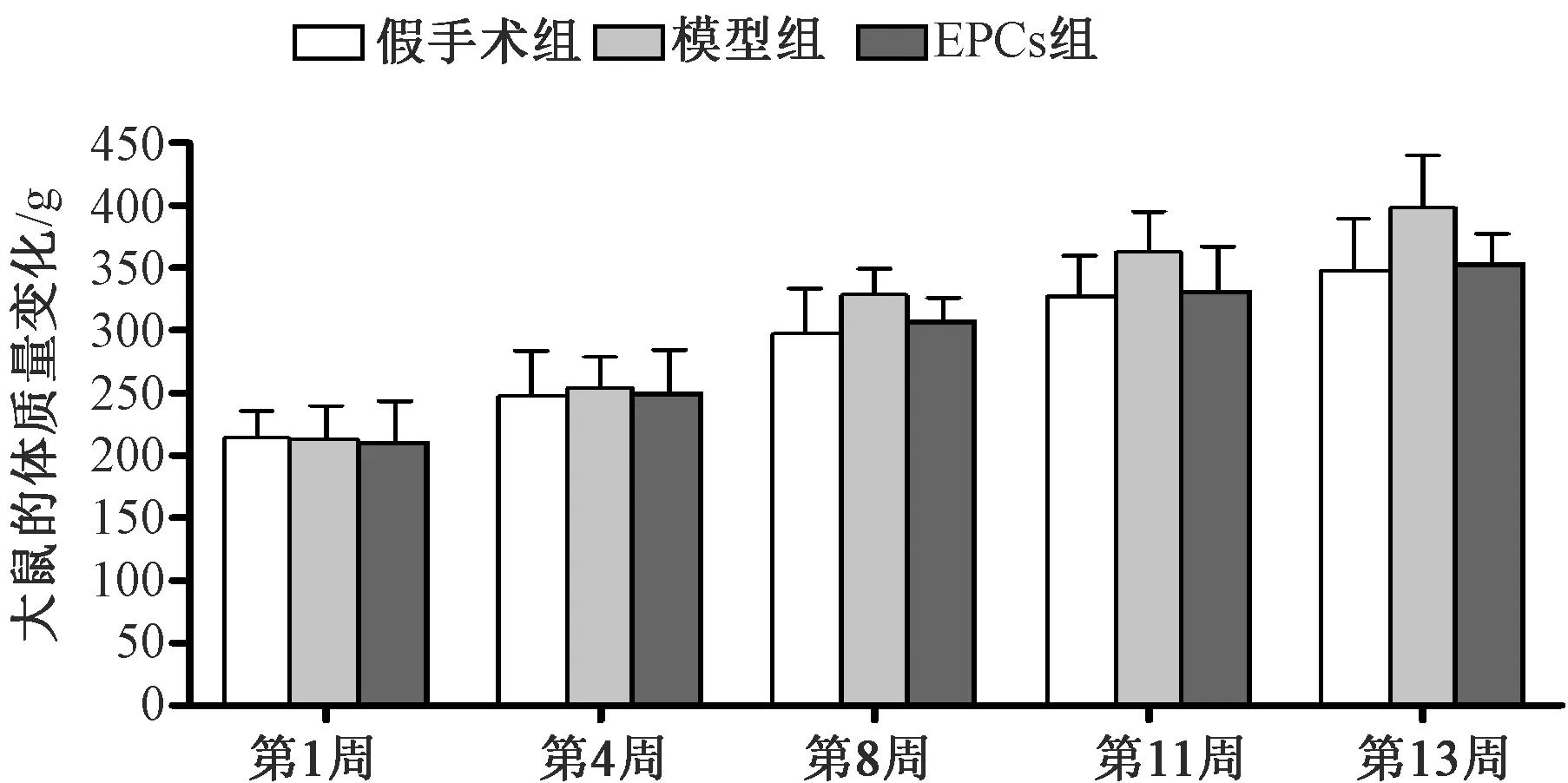
图2 各组大鼠的体质量比较Fig.2 Comparison of body mass in each group of rats
2.3 骨密度及骨钙含量测定
在造模后第13周,模型组股骨骨密度及骨钙含量较假手术组明显降低,差异具有统计学意义(P<0.05);EPCs组股骨骨密度和骨钙含量较模型组显著升高(P<0.05),见表 1。表明EPCs移植治疗能够有效提高去卵巢骨质疏松大鼠骨密度和骨钙含量,发挥治疗作用。
2.4 各组大鼠25(OH)D、CTX-I、BAP、TRAP5b的表达变化
在造模后第13周,与假手术组比较,模型组血清25(OH)D、BAP水平降低,CTX-I、TRAP5b的水平升高(P<0.05)。与模型组比较,EPCs组血清25(OH)D、BAP水平升高,CTX-I、TRAP5b水平降低(P<0.05)。表明EPCs移植治疗能够有效地提高去卵巢OP大鼠血清25(OH)D、BAP水平、降低 CTX-I、TRAP5b水平,见表2。
表1 大鼠股骨BMD值和骨钙含量测定Table 1 BMD and bone calcium content in rat femur
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05。
表2 大鼠血清中25(OH)D、CTX-I、BAP、TRAP5b的表达Table 2 Expression of 25(OH)D, CTX-I, BAP and TRAP5b in rat serum
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05。

图3 大鼠股骨组织病理学形态变化(×100)A:模型组;B:EPCs组;C:假手术组。Fig.3 Pathological changes in rat femoral tissue (×100) A:model group;B:EPCs group;C:sham operation group.
2.5 生物力学性能的变化
在造模后第13周,通过三点弯曲实验检测生物力学性能,显示模型组极限载荷、极限应力和弹性模量明显低于假手术组(P<0.05),EPCs组的极限载荷和弹性模量比模型组有显著增高(P<0.05),见表3。
2.6 HE染色
图3所示13周时,模型组骨小梁有断裂,变稀疏,排列紊乱,间隙增大;EPCs组骨小梁窄较之减轻,部分骨小梁较粗,骨小梁排列较之规则、间隙增小于模型组;假手术组骨组织结构完整,以上病理变化进一步减轻。
表3 大鼠股骨生物力学检测Table 3 Biomechanical testing of rat femur
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05。
2.7 TGF-β/Smad信号通路基因表达影响
图4所示,TGF-β/Smads信号通路检测显示EPCs组TGF-β1及Smad2、Smad3基因表达上调,与模型组相比显著升高,与假手术组相近(P<0.05)。表明EPCs移植可能通过调高TGF-β/Smads通路发挥作用。
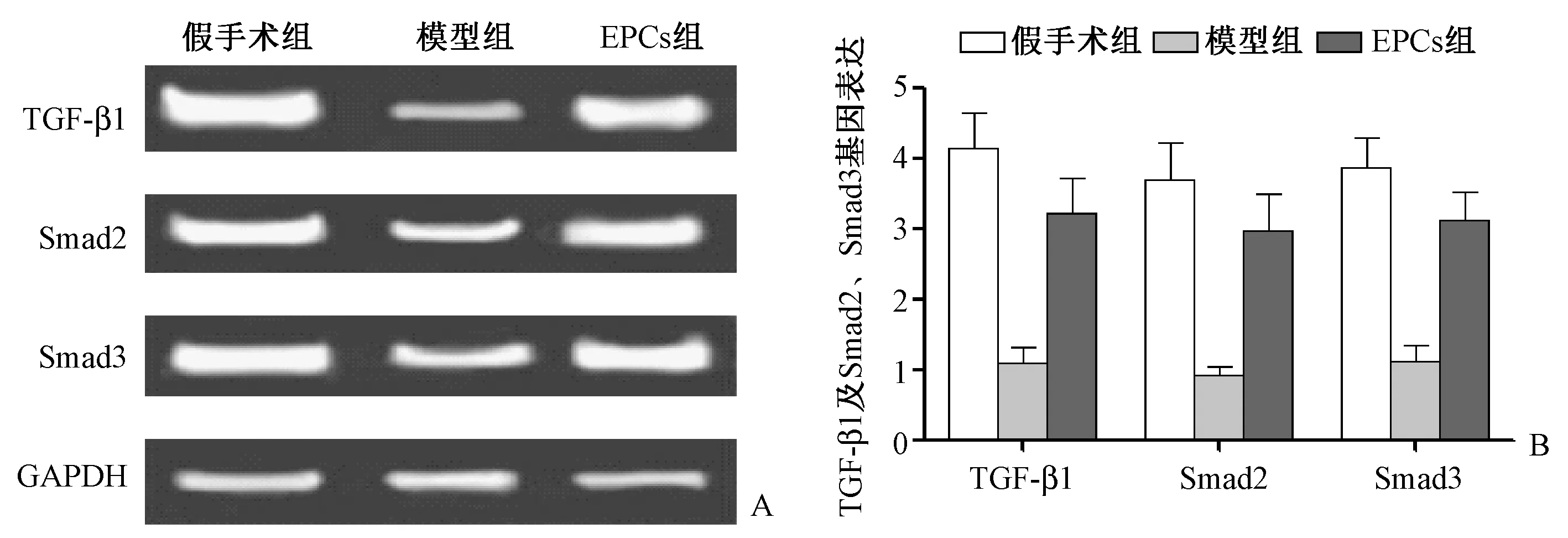
图4 各组椎体TGF-β/Smad基因表达 A:TGF-β/Smad 基因表达条带图;B:TGF-β/Smad 基因表达水平。Fig.4 TGF-β/Smad gene expression in vertebral body of each group A: TGF-β/Smad gene expression band map; B: TGF-β/Smad gene expression.
2.8 TGF-β/Smad信号通路蛋白表达影响
图5所示, TGF-β/Smads信号通路检测显示EPCs组TGF-β1及Smad2、Smad3信号通路蛋白的表达,与模型组相比显著升高,与假手术组相近(P<0.05)。表明EPCs移植可能通过调高TGF-β/Smads通路发挥作用。
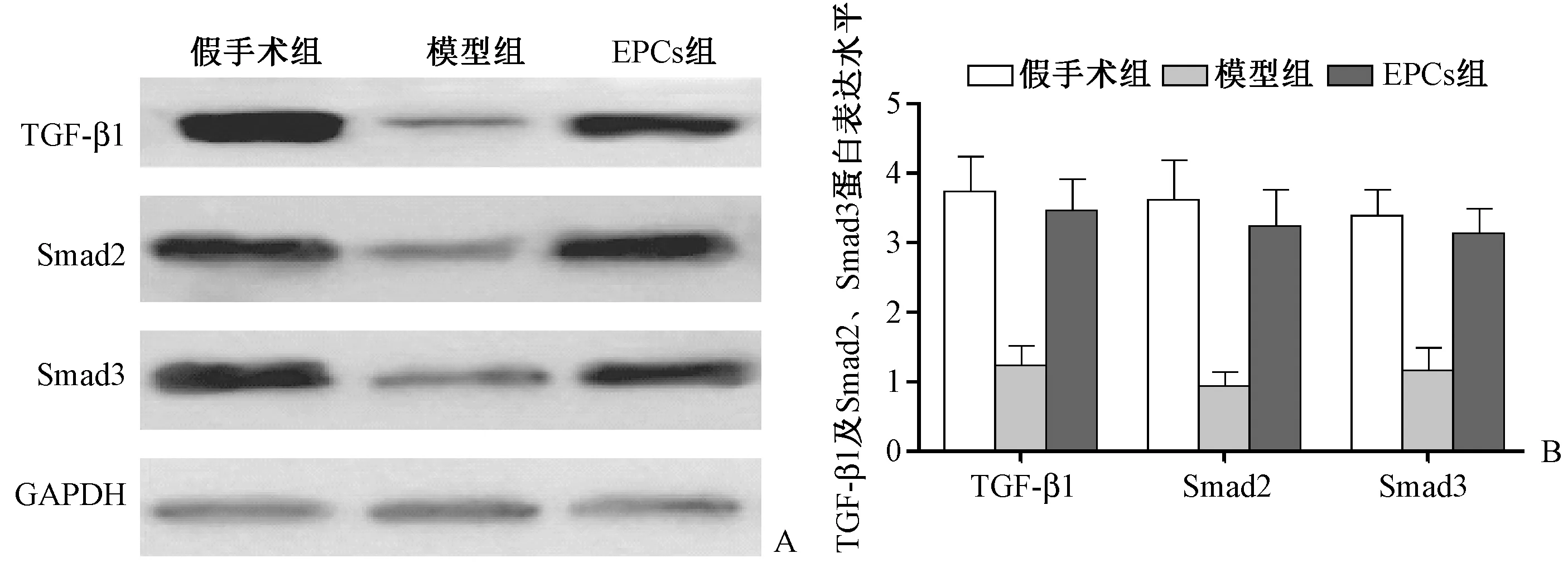
图5 各组椎体TGF-β/Smad蛋白表达 A:TGF-β/Smad 蛋白表达条带图;B:TGF-β/Smad 蛋白表达水平。Fig.5 TGF-β/Smad protein expression in vertebral body of each group A: TGF-β/Smad protein expression band map; B: TGF-β/Smad Protein Expression.
3 讨论
骨质疏松为老年女性常见病之一,其根本原因为女性更年期后,机体雌激素水平逐渐降低[8],骨吸收与骨形成的平衡受到影响,导致骨骼密度和骨钙含量降低,最终骨强度变小,骨脆性增加,极易发生骨折[9]。大鼠卵巢摘除去势手术建立的骨质疏松动物模型,模拟了这一疾病的生理条件和进程,为目前国内外筛选骨质疏松药物和治疗方案的首选动物模型[10]。EPCs是一群具有增生能力和能够分化为血管内皮细胞的潜能干细胞, 能够促进损伤血管的再生,在机体损伤修复过程中扮演着不可缺少的角色,在特定条件下可以分化为多种细胞,因此成为近些年来干细胞研究的热点,并且取得了令人瞩目的成绩[6,11]。最近相关研究[12]表明EPCs还具有分化为造血细胞和成骨细胞的能力。同时临床研究[13]表明老年人骨髓内皮祖细胞的数量与骨密度成显著正相关,表明内皮祖细胞对骨组织新陈代谢可能有正调控作用,能够有效提高老年人的骨量,减轻骨质疏松。由此可以推测若通过静脉移植EPCs、提高体内成骨细胞的数量,可能对骨质疏松发挥治疗作用。
本实验通过大鼠去势建立骨质疏松模型后,经EPCs尾静脉移植进行干预。研究结果显示移植后13周,与模型组相比,EPCs组大鼠血清25(OH)D、BAP水平升高,25(OH)D、BAP为成骨细胞活性增加的重要标志,表明EPCs移植后促进了骨质生成;CTX-I、TRAP5b的表达出现降低,CTX-I、TRAP5b为骨吸收主要标志物,表明EPCs移植后骨吸收减少。本研究显示模型组骨密度和骨钙含量较假手术组明显降低,表明大鼠骨质疏松造模成功。EPCs移植组骨密度和骨钙含量较模型组明显升高,说明EPCs移植对去势骨质疏松大鼠有治疗作用。生物力学检测表明,模型组极限载荷、极限应力和弹性模量明显低于假手术组,EPCs组的极限载荷和弹性模量比模型组有显著增高。进一步在基因蛋白水平对大鼠椎骨TGF-β/Smads信号通路的检测显示,EPCs组TGF-β1及Smad2/3的表达,与模型组相比显著升高,与假手术组相近,表明EPCs大鼠尾静脉移植能够对卵巢骨质疏松大鼠起到有效的治疗作用。
综上,EPCs移植可能通过调控TGF-β/Smads通路发挥治疗去卵巢大鼠骨质疏松症的作用。

