EphB/EphrinB信号通路对成骨分化能力的影响
刘军 李旭升 甄平 田琦 周胜虎 王伟 李玉娟 何晓乐
1. 中国人民解放军联勤保障部队940医院(原兰州军区兰州总医院)全军骨科中心, 甘肃 兰州 730050 2. 中国人民解放军联勤保障部队940医院(原兰州军区兰州总医院)手麻科, 甘肃 兰州 730050 3. 空军军医大学西京医院老年病科,陕西 西安 710032
国内外研究表明,EphB/EphrinB双向信号转导通路可在破骨细胞与成骨细胞之间发挥重要作用,而其中EphB4/EphrinB2双向信号转导通路在解决相同位置上骨吸收转向骨形成的有序性问题中的影响尤为关键。EphB4/EphrinB2信号通路可以接触依赖性的方式存在于成熟破骨细胞与成骨前体细胞之间,在正向正向信号转导促进成骨细胞分化增殖的同时,反向信号转导则可抑制破骨细胞的形成及其骨吸收活性[1-2]。对转基因小鼠的试验结果表明,成骨细胞中特异性EphB4过表达的小鼠最终股骨颈密度显著增加,破骨细胞数量减少、增殖能力明显下降,与骨吸收能力相关的尿液分解标志物脱氧吡啶啉(deoxypyridinoline,DPD)水平降低[3]。既往诸多研究表明,Eph/Ephrin双向信号转导与BMP/Smads、JAK/STATj及MAPK等通路存在交叉作用,彼此之间相互协调,参与调节疼痛、抑郁发生发展、神经-生理学系统等生物行为[4-6],但Eph/Ephrin信号通路在骨平衡及骨生长吸收等过程中的研究尚不深入。Compagni等[7]研究表明,在EphrinB1表达受到抑制的试验小鼠中可出现脊柱及四肢关节骨骼发育异常,其主要特点为脊椎椎体紊乱、关节融合及四肢远端小关节软骨发育不完善等问题,而脊柱及四肢异常骨增生问题同样可出现在EphB2/EphB3受体突变的小鼠中。Davy等[8]的研究发现,在EphrinB1及EphB2/EphB3表达突变的试验小鼠中,可出现颅骨锁骨发育不全及胸骨骨化缺失等骨发育缺陷现象。本研究拟对EphB/EphrinB信号通路和去势小鼠骨髓间充质干细胞的成骨分化能力及绝经后骨质疏松动物模型骨量的相关性进行初步探讨,为EphB/EphrinB信号通路在骨稳态失衡疾病中的作用提供一定试验依据。
1 材料和方法
1.1 主要试剂和仪器
Ficoll细胞分离液购自美国Sigma公司,α-MEM培养基、胎牛血清、青链霉素购自美国Hyclone公司,RNA提取试剂盒购自美国Omega公司,SYBRRPrimeScriptTM RT-PCR Kit购自日本Takara公司,基因引物购自中国上海生工生物公司,倒置相差显微镜购自日本Nikon公司,实时荧光定量PCR试剂盒购自美国Bio-Rad公司。
1.2 小鼠骨髓基质干细胞来源
研究动物购自中国人民解放军联勤保障部队第九四○医院(原兰州军区兰州总医院)实验动物中心,8周龄健康雌性BALB/c小鼠24只,平均体重(20.0±3.2)g,术后10周处死,无菌条件下取小鼠双下肢股骨和胫骨骨髓腔内骨髓,贴壁培养骨髓间充质干细胞,鉴定后方用于后续细胞试验。所有实验动物均按照我国“实验室动物饲养和使用指南”纳入研究,本研究经中国人民解放军联勤保障部队第九四○医院动物伦理委员会批准。
1.3 方法
1.3.1小鼠卵巢去除术:将健康雌性BALB/c小鼠24只随机分为以下两组:假手术组及去势组,每组各12只。采用如下手术方法:① 在小鼠腹腔注射1%戊巴比妥钠(0.1 g/kg)进行常规麻醉;② 对小鼠采用俯卧位,并将其四肢展开后固定于动物手术台上,于肋下1 cm处,脊柱两侧2 cm处剪除毛发,并使用碘附消毒皮肤,然后切开背肌约1 cm,便可见两侧被黄色脂肪组织包绕的卵巢以及紧密相联的子宫角(见图1);③ 用显微器械尺镊将小鼠脂肪组织夹起并拉出创口,于子宫角上部和输卵管近子宫端切断子宫角并将卵巢进行摘除,观察术部无明显出血点后将脂肪组织送回腹腔,逐层缝合皮下组织后,关闭伤口;④ 假手术组仅仅去除卵巢周围脂肪组织后逐层关伤口;⑤ 术后常规肌肉注射青霉素40万单位3 d,1次/d。
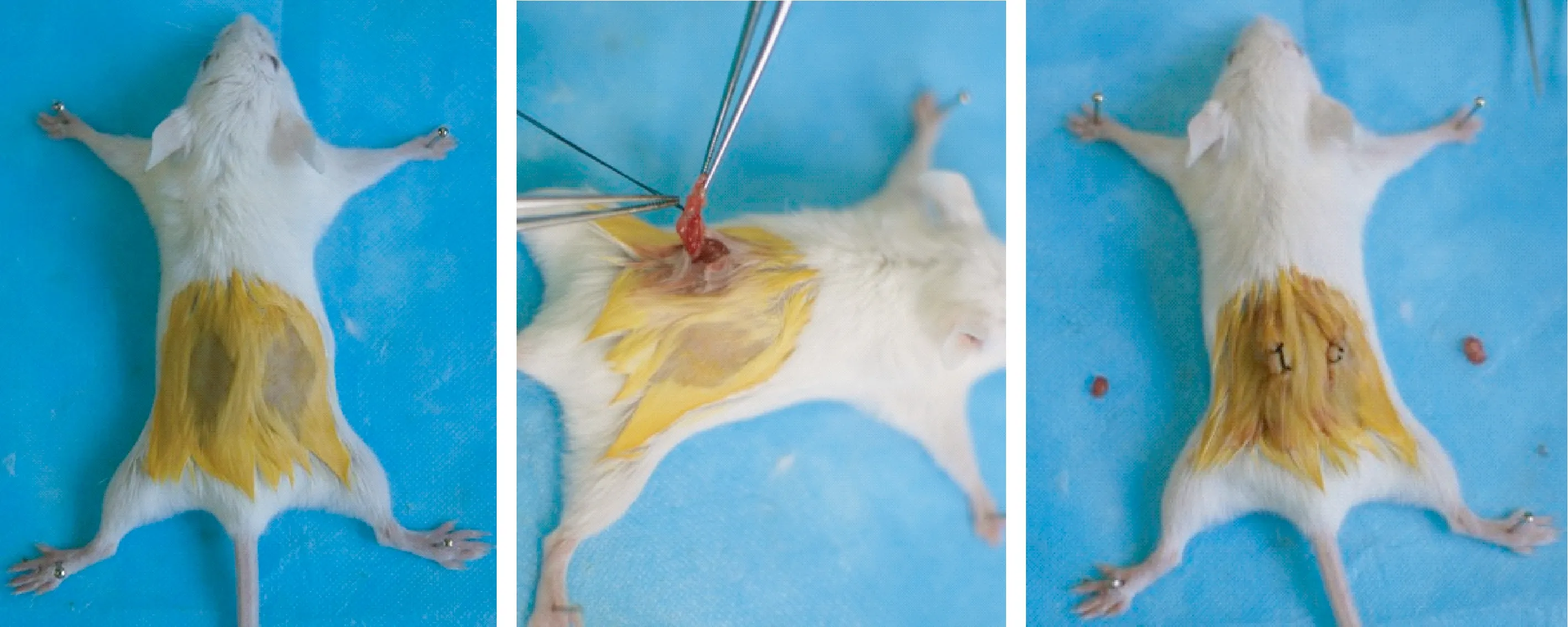
图1 小鼠卵巢摘除术Fig.1 Mouse ovarian ablation
1.3.2腹腔内注射EphB受体激动剂EphrinB-Fc蛋白:将去势组雌性BALB/c小鼠共计12只按随机数字表法分为4组,各组动物分别于术后2、4、6、8周腹腔内注射不同Fc。注射步骤:① 碘附消毒小鼠外侧腹部皮肤;② 各组小鼠称重,用PBS缓冲液溶解不同Fc粉剂,一次性过滤器过滤;③ 使用微量注射器,按1 mg/kg分别给不同处理的小鼠腹腔内注射相应EphB受体激动剂EphrinB-Fc蛋白:EfnB1-Fc组(OVX+EfnB1-Fc组)、EfnB2-Fc组(OVX+EfnB2-Fc组),给予注射EphB受体抑制剂EphB2-Fc组(OVX+EphB2-Fc组),对照组给予注射human IgG-Fc(OVX+Con+Fc组),注射剂量均为0.5 mL,注射部位均选择两大腿根连线与腹中线交叉点外侧约1 cm处,注射后使用棉签压迫注射点30 s。
1.3.3Micro-CT检测动物模型股骨骨量:各组分别注射Fc制剂后,于术后10周将24只小鼠脱颈处死,然后取各组股骨置于Micro-CT扫描试管内进行Micro-CT扫描分析,扫描电压为80 kVp,电流为80 mA。沿着股骨的长轴方向进行扫描,分辨率为1024×1024像素,层间距为15 μm。扫描后所获得的平面采用Microview ABA 2.1.2软件进行三维重建并测定骨密度(BMD)及骨体积分数(BV/TV)。
1.3.4小鼠骨髓间充质干细胞的培养及鉴定:① 取去势组和假手术组术后10周小鼠,每组各为12只,颈椎脱臼处死后,将试验小鼠放置在75%酒精中5 min,在无菌条件下暴露小鼠股骨及胫骨,去除骨组织附带的肌肉和骨膜,切断股骨和胫骨两端,用PBS液冲洗取下标本。② 将4 mL冲洗液缓缓加入盛有等体积Ficoll细胞分离液试管内,后以1 000 r/min将分离液试管离心10 min,试验用滴管抽吸出试管内的乳白色云雾状单核细胞层,PBS液将单核细胞层充分漂洗3次。漂洗后弃去上清的细胞重悬于含10% FBS及100 U/mL青链霉素的α-MEM-低糖培养液,按试验要求的密度在9孔培养基中接种后,置于37 ℃、5% CO2、饱和湿度的培养箱中,平均每3天1次全量换液。③ 待细胞汇合成单层后加入0.25%的胰酶消化,按照1∶2的比例进行传代接种培养(此为第一代P1),以此类推。待培养到P3代,用于后续实验。
1.3.5对培养鉴定后的骨髓间充质干细胞使用实时定量PCR(Realtime-PCR)检测Runx2、ALP、Osterix、OPG及RANKL表达水平:通过SYBR GreenⅠ对基因表达进行行相对定量分析,试验过程遵照ΔΔCt解析研究方法进行全程设计,主要测定在人与小鼠骨髓间充质干细胞表达的骨重建相关EphB/EphrinB信号通路关键分子的表达情况,引物由上海生工生物工程公司合成,见表1。具体实验步骤如下:① RT-PCR检测反应体系,见表2。② Realtime-PCR选择两步法反应程序测定,见表3。③ 选择2-ΔΔCt值法对研究中RT-PCR的试验结果进行分析。
表1成骨细胞与破骨细胞分化相关基因引物
Table1Gene primers of osteogenic and osteoclast differentiation

基因顺序列(5’-3’)反序列(5’-3’)GAPDH Runx2ALPOsterixOPGRANKLaggccggtgctgagtat-gtccttcctcgaacttgatttct-cacaacccagacacaagcattccagaagccatacgctgac-ctttcttcttcaggtttgctgttc-ctattagcattcaggtgtc-caacctgcctgcttcaccaccttctctacaggaatacgcatcacaacaccagcaagaagaagcctttgccaggaaatgagtgagggaagaagtgggatgttttcaagtgcttcaagagagagggctgtgagtt
表2RT-PCR反应液配制表
Table2Table of solution preparation for RT-PCR reaction

试剂使用量(μL)SYBR Premix Ex Taq II (2X)12.5PCR 前引物1PCR 后引物1cDNA模板2无菌水Total8.525
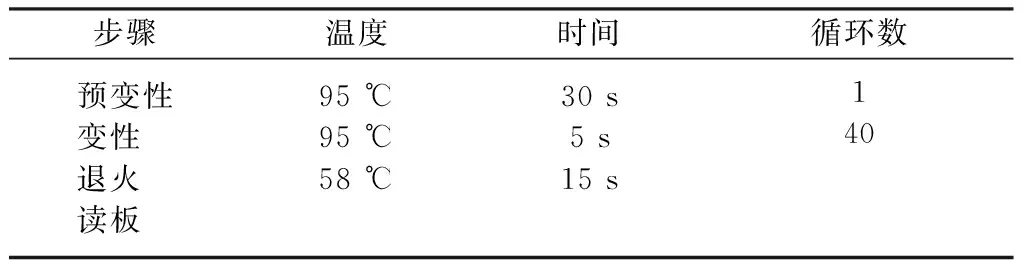
表3 Realtime-PCR反应程序Table 3 Reaction procedure of real-time PCR
1.3.6成骨碱性磷酸酶染色(ALP)及茜素红染色观察成骨分化能力:ALP染色:①细胞成骨诱导14 d后,PBS进行冲洗3遍,4 ℃多聚甲醛固定30 min,PBS再重新冲洗3遍,每次漂洗时间为5 min,选择BCIP/NBT碱性磷酸酯酶显色试剂盒说明书按流程进行显色。② 遵循BCIP/NBT碱性磷酸酯酶显色试剂盒的说明书要求进行染色液的配制。③将配制好的BCIP/NBT染色液加入经过PBS漂洗3次后的细胞中。④将混匀的细胞溶液进行37 ℃下避光保存30 min。⑤将混合细胞溶液中的BCIP/NBT染色液去除,PBS漂洗3遍后进行拍照观察。
茜素红染色:①茜素红染液的配制:称取0.1 g茜素红溶于Tris-HCl 100 mL(pH=8.3)中,4 ℃保存。②将以上成骨培养组培养21 d后,弃去培养基,使用预冷的PBS将细胞洗涤3次,然后加入预冷的多聚甲醛,室温下固定30 min。③加入事先配制好的茜素红染液,室温下进行染色5 min,然后晾干拍照。
1.4 统计学处理

2 结果
2.1 小鼠骨髓间充质干细胞中骨重建相关Eph/Ephrin信号通路表达水平
在小鼠来源的骨髓间充质干细胞中,与假手术组(Sham组)相比较,去势组(OVX组)中EfnA2、EphB4、EfnB2、EfnB1及EphA4表达显著增高(P<0.01),去势组中EphA2及EphB2表达显著降低(P<0.01)。见图2。
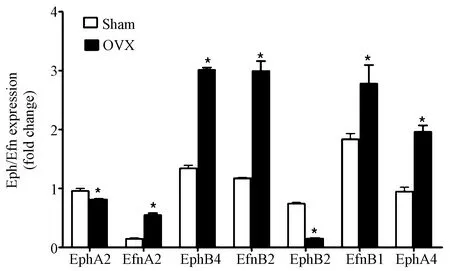
图2 OVX组与Sham组小鼠骨髓间充质干细胞中骨重建相关Eph/Ephrin信号通路表达水平比较注: 与Sham组比较,*P<0.01。Fig.2 Comparison of expression of Eph/Ephrin signaling pathway in bone remodeling between OVX group and Sham group in bone mesenchymal stem cells
2.2 Micro-CT分析检测动物模型股骨骨量结果
各去势组分别注射Fc,于术后10周将小鼠脱颈处死,与OVX human IgG-Fc(OVX+con+Fc)组比较,Sham组、OVX+EfnB1-Fc、OVX+EfnB2-Fc及OVX+EphB2-Fc组骨小梁结构均较完整、骨小梁密度较好(P<0.01)。与OVX+EfnB1-Fc、OVX+EfnB2-Fc去势组相比较,Sham组和OVX+EphB2-Fc去势组的骨密度及骨体积分数均明显增高(P<0.01)。见图3。
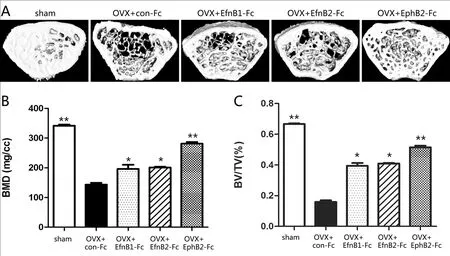
图3 各组小鼠Fc腹腔注射后Micro-CT结果分析注: 与OVX+Con+Fc组比较,*P<0.01;与OVX+EfnB1-Fc 和 OVX+EfnB2-Fc去势组比较,**P<0.01。Fig.3 Analysis of the results of micro-CT after intraperitoneal injection of Fc in mice of each group
2.3 Realtime-PCR检测各组Runx2、ALP、Osterix、OPG及RANKL表达水平
各去势组(EfnB1-Fc、EfnB2-Fc及EphB2-Fc)小鼠原代成骨细胞诱导7 d后,Realtime PCR检测成骨相关基因提示,与去势对照组(Con+Fc组)比较,EfnB1-Fc、EfnB2-Fc和EphB2-Fc去势组中ALP与Osterix的表达水平升高(P<0.01),与EfnB1-Fc去势组比较,EphB2-Fc去势组中ALP与Osterix的表达水平显著升高(P<0.01)。EfnB1-Fc、EfnB2-Fc和EphB2-Fc去势组中RANKL的表达未见明显差异(P>0.05),但OPG的表达水平明显升高(P<0.01),OPG/RANKL的比率明显上调(P<0.01),其中,EfnB1-Fc去势组与EphB2-Fc去势组中OPG/RANKL的比率升高最为明显(P<0.01)。见图4-a、图4-b。
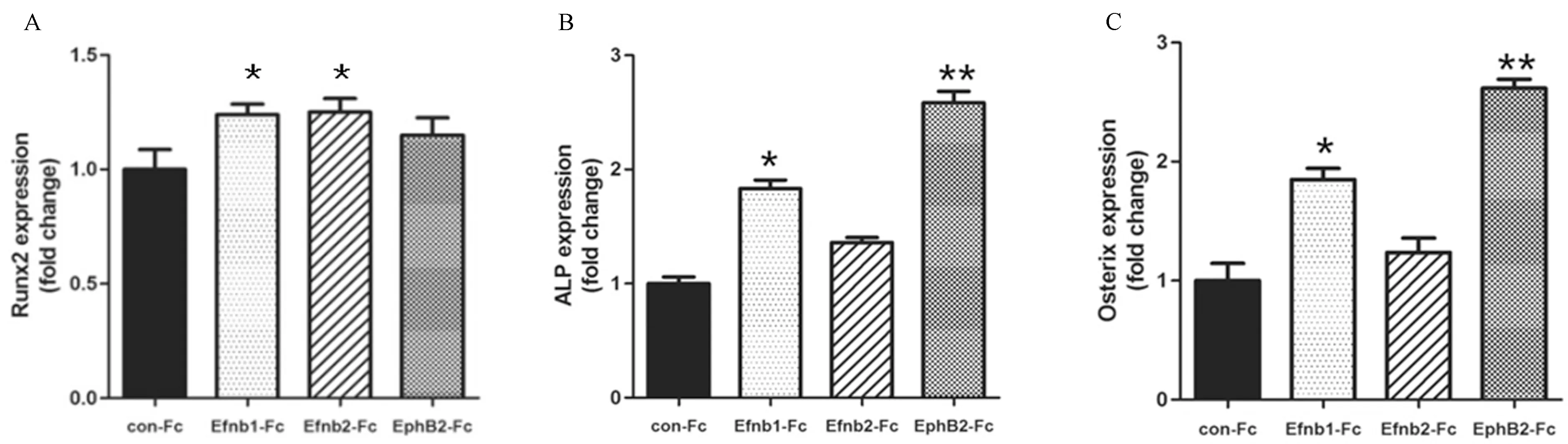
图4-a 各Fc处理组的去势小鼠BMSCs成骨分化相关基因表达比较注:与 Con-Fc组比较,*P<0.01;与EfnB1-Fc组比较,**P<0.01。Fig.4 -a Comparison of osteogenic differentiation-related gene expression in castrated mouse BMSCs between each Fc-treated group

图4-b 各Fc处理组的去势小鼠BMSCs的OPG、RANKL表达比较注:与 Con-Fc组比较,*P<0.01;与EfnB1-Fc组比较,**P<0.01。Fig.4-b Comparison of OPG and RANKL expression in castrated mouse BMSCs between each Fc-treated group
2.4 成骨碱性磷酸酶染色(ALP)及茜素红染色观察各组成骨分化能力
各去势组(EfnB1-Fc、EfnB2-Fc及EphB2-Fc)小鼠原代成骨细胞诱导14 d后进行碱性磷酸酶染色,诱导21 d后进行茜素红染色。与去势对照组(Con+Fc组)比较,EfnB1-Fc和EphB2-Fc去势组中ALP的活性和骨基质矿化能力显著增强(P<0.01),与EfnB1-Fc组相比较,EphB2-Fc去势组的ALP增强最为明显(P<0.01)。见图5。
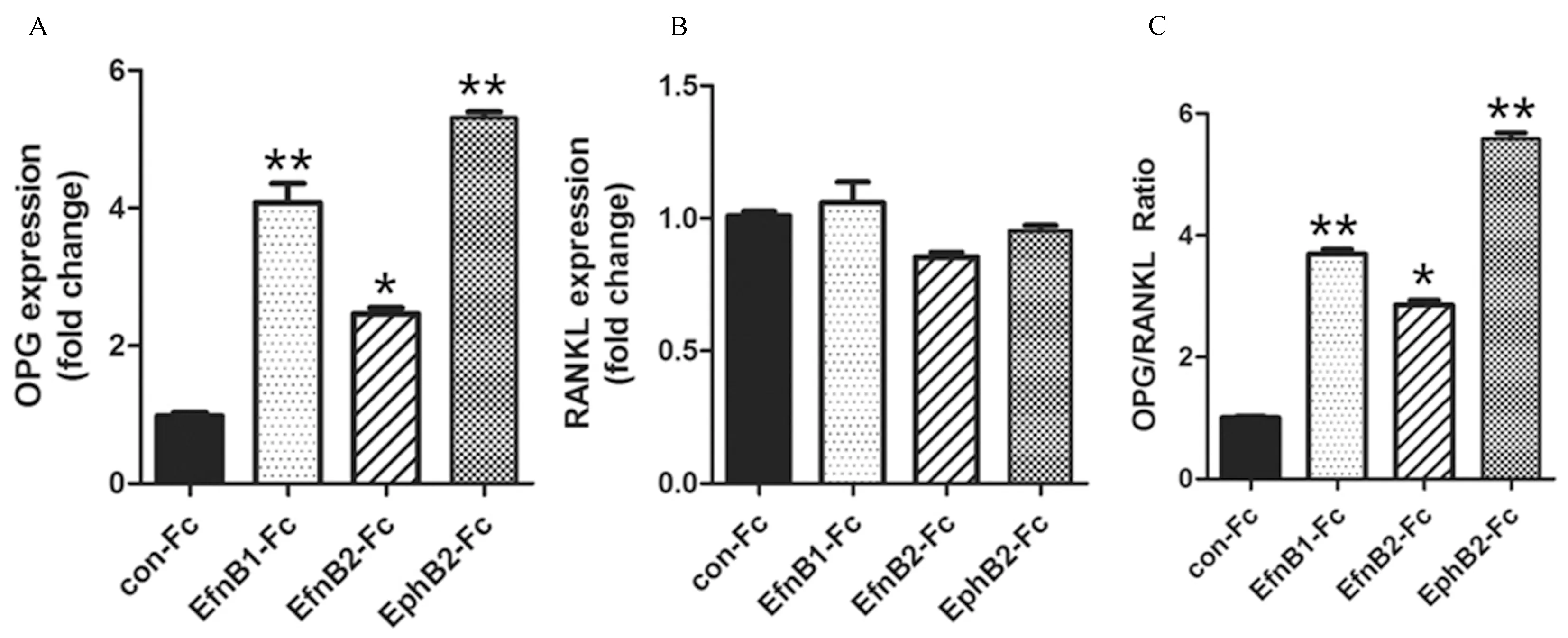
图5 各Fc处理组的去势小鼠BMSCs成骨分化的ALP及茜素红染色结果分析注:与 Con-Fc组比较,*P<0.01;与EfnB1-Fc组比较,**P<0.01。Fig.5 Comparison of ALP and Alizarin red staining results in castrated mouse BMSCs between each Fc-treated group
3 讨论
相关研究表明骨髓间充质干细胞(bone marrow derived mesenchymal stem cells, BMSCs)在体内分化为不同的组织细胞受复杂的调控机制所控制,当调控机制发生紊乱,将会导致相关疾病的发生[9]。BMSCs的分化异常与骨质疏松症的发生密切相关,主要体现为在骨质疏松患者骨髓中成骨分化能力减弱,成脂分化能力增加。目前主要有两种学说:①BMSCs的衰老导致了成熟的骨细胞生成减少,进而造成了骨形成的减弱[10]。在一个多样本的人群研究证实,骨髓间充质干细胞的数量和增殖能力在骨质疏松患者中其数量以及增殖能力均是下降的[11]。在绝经后骨质疏松患者中,骨髓间充质干细胞成骨分化能力也是减弱的,由于成骨细胞分化的减少,使得骨保护素OPG生成减少,这样间接的促进破骨细胞的生成,加速骨量丢失[12]。②在骨质疏松症患者中,骨髓间充质干细胞成脂肪分化的增加抵消了其成骨分化[13]。在老年性骨质疏松骨髓中,脂质积累是增加的,这意味着成骨与成脂之间是负相关的。卵巢切除术引起的骨量的减少同样也被证明脂肪细胞的分化是增加的。因此,通过干预,使得骨髓间充质干细胞成骨分化和成脂分化之间达到平衡,可能会成为一个治疗骨质疏松症新的治疗靶点。
在人类基因组中,Eph(erythropoietin-producing hepatocyte kinases)受体是酪氨酸蛋白激酶受体家族中最大的亚家族,Eph的配体为Ephrin(Eph receptor interacting proteins)[14]。目前研究表明,人类基因组中Eph受体共有14个成员,其中包括2个亚类的EphA(EphA1~EphA8)以及EphB(EphB1~EphB6)[15]。Zhao等[16]团队率先研究报道,在骨吸收与骨形成耦联过程中存在Eph/Ephrin双向信号转导,并影响整个耦联过程。EphB4过表达的转基因小鼠被研究证实骨密度高于对照组小鼠,且其破骨细胞的增殖能力收到明显抑制。Kuroda等[17]对成骨细胞中EphA4研究发现,EphA4蛋白在试验小鼠的成骨及软骨骨化方面发挥重要影响,在成骨细胞和软骨细胞形成的终末期影响更为明显,但与EphA4蛋白相互作用的Ephrin配体尚需进一步研究阐明。
在本研究中发现:在小鼠来源的骨髓间充质干细胞中,去势组小鼠的EfnA2、EphB4、EfnB2、EfnB1及EphA4较假手术组明显表达降低,但去势组中EfnA2及EfnB2相比表达显著升高。使用Micro-CT分析检测动物模型股骨骨量结果提示:各组分别注射Fc,于术后10周将小鼠脱颈处死,加入human IgG-Fc去势组(OVX+Con+Fc组)小鼠的骨小梁结构均破坏严重,骨小梁密度下降。Sham组和加入EfnB1-Fc、EphB2-Fc去势组的骨密度及骨体积分数均明显增高,但EphB2-Fc去势组提高骨密度能力更好。此结果表明小鼠去势后可抑制BMSCs的成骨分化能力,而EphB2-Fc可刺激骨微环境,有利于去势小鼠骨量的维持。我们在体外试验中已验证了EphB2/EphrinB1双向信号通路对去势骨髓间充质干细胞成骨分化能力的作用,体内实验中再次验证其信号通路对去势小鼠骨量丢失的抑制作用,改善了去势小鼠的骨量丢失。采用成骨碱性磷酸酶染色(ALP)、茜素红染色及Realtime-PCR检测Runx2、ALP、Osterix、OPG及RANKL表达水平的研究中结果提示:EfnB1-Fc和EfnB2-Fc组中Runx2表达增高,EfnB1-Fc、EfnB2-Fc和EphB2-Fc去势组中ALP与Osterix的表达水平升高,且EphB2-Fc去势组中ALP与Osterix的表达水平升高最为明显,EfnB1-Fc和EphB2-Fc可显著提高BMSCs成骨分化中ALP的活性和骨基质矿化能力,以EphB2-Fc效果最为显著。EfnB1-Fc、EfnB2-Fc和EphB2-Fc去势组中OPG的表达水平明显升高,进而OPG/RANKL的比率明显上调。其中,EfnB1-Fc去势组与EphB2-Fc去势组中OPG/RANKL的比率升高最为明显。本研究结果显示:①EfnB1-Fc与EphB2-Fc在抑制骨量丢失、促进骨基质矿化能力方面功能相似,其原因两个因素相关,即EphrinB1(EfnB1)上调后可发挥促成骨抑制破骨,以及EphrinB1高亲和结合受体EphB2受到抑制剂作用后反向刺激EphrinB1信号通路,引起EphrinB1上调最终提高成骨分化能力相关。Eph/Ephrin信号通路对骨重建的影响中,当EphrinB2缺乏时,EphrinB1和其他因子可能起到代偿作用。②骨髓间充质干细胞中过表达的Runx2,在骨髓间充质干细胞分化为成骨祖细胞时发挥重要作用,显著的增加骨髓间充质干细胞成骨分化以及骨矿化能力[18]。③ALP作为骨髓间充质干细胞成骨分化早中期的一个标志物,在钙化期开始达到高峰,提高质骨髓间充质干细胞的成骨分化的能力。④Osterix作为Runx2的下游作用元件,在成骨过程中出现的比Runx2晚,Osterix本身作为重要影响因子,可在Runx2促进BMCs分化为成骨祖细胞之后,继续发挥促进前成骨细胞的形成作用,并影响前成骨细胞向功能完善的成骨细胞分化[19]。⑤在成骨与破骨分化过程中,EphB/EphrinB对骨髓间充质干细胞的调节不光局限于成骨分化能力,也间接影响破骨细胞系的分化功能,其中EfnB2-Fc对破骨细胞分化的抑制作用最为显著。⑥EphB/EphrinB双向信号通路中的反向信号转导可通过EphrinB2 C端的YKV基序部位与胞内含PDZ结构域的蛋白质结合作用,其产生的信号向下游转导,对c-Fos-NFATc1转录级联反应过程(负反馈)产生抑制作用,从而降低破骨细胞的分化[20]。⑦经EphB4的正向信号使成骨前体细胞内的成骨分化标志物表达增强,促进了成骨细胞的分化,其胞内转导通路可能是降低RhoA 活性促进成骨能力。
EfnB1-Fc和EphB2-Fc处理可上调去势骨髓间充质干细胞的ALP和Osterix表达,这与Arthur等[21]和 Xing等[22]分别在正常人类骨髓间充质干细胞和正常小鼠骨髓间充质干细胞的研究一致。文献报道在成骨细胞和破骨细胞偶联机制中EphB4/EphrinB2双向信号通路能促进成骨细胞分化,同时抑制破骨细胞分化。对于OPG的上调和EfnB1-Fc和EphB2-Fc处理组一致,提示EfnB2-Fc的作用主要表现应在于对破骨细胞分化的抑制。之所以没有选择EphB4-Fc作为刺激因素是因为EphB4是EphrinB2的主要受体,而EphrinB2的反向信号通路主要发生在破骨细胞中,抑制破骨细胞分化,在成骨细胞系中增加EphB4-Fc并不能起到促进成骨分化作用[23]。
体外试验验证了EphB2/EphrinB1双向信号通路对去势骨髓间充质干细胞成骨分化能力的作用,并且发现EphB/EphrinB通过调节OPG/RNAKL比率影响去势骨髓间充质干细胞的功能,从而间接影响破骨细胞系的分化。本研究证明EphB/EphrinB信号通路的刺激干预可以改善因去势后小鼠骨质疏松症的进一步加剧,阻止了骨小梁的大量破坏和丢失。在早期的研究中,通过骨髓腔内注射技术,对于去势造成的绝经后骨质疏松症模型给予骨髓间充质干细胞注射,有利于小鼠骨量的维持。在研究中,通过腹腔内注射EfnB1-Fc、EfnB2-Fc、EphB2-Fc片段,结合EphB/EphrinB对OPG/RANKL的研究,可以推测EphB2-Fc促进成骨作用比较显著,EfnB2-Fc在调节骨髓间充质干细胞OPG的上调对骨微环境中破骨细胞的分化起到一定的抑制作用,进而减少了骨吸收,维持了骨量。提示EphB/EphrinB信号通路对于去势后破骨细胞系的作用机制应是下一步研究的方向之一。从而使EphB/EphrinB信号通路在整体骨重建过程中的调节作用机制更加明晰。
综上,本研究验证了EphB/EphrinB在去势骨质疏松小鼠中调节骨重建的作用,为进一步将EphB/EphrinB作为治疗绝经后骨质疏松治疗靶点的目标提供了试验依据。

