卵巢癌组织中miR-338-3p、MACC1的表达变化及意义
马涛,李丹,杨翠宏 本溪市中心医院,辽宁本溪117000
卵巢癌是女性常见恶性肿瘤之一,在全球范围内每年新确诊的卵巢癌患者达24万例,每年死亡1.5万例,5年总体生存率不足45%。我国虽然是卵巢癌发病率较低的国家,但近年来卵巢癌发病率及病死率有逐渐上升的趋势[1]。由于卵巢癌发病隐匿,多数患者出现典型的临床症状时已处于晚期,不能进行根治性手术治疗,即使予以放化疗及免疫治疗等,患者的远期预后较差[2]。因此探索卵巢癌发病的分子机制,寻找新的诊治靶点,具有重要的临床意义。微小RNA(miRNA)是一种非编码RNA调节分子,长度约19~25 nt,可结合靶基因mRNA的3′端的非翻译区,通过影响mRNA的稳定性调控基因的表达。研究表明,miRNA在感染、免疫及肿瘤等多种疾病中均发挥重要的调节作用[3,4]。研究发现miR-338-5p在结直肠癌等多种肿瘤中异常表达,并通过影响磷脂酰肌醇-3-激酶表达,促进肿瘤细胞的增殖、侵袭及转移[5]。而目前miR-338-3p在卵巢癌发病中的作用机制尚不清楚。结肠癌转移相关基因1(MACC1)位于7p21.1,其编码蛋白是肝细胞生长因子(HGF)-HGF受体信号通路的关键调节因子,参与细胞生长、血管生成、细胞迁移等生物学行为。MACC1在结直肠癌[6]、肺癌[7]等肿瘤中高表达,促进肿瘤的增殖和转移形成,是预测患者长期生存的独立预测指标。但目前在卵巢癌中miR-338-3p、MACC1的表达及二者之间的关系尚不清楚。本研究通过检测卵巢癌组织中miR-338-3p及MACC1的表达,探讨两者在卵巢癌发生发展及预后中的作用。
1 资料与方法
1.1 临床资料 选取2013年1月~2014年10月于本院行手术治疗的卵巢癌患者91例,年龄30~73(52.5±7.1)岁;体质量指数(22.1±2.27)kg/m2;病理类型:黏液性癌53例,浆液性癌38例;根据国际妇产科联盟(FIGO)分期标准[8]:Ⅰ~Ⅱ期57例,Ⅲ期34例;分化程度:高分化22例,中分化31例,低分化38例;伴腹水42例,不伴腹水49例;伴淋巴结转移39例,无淋巴结转移52例。纳入标准:经病理学检查确诊为卵巢癌;既往未进行手术及放化疗等肿瘤相关治疗;临床病理资料、随访资料完整。排除标准:妊娠期;合并严重的急慢性感染性疾病;合并其他器官恶性肿瘤。同期选择30例子宫良性疾病患者作对照,均行手术治疗,年龄28~70(53.1±6.8)岁;体质量指数(22.6±2.35)kg/m2;病理类型:子宫肌瘤14例,子宫腺肌症16例。两类患者年龄、体质量指数比较差异无统计学意义(P均>0.05)。以上患者均签署知情同意书,本研究经医院医学伦理委员会批准。
1.2 标本采集及保存 于术中取卵巢癌组织标本及对照患者正常卵巢上皮组织,均经病理检查确诊,迅速置于EP管中,置于液氮罐中速冻,于-80 ℃冰箱保存待测。
1.3 卵巢癌组织及卵巢正常组织中miR-338-3p、MACC1 mRNA表达检测 采用qRT-PCR法。取新鲜组织标本50 mg,采用TRIzol(美国Invitrogen公司)法提取组织中总RNA。分光光度计鉴定总RNA的浓度及纯度,吸光度(OD)260/OD280为1.8~2.0。miR-338-3p反转录:以总RNA 2 μg为模板,用TaqMan MicroRNA反转录试剂盒(美国Applied Biosystems公司)进行反转录,合成cDNA。以cDNA为模板,进行qPCR反应,以U6作为内参。MACC1反转录:以总RNA 2 μg为模板,应用Fermentas第一链cDNA反转录试剂盒反转录合成cDNA。qRT-PCR步骤按照SYBR Green PCR试剂盒(Takara)说明书进行操作。miR-338-3p正向引物序列:5′-AACCGGTCCAGCATCAGTGATT-3′,反向引物序列:5′-CAGTGCAGGGTCCGAGGT-3′;U6正向引物序列:5′-CTCGCTTCGGCAGCACA-3′,反向引物序列:5′-AACGCTTCACGAATTTGCGT-3′;MACC1正向引物序列:5′-CATTTTCGGTCAGGAAGAATTGC-3′,反向引物序列:5′-TGGAAGCATTATTACCACGAAGG-3′;β-actin正向引物序列:5′-CATGTACGTTGCTATCCAGGC-3′,反向引物序列:5′-CTCCTTAATGTCACGCACGAT-3′。引物由上海吉凯生物公司设计合成。qPCR反应条件:95 ℃ 10 min,95 ℃变性15 s,60 ℃退火60 s,共40个循环,每个样本重复3次。以2-ΔΔCt法计算miR-338-3p、MACC1 mRNA的相对表达量。
1.4 随访 术后即对卵巢癌患者进行门诊随访,随访时间60个月,每3个月随访1次,随访内容包括患者生存情况、疾病复发等,随访终止时间为2019年10月或患者死亡。

2 结果
2.1 卵巢癌组织与卵巢正常组织中miR-338-3p、MACC1 mRNA表达比较 卵巢癌组织与卵巢正常组织中miR-338-3p相对表达量分别为0.324±0.010、0.832±0.012,MACC1 mRNA的相对表达量分别为0.785±0.021、0.063±0.011。卵巢癌组织中miR-338-3p相对表达量低于卵巢正常组织(t=229.316,P=0.000),MACC1 mRNA相对表达量高于卵巢正常组织(t=243.188,P=0.000)。Pearson线性相关分析结果显示,卵巢癌组织中miR-338-3p与MACC1 mRNA表达呈负相关(r=-0.621,P=0.000)。
2.2 卵巢癌组织中miR-338-3p、MACC1 mRNA表达与患者临床病理特征的关系 卵巢癌组织中miR-338-3p、MACC1 mRNA相对表达量与肿瘤分化程度、FIGO分期及淋巴结转移有关(P均<0.05),与患者年龄、肿瘤病理类型、腹水无关(P均>0.05),见表1。
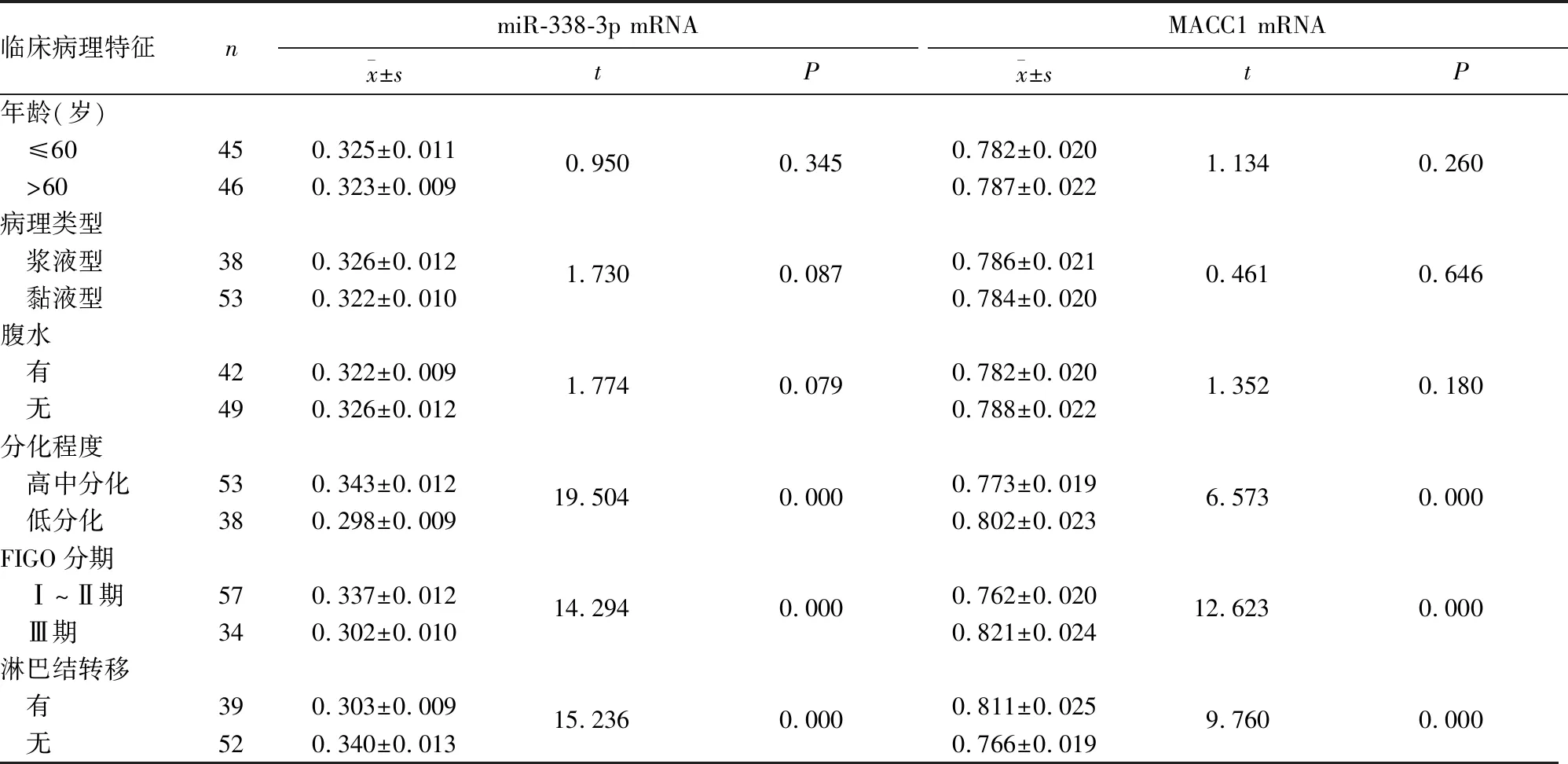
表1 卵巢癌组织中miR-338-3p、MACC1 mRNA表达与患者临床病理特征的关系
2.3 卵巢癌组织中miR-338-3p、MACC1 mRNA表达与患者预后的关系 患者随访7~60(44.1±6.1)个月,随访期间死亡49例。以miR-338-3p相对表达量的均数0.324为界,分为miR-338-3p高表达47例、低表达44例,二者生存时间分别为(51.0±5.2)、(23.4±3.6)个月,比较差异有统计学意义(t=28.532,P=0.000);二者5年总体生存率分别为80.8%(38/47)、25.0%(11/44),比较差异有统计学意义(χ2=3.926,P=0.045)。
以MACC1 mRNA均数0.782为界,分为MACC1 mRNA高表达45例、低表达46例,二者生存时间分别为(22.7±3.3)、(50.3±5.5)个月,比较差异有统计学意义(t=28.948,P=0.000);二者5年总体生存率分别为26.7%(12/45)、80.4%(37/46),比较差异有统计学意义(χ2=4.697,P=0.044)。
3 讨论
近年来随着分子生物学及高通量测序等技术的发展,发现卵巢癌是一种异质性疾病,其发生发展由不同分子机制分子亚型组成,因此针对卵巢癌病因及发病机制的研究逐渐成为近年来的热点[9]。
miRNA通过影响肿瘤细胞上皮-间质转化、血管生成及肿瘤细胞微环境的调控,参与卵巢癌、肺癌等多种恶性肿瘤的侵袭和转移过程,并有望成为新的肿瘤诊断治疗的分子标志物[10,11]。miR-338-3p基因位于染色体17q25.3,在肝细胞癌、非小细胞肺癌及胃癌等多种肿瘤中表达下调,并可通过靶向调控缺氧诱导因子1α、Ras相关蛋白14及细胞周期蛋白D1(Cyclin D1)等基因的表达,促进肿瘤细胞增殖、侵袭和迁移[12,13]。本研究数据表明,在卵巢癌组织中,miR-338-3p的表达明显低于卵巢正常组织。其机制可能是长链非编码(Lnc)RNA对miR-338-3p的表达抑制有关。研究表明,LncRNA SNHG15能作为分子海绵结合并抑制miR-338-3p基因的表达及活性。肿瘤发生时LncRNA SNHG15基因表达升高,导致miR-338-3p表达明显被抑制,其下游癌基因如RAB14的表达升高,肿瘤细胞的的增殖及浸润能力显著增强[14]。本研究中Ⅲ期、低分化及伴淋巴结转移患者卵巢癌组织中miR-338-3p表达显著降低,miR-338-3p表达与肿瘤分期、分化程度及淋巴结转移有关。其原因可能是miR-338-3p能够抑制上皮间质转化过程中的转录因子SOX4的表达有关。研究表明,miR-338-3p能够结合SOX4信使RNA的3′端非编码区,抑制SOX4表达。肿瘤发生时miR-338-3p表达降低后,SOX4表达升高,能够促进上皮性标志E钙黏素等表达减少,而间质性标志波形蛋白表达增多,促进肿瘤细胞的分化程度降低及淋巴结转移[15]。本研究中miR-338-3p低表达患者5年生存时间短、总体生存率明显降低。表明miR-338-3p表达降低与卵巢癌患者的不良生存预后有关,有望成为判断卵巢癌患者预后的重要指标。
MACC1位于人类7号染色体,是HGF-MET信号通路的关键调节因子。MACC1在多种肿瘤中存在过表达现象,并能激活β-钙黏素的表达,促进肿瘤细胞的无限增殖、上皮间质转化、转移、肿瘤干细胞样性质和化学耐药性[16]。本研究中,卵巢癌组织中MACC1表达明显升高,其原因可能与MACC1基因的转录后调控异常有关。研究表明,miR-23b能与MACC1 3′UTR特异性结合,降低MACC1信使RNA的稳定性,减少MACC1的表达。肿瘤发生时miR-23b等表达降低,导致MACC1过表达,促进肿瘤的恶性进展[17]。此外,本研究中MACC1 mRNA表达与肿瘤分期、分化程度及淋巴结转移有关,其机制可能是MACC1过度表达能够促进下游细胞周期蛋白依赖性激酶2(CDK2)、Cyclin D1及基质金属蛋白酶2(MMP2)的表达。研究发现,肿瘤细胞中Cyclin D1及CDK2表达增加能够促进细胞周期由G0期向G2期转换,促进肿瘤细胞的恶性增殖[18];而肿瘤中MMP2的表达促进细胞外基质的降解,进而促进肿瘤的局部浸润及淋巴结转移[19]。本研究中,高表达MACC1的患者5年生存时间短、总体生存率较低。表明MACC1高表达的卵巢癌患者预后不良。MACC1有可能成为新的判断卵巢癌患者预后的因子。
此外,本研究中卵巢癌组织中miR-338-3p与MACC1表达呈明显负相关,可能是MACC1基因表达受miR-338-3p的转录后调控。有研究报道,miR-338-3p能够结合MACC1的信使RNA的3′UTR区,进而促进MACC1信使RNA的降解;而卵巢癌中miR-338-3p表达降低后,对MACC1的表达抑制作用减弱,MACC1表达升高,促进肿瘤的增殖、浸润及远处转移[20]。

