LncRNA FAL1靶向miR-761对骨肉瘤MG63细胞生物学行为的影响
张磊,陈军号,骆浪汉川市人民医院,湖北汉川431600
研究显示,在骨肉瘤组织或细胞中存在着异常表达的长链非编码RNA(lncRNA)和微小RNA(miRNA),而lncRNA、miRNA可通过影响肿瘤相关基因的表达调控细胞生物学过程,在骨肉瘤的发生发展过程中发挥着癌基因或抑癌基因的作用[1~3]。lncRNA是一类长度超过200 nt的长链非编码RNA,不具有编码蛋白质的潜能,但可从转录和转录后水平调控基因表达;miRNA是一类长度约22 nt的短链非编码RNA,可通过抑制靶基因的翻译或将其降解调控靶基因的表达。同时,LncRNA和miRNA之间存在着复杂的调控关系,LncRNA可作为miRNA的分子海绵,通过与miRNA结合调控其表达[4]。功能基因组趋化基因(FAL1)是LncRNA家族成员,在食管癌、非小细胞肺癌和上皮性卵巢癌等肿瘤中异常表达,可通过影响细胞增殖、侵袭、迁移和凋亡等,参与肿瘤的发生发展[5~7]。LncRNA FAL1在骨肉瘤中表达上调,且发挥重要的促癌作用[8]。近年来有研究[9]指出,LncRNA FAL1靶向调控miR-761是其促进口腔鳞状细胞癌发生的重要机制。LncRNA FAL1促进骨肉瘤恶性进展的分子机制是否与miR-761有关尚不清楚。2018年10月~2019年10月,本研究对此作了探讨。
1 材料与方法
1.1 细胞、试剂及仪器 人骨肉瘤细胞系MG63(上海烜雅生物科技有限公司)。青链霉素双抗、DMEM培养基(美国Gibco公司),胎牛血清(杭州四季青生物工程材料有限公司),0.25%胰蛋白酶(北京索莱宝科技有限公司),pcDNA3.1空载体、LncRNA FAL1过表达载体pcDNA3.1-FAL1、LncRNA FAL1干扰序列si-FAL1和阴性对照si-Ctrl(上海吉玛制药技术有限公司),miR-761 mimics、miR-761 inhibitor及阴性对照mimics-NC、inhibitor-NC(百奥迈科生物技术有限公司),PCR引物(上海生工生物工程股份有限公司),脂质体2000和TRIzol(美国Invitrogen公司)。实时荧光定量PCR试剂盒(大连宝生物工程有限公司),CCK-8试剂盒(日本同仁公司),逆转录试剂盒(大连宝生物工程有限公司),荧光素酶检测试剂盒(美国Promega公司),细胞凋亡检测试剂盒、Transwell小室和流式细胞仪(美国BD公司)。倒置显微镜(日本Nikon公司),细胞培养箱(美国Thermo公司),酶标仪(美国BioTek公司),实时荧光定量PCR检测系统(美国Bio-Rad公司)。
1.2 细胞培养 用含10%胎牛血清和100 U/mL的DMEM培养基在饱和湿度、37 ℃、含5% CO2的培养箱中常规培养MG63细胞。待细胞铺满瓶底85%左右时,加入0.25%胰蛋白酶消化,并按照1∶3传代。收集长势良好的第3代对数生长期细胞进行实验。
1.3 细胞转染 LncRNA FAL1:将细胞随机分为Vector组(转染pcDNA3.1空载体)、FAL1组(转染pcDNA3.1-FAL1)、si-FAL1组(转染si-FAL1)、si-Ctrl组(转染si-Ctrl),每组设3个复孔;miR-761:将细胞随机分为si-Ctrl组(转染si-Ctrl)、si-FAL1组(转染si-FAL1)、si-FAL1+inhibitor-NC组(共转染si-FAL1和inhibitor-NC)、si-FAL1+miR-761 inhibitor组(共转染si-FAL1和miR-761 inhibitor),每组设3个复孔。将对数生长期的MG63细胞以每孔1×104个接种至6孔板上,置于饱和湿度、37℃、5% CO2条件下常规培养。待细胞达70%融合度时,根据上述分组参照脂质体2000说明书进行瞬时转染。转染5 h后更换新鲜培养基,继续培养48 h后收集各组细胞进行后期实验。
1.4 细胞内LncRNA FAL1、miR-761表达检测 采用实时荧光定量PCR法。用TRIzol法提取细胞总RNA后,参照逆转录试剂盒说明书将RNA进行逆转录,以逆转录产物cDNA 为模板,GAPDH作内参,参照实时荧光定量PCR试剂盒步骤采用2-ΔΔCt法计算LncRNA FAL1、miR-761相对表达量。LncRNA FAL1 上游引物序列为5′-GCAAGCGGAGACTTGTCTTT-3′,下游引物序列为5′-TTGAACTCCTGACCTCGTGA-3′;miR-761上游引物序列为5′-GCAAGAGGACACACATTGAGAC-3′,下游引物序列为5′-TATTGGGCTGGGTGAAGTTG-3′;GAPDH上游引物序列为5′-GGGAAACTGTGGCGTGAT-3′,下游引物序列为5′-GAGTGGGTGTCGCTGTTGA-3′。
1.5 LncRNA FAL1与miR-761靶向关系检测 采用双荧光素酶报告基因实验。将LncRNA FAL1的3′ UTR序列及其突变序列克隆到psi-CHECK载体荧光素酶报告基因载体中,分别构建FAL1-WT野生型和FAL1-MUT突变型质粒。将对数生长期MG63细胞以每孔1×104个接种至6孔细胞板上后,常规条件下培养过夜。待细胞融合度达70%时参照脂质体2000说明书步骤将FAL1-WT、FAL1-MUT质粒分别与miR-761 mimics、mimics-NC、miR-761 inhibitor、inhibitor-NC共转染至MG63细胞中,分别设3个复孔。转染48 h后,收集各组细胞并按照荧光素酶检测试剂盒说明书检测细胞的荧光素酶活性。
1.6 细胞增殖活力检测 采用CCK-8法。转染48 h,将对数生长期各组细胞以每孔5×103个接种至96孔细胞板上。置于细胞培养箱内常规培养24、48、72、96 h后,参照CCK-8试剂盒说明书采用酶标仪检测各组细胞450 nm波长处的OD值,以OD值表示细胞的增殖活力。
1.7 细胞侵袭、迁移能力检测 采用Transwell小室实验。用无血清培养基将收集的细胞制成密度为1×105个/mL的细胞悬液。在人工基底膜包被(用于细胞侵袭检测)或未包被(用于细胞迁移检测)Transwell小室的上室中每孔加入细胞悬液200 μL,并在小室下室中每孔加入含血清的培养基600 μL。置于细胞培养箱中常规培养过夜后,取出小室。轻轻拭去上室内残留的细胞后,分别采用甲醇、0.5%结晶紫对上室底部细胞进行固定和染色。洗去染色液后,室温下自然晾干,采用倒置显微镜观察每个样品(随机选取3个视野)中的穿膜细胞数。
1.8 细胞凋亡率检测 采用流式细胞术。转染48 h,用磷酸盐缓冲液洗涤细胞后,用结合缓冲液将细胞制成密度为1×106个/mL的细胞悬液。在100 μL细胞悬液中加入5 μL的FITC Annexin V和5 μL碘化丙啶,室温下避光孵育15 min,用流式细胞仪检测各组细胞凋亡情况,计算细胞凋亡率,参照试剂盒说明书进行操作。

2 结果
2.1 LncRNA FAL1对MG63细胞中miR-761表达的影响 与Vector组比较,FAL1组LncRNA FAL1相对表达量高(P<0.05),而miR-761相对表达量低(P<0.05);与si-Ctrl组比较,si-FAL1组LncRNA FAL1相对表达量低(P<0.05),而miR-761相对表达量高(P<0.05)。见表1。

表1 各组LncRNA FAL1、miR-761表达比较
注:与Vector组比较,*P<0.05;与si-Ctrl组比较,#P<0.05。
2.2 LncRNA FAL1与miR-761的靶向关系 生物信息学软件DIANA-lncBase Predicted v2、starBase v2.0和miRcode数据库软件预测到LncRNA FAL1 3′UTR与miR-761存在互补的结合位点。双荧光素酶报告基因实验进一步检测结果显示,与mimics-NC组比较,miR-761 mimics组转染FAL1-WT质粒荧光素酶活性低(P<0.05);与inhibitor-NC组比较,miR-761 inhibitor组转染FAL1-WT质粒荧光素酶活性高(P<0.05);但miR-761对转染FAL1-MUT质粒细胞的荧光素酶活性无影响(P均>0.05)。见表2。

表2 各组双荧光素酶活性比较
注:与mimics-NC组比较,*P<0.05;与inhibitor-NC组比较,#P<0.05。
2.3 LncRNA FAL1通过靶向miR-761对MG63细胞增殖的影响 与si-Ctrl组比较,细胞培养48、72、96 h si-FAL1组细胞增殖活力低(P均<0.05);与si-FAL1组比较,细胞培养48、72、96 h si-FAL1-miR-761 inhibitor组细胞增殖活力高(P均<0.05),但si-FAL1-inhibitor-NC组细胞增殖活力无明显变化(P均>0.05)。见表3。

表3 各组细胞增殖活力比较
注:与si-Ctrl组比较,*P<0.05;与si-FAL1组比较,#P<0.05。
2.4 LncRNA FAL1通过靶向miR-761对MG63细胞侵袭迁移的影响 与si-Ctrl组比较,si-FAL1组侵袭、迁移细胞数量少(P均<0.05);与si-FAL1组比较,si-FAL1-miR-761 inhibitor组侵袭、迁移细胞数量多(P均<0.05),但si-FAL1-inhibitor-NC组侵袭、迁移细胞数量差异无统计学意义(P均>0.05)。见表4。
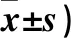
表4 各组细胞侵袭迁移数量比较(个,
注:与si-Ctrl组比较,*P<0.05;与si-FAL1组比较,#P<0.05。
2.5 LncRNA FAL1通过靶向miR-761对MG63细胞凋亡的影响 si-Ctrl组、si-FAL1组、si-FAL1-inhibitor-NC组、si-FAL1-miR-761 inhibitor组细胞凋亡率分别为(4.65±0.45)%、(21.23±2.10)%、(24.16±2.41)%、(13.88±1.38)%。与si-Ctrl组比较,si-FAL1组细胞凋亡率高(P<0.05);与si-FAL1组比较,si-FAL1-miR-761 inhibitor组MG63细胞凋亡率低(P<0.05),但si-FAL1-inhibitor-NC组MG63细胞凋亡率差异无统计学意义(P>0.05)。
3 讨论
骨肉瘤是最常见的一种原发性骨肿瘤,在儿童和青少年中的发病率较高。目前,手术联合化疗是骨肉瘤治疗的重要手段,但对于转移性或复发性患者的治疗效果并不理想[10],其5年内生存率60%左右[11]。因此,深入探讨骨肉瘤发生发展的分子机制,探索新的治疗策略和方法对打破骨肉瘤治疗瓶颈十分必要。LncRNA是一类与骨肉瘤发生发展密切相关的非蛋白质编码的RNA分子,其异常表达可通过影响细胞增殖和转移等过程发挥致癌或抑癌的作用,是导致骨肉瘤发生发展的重要指标之一,不仅可作为早期诊断或预后的重要标志物,也是骨肉瘤靶基因治疗的重要靶标[12,13]。
LncRNA FAL1是LncRNA家族中的一员,可通过调控细胞增殖、侵袭、迁移和凋亡等,在结肠癌、宫颈癌和乳头状甲状腺癌等肿瘤恶性进展中发挥重要的促进作用[14~16]。近年有研究[8]显示,LncRNA FAL1在骨肉瘤组织和细胞中异常高表达,且其表达水平的改变与肿瘤转移、分期和生存率密切相关;而干扰其表达可通过抑制细胞增殖、侵袭、迁移和上皮间质转化抑制骨肉瘤的恶性进展,被认为可能是骨肉瘤潜在的治疗靶点。
miR-761是miRNA家族中的一员,在肺癌、结直肠癌和肝癌等肿瘤中异常表达,可通过调控细胞增殖、侵袭、迁移和凋亡等发挥着致癌或抑癌基因的作用[17~19]。已有研究[20]证实,miR-761在骨肉瘤中表达下调,与肿瘤大小和分期密切相关;且上调其表达可抑制癌细胞增殖和侵袭。本研究通过生物信息学软件预测到LncRNA FAL1 3′UTR与miR-761存在互补的结合位点,采用双荧光素酶报告基因实验证实LncRNA FAL1可直接靶向miR-761;同时,LncRNA FAL1过表达可使骨肉瘤MG63细胞中miR-761表达降低,而LncRNA FAL1低表达可使MG63细胞中miR-761表达升高。这表明在骨肉瘤MG63细胞中LncRNA FAL1可靶向调控miR-761表达。此外,本研究转染LncRNA FAL1干扰序列si-FAL1后发现,骨肉瘤MG63细胞增殖能力明显减弱,而转染miR-761 inhibitor可逆转si-FAL1对MG63细胞增殖的抑制作用。该结果与Ye等[9]在口腔鳞癌机制研究中得出的沉默LncRNA FAL1表达可靶向调控miR-761抑制癌细胞增殖的结果相一致。另外,本研究还发现si-FAL1可抑制MG63细胞侵袭、迁移并促进细胞凋亡,而miR-761 inhibitor可逆转si-FAL1的上述作用。这提示LncRNA FAL1可通过靶向调控miR-761影响细胞增殖、侵袭、迁移和凋亡参与骨肉瘤的发生发展。
综上所述,LncRNA FAL1在骨肉瘤MG63细胞中发挥重要作用,干扰其表达可通过靶向miR-761表达抑制骨肉瘤MG63细胞增殖、侵袭、迁移并促进其凋亡。该结果进一步丰富了LncRNA FAL1调控骨肉瘤发生发展的分子机制,也为LncRNA FAL1有望成为骨肉瘤治疗的潜在靶点提供了新的参考。

