缺氧诱导的miRNA-210靶向HIF-1α促进胃癌发展机制研究
贾国炳
胃癌起源于胃黏膜上皮的恶性肿瘤,在全球恶性肿瘤中发病率第四位,在中国占首位,40%患者确诊时胃癌已发生转移[1],严重影响患者生命安全。肿瘤生长需要氧气的供应,但随着实体瘤的生长,多种结构异常导致肿瘤组织中氧分压低于正常组织[2]。低氧微环境是实体瘤的常见特征,低氧时最先刺激低氧诱导因子(hypoxia inducible factor-1,HIF-1)过表达,进而促进细胞增殖和迁移[3]。同时低氧时多种微小RNA(microRNA,miRNA)表达异常,miR-210是缺氧诱导的miRNA之一,缺氧时在胃癌组织中高表达,与胃癌组织的发生、发展有关[4]。但miR-210与HIF-1α在低氧条件下对胃癌细胞的影响尚不明确。因此本研究以人胃癌细胞系SGC-7901为研究对象,检测低氧条件下miR-210和HIF-1α的变化与细胞增殖、迁移的关系,为寻找新的胃癌靶基因位点提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞:人胃癌细胞SGC-7901购自中国科学院上海细胞库。
1.1.2 主要试剂:氯化钴(CoCl2)购自苏州斌顺化工有限公司,货号:7646-79-9。RPMI1640培养基、胎牛血清(fetal bovine serum,FBS)、二甲基亚砜(dimethyl sulfoxide,DMSO)、Trizol均购自美国ThermoFisher公司。CCK-8试剂盒、蛋白提取试剂盒、BCA试剂盒、PVDF膜均购自碧云天生物科技有限公司,货号分别为:C0037、P0033、P0012S、FFP32。miRVana miRNA提取试剂盒购自美国Ambion公司。2×Hi SYBR Green QPCR Mix购自日本TaKaRa公司,货号:ARR041A。一抗HIF-1α(抗鼠)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(抗兔)、胰岛素样生长因子Ⅱ mRNA结合蛋白3(insulinlike growth factorⅡ mRNA-binding protein 3,IMP3)(抗兔)、β-连环蛋白(β-catenin)(抗兔)、内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(抗兔)均购自美国Abcam公司,克隆号分别为:H1alpha67、EPR3821、EPR12021、E247、EPR16891。脱脂奶粉购自美国BD公司。二氨基联苯胺(Diaminobenzidine,DAB)显色试剂购自索来宝科技有限公司。antagomic miR-210试剂购自广州锐博生物科技有限公司,引物由上海生工生物公司合成。
1.1.3 仪器:CO2培养箱购自德国WIGGENS公司,型号:WCI-180。酶标仪购自美国BIO-RAD公司,型号:550。Transwell小室购自美国Costar公司,型号:3421。普通光学显微镜购自美国Olympus 公司,型号:XK-SW002。实时荧光定量PCR(qRT-PCR)仪购自美国ABI公司,型号:7500。蛋白凝胶成像仪购自上海Tanon公司,型号:5200。
1.2 方法
1.2.1 细胞培养与处理:①细胞培养:RPMI1640培养基中加10%FBS制成完全培养基,4℃冰箱保存待用。SGC-7901从液氮中取出,37℃水浴锅中复苏,10 ml离心管中加8 ml RPMI1640完全培养基,SGC-7901加入其中去除DMSO。RPMI1640完全培养基重悬SGC-7901置CO2培养箱(5%CO2,37℃)中常规培养,传2~3代后收集对数生长期细胞进行实验。②细胞处理:生长良好的SGC-7901接种于6孔细胞板中,待密度至60%时RPMI1640完全培养基稀释CoCl2,制成CoCl2终浓度分别为0、100、150、200、300 μmol/L,RPMI1640完全培养基分别加入培养孔中,作用3 h后更换为RPMI1640完全培养基进行后续实验。
1.2.2 CCK-8法检测细胞增殖能力:1.2.1处理过的细胞接种至96孔板(5.0×104个/孔),RPMI1640完全培养基为空白对照,每孔100 μl,6个重复。置CO2培养箱中培养48 h后,加入CCK-8试剂继续培养2 h,酶标仪检测450 nm下各孔细胞光密度(optic density,OD),OD450=实验孔OD450-空白对照孔OD450。
1.2.3 Transwell实验检测细胞迁移能力:Transwell置于24孔板中,每孔加1 ml只含RPMI1640的培养基置于CO2培养箱平衡1 h,取出小室风干备用。新的24孔板每孔加500 μl RPMI1640完全培养基,1.2.1处理过的细胞用只含RPMI1640的培养基制成悬液接种于Transwell小室上层(3×103个/孔),整个过程无菌操作。置CO2培养箱中培养48 h后取出Transwell小室,置于0.1%结晶紫中染色5 min,清洗多余结晶紫后光学显微镜下拍照并计数发生迁移的细胞数量。
1.2.4 qRT-PCR检测细胞中miR-210水平:1.2.1处理过的细胞接种至6孔板中加RPMI1640完全培养基,待细胞密度至80%~90%时做qRT-PCR实验。每个孔中加1 ml Trizol裂解细胞并提总RNA,100 ng miRVana miRNA提取试剂盒提取cDNA,qRT-PCR仪对miR-210、内参U6扩增。引物序列:hsa-miR-210-F:5’-ATGTTGGCCCTGGTGA-3’,hsa-miR-210-R:5’-TGGCTGTGTAGGGTCG-3’;hsa-U6-F:5’-TGCTGGGGCTTTCCGGCAGCGC-3’,hsa-U6-R:5’-CCCAGTGAGGTCCGGAGGT-3’。上样体系:cDNA 1 μl,F/R(10 μmol/L)各0.5 μl,2×Hi SYBR Green QPCR Mix 10 μl,ddH2O 8.0 μl。反应条件:95℃、5 min;95℃、10 s,58℃、25 s,45个循环。2-ΔΔCT法计算细胞中miR-210水平。
1.2.5 蛋白免疫印迹(western blot,WB)检测细胞中HIF-1α、PCNA、IMP3、β-catenin蛋白表达:按1.2.4操作,待细胞密度至80%~90%时做WB实验。蛋白提取试剂盒提取细胞总蛋白,BCA试剂盒测定蛋白总浓度,处理蛋白使每孔总蛋白浓度相同。每孔上样30 ng,PAGE胶分离蛋白质,PVDF膜280 mA 45 min转膜;5%脱脂奶粉室温封闭2 h;对应加入一抗HIF-1α(1∶400)、PCNA(1∶1 000)、IMP3(1∶2 000)、β-catenin(1∶5 000)、GADPH(1∶10 000)4℃孵育过夜;对应加入二抗,室温孵育1 h。DAB显色试剂显色,蛋白凝胶成像仪拍照和定量分析。
1.2.6 细胞转染:细胞处理后接种于6孔板,待密度至80%更换为只含RPMI1640的培养基。LipofectamineTM3000法转染,按照试剂盒说明书操作。分为miR-210阴性对照(antagomic NC)组和miR-210抑制(antagomic miR-210)组,分别转染终浓度为100 nmol/Lantagomic NC和antagomic miR-210,另设不转染组作为对照。转染6 h后观察细胞形态,更换为RPMI1640完全培养基。置CO2培养箱中48 h后WB检测HIF-1α蛋白表达。

2 结果
2.1 不同缺氧浓度下胃癌细胞SGC-7901增殖情况 与0 μmol/L CoCl2组比较,100、150、200、300 μmol/L CoCl2组OD450升高(P<0.05);与100 μmol/L CoCl2组比较,150、200、300 μmol/L CoCl2组OD450升高(P<0.05);与150 μmol/L CoCl2组比较,200、300 μmol/L CoCl2组OD450升高(P<0.05);与200 μmol/L CoCl2组比较,300 μmol/L CoCl2组OD450升高(P<0.05)。见表1。
表1 不同缺氧浓度下胃癌细胞SGC-7901增殖情况比较
注:与0 μmol/L CoCl2组比较,*P<0.05;与100 μmol/L CoCl2组比较,#P<0.05;与150 μmol/L CoCl2组比较,△P<0.05;与200 μmol/L CoCl2组比较,☆P<0.05
2.2 不同缺氧浓度下胃癌细胞SGC-7901迁移情况 与0 μmol/L CoCl2组比较,其余4组迁移细胞数量升高(P<0.05);与100 μmol/L CoCl2组比较,150、200、300 μmol/L CoCl2组迁移细胞数量升高(P<0.05);与150 μmol/L CoCl2组比较,200、300 μmol/L CoCl2组迁移细胞数量升高(P<0.05)。见图1,表2。

图1 不同缺氧浓度下胃癌细胞SGC-7901迁移情况比较(结晶柴染色×200)
表2 不同缺氧浓度下胃癌细胞SGC-7901迁移个数比较
注:与0 μmol/L CoCl2组比较,*P<0.05;与100 μmol/L CoCl2组比较,#P<0.05;与150 μmol/L CoCl2组比较,△P<0.05;与200 μmol/L CoCl2组比较,☆P<0.05
2.3 miR-210在不同缺氧浓度下胃癌细胞SGC-7901中的表达 与0 μmol/L CoCl2组比较,100、150、200、300 μmol/L CoCl2组miR-210表达水平升高(P<0.05);与100 μmol/L CoCl2组比较,150、200、300 μmol/L CoCl2组miR-210表达水平升高(P<0.05);与150 μmol/L CoCl2组比较,200、300 μmol/L CoCl2组miR-210表达水平升高(P<0.05);与200 μmol/L CoCl2组比较,300 μmol/L CoCl2组miR-210表达水平升高(P<0.05)。见表3。
表3 miR-210在不同缺氧浓度下胃癌细胞SGC-7901中表达水平比较
注:与0 μmol/L CoCl2组比较,*P<0.05;与100 μmol/L CoCl2组比较,#P<0.05;与150 μmol/L CoCl2组比较,△P<0.05;与200 μmol/L CoCl2组比较,☆P<0.05
2.4 HIF-1α在不同缺氧浓度下胃癌细胞SGC-7901中的表达 与0 μmol/L CoCl2组比较,150、200、300 μmol/L CoCl2组HIF-1α表达水平升高(P<0.05);与100 μmol/L CoCl2组比较,150、200、300 μmol/L CoCl2组HIF-1α表达水平升高(P<0.05);与150 μmol/L CoCl2组比较,200、300 μmol/L CoCl2组HIF-1α表达水平升高(P<0.05)。见图2,表4。

图2 HIF-1α在不同缺氧浓度下胃癌细胞SGC-7901中的表达比较
2.5 不同缺氧浓度下胃癌细胞SGC-7901中PCNA、IMP3、β-catenin的表达 与0 μmol/L CoCl2组比较,100 μmol/L CoCl2组PCNA、β-catenin,150、200、300 μmol/L CoCl2组PCNA、IMP3、β-catenin表达水平升高(P<0.05);与100 μmol/L CoCl2组比较,150 μmol/L CoCl2组IMP3、β-catenin,200、300 μmol/L CoCl2组PCNA、IMP3、β-catenin表达水平升高(P<0.05);与150 μmol/L CoCl2组比较,200 μmol/L CoCl2组PCNA、IMP3,300 μmol/L CoCl2组PCNA、IMP3、β-catenin表达水平升高(P<0.05);与200 μmol/L CoCl2组比较,300 μmol/L CoCl2组β-catenin表达水平升高(P<0.05)。见图3,表5。
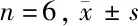
表4 HIF-1α在不同缺氧浓度下胃癌细胞SGC-7901中的表达水平比较
注:与0 μmol/L CoCl2组比较,*P<0.05;与100 μmol/L CoCl2组比较,#P<0.05;与150 μmol/L CoCl2组比较,△P<0.05;与200 μmol/L CoCl2组比较,☆P<0.05

图3 不同缺氧浓度下胃癌细胞SGC-7901中增殖蛋白PCNA、IMP3、β-catenin的表达
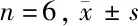
表5 在不同缺氧浓度下胃癌细胞SGC-7901中增殖蛋白PCNA、IMP3、β-catenin水平比较
注:与0 μmol/L CoCl2组比较,*P<0.05;与100 μmol/L CoCl2组比较,#P<0.05;与150 μmol/L CoCl2组比较,△P<0.05;与200 μmol/L CoCl2组比较,☆P<0.05
2.6 miR-210可靶向调控HIF-1α基因 Targetscan预测结果显示,HIF-1α基因3’UTR区有与miR-210结合位点。低氧条件下转染antagomic miR-210和其对应NC,与0 μmol/L CoCl2组比较,200 μmol/L CoCl2组和200 μmol/L+antagomic NC组细胞中HIF-1α表达水平升高(P<0.05)。200 μmol/L CoCl2组和200 μmol/L CoCl2+antagomic NC组差异无统计学意义(P>0.05)。与200 μmol/L CoCl2组、200 μmol/L CoCl2+antagomic NC组比较,200 μmol/L CoCl2+antagomic组细胞中HIF-1α表达水平降低(P<0.05)。见图4,表6。
3 讨论
胃癌在中国属高发癌症,发病率、死亡率分别占全球胃癌发病和死亡的42.6%、45%,治疗花费大且复发率高,给家庭带来沉重的负担[5]。胃癌复发和死亡率高的主要原因是胃癌细胞具有转移能力,低氧微环境是其中一个诱因。研究发现低氧诱导肺动脉成纤维细胞、平滑肌细胞的增殖、迁移和肺血管的重构[6,7]。CoCl2已被应用于制备缺氧模型,能够产生与机体相似的缺氧反应[8]。本研究发现,随着CoCl2浓度的升高,胃癌细胞SGC-7901 OD450、迁移细胞数量升高;提示细胞缺氧程度越严重,细胞增殖、迁移速度越快,加重胃癌进程。

图4 HIF-1α基因与miR-210结合位点预测
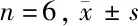
表6 HIF-1α在胃癌细胞SGC-7901不同处理中的表达比较
注:与0 μmol/L CoCl2组比较,*P<0.05;与200 μmol/L CoCl2组比较,#P<0.05;与200 μmol/L CoCl2+NC组比较,△P<0.05
miRNA是一段长18~24个氨基酸的内源性非编码RNA,能与靶基因mRNA3’非编码区特异性结合,调节基因转录和表达,在细胞增殖、转移、分化及凋亡等过程中发挥重要作用[9]。miR-210在缺氧环境中可调控细胞周期、促进干细胞代谢、抑制线粒体代谢、抑制DNA修复、诱导血管生成、支持细胞分化等,加重疾病进程[10]。在缺氧心肌细胞中miR-210表达上调会加重细胞损伤,抑制miR-210的表达会减弱心肌细胞的损伤[11]。本研究发现随着CoCl2浓度的升高,胃癌细胞SGC-7901细胞系中miR-210表达量升高;提示缺氧越严重,越促进miR-210的表达,可能是与相关靶位点结合促进细胞增殖、转移,从而加快疾病进程。
HIF-1α是低氧时最先刺激的因子,低氧刺激可促HIF-1α过表达使细胞适应低氧环境,可结合或活化靶基因上共同结合位点5’-RCGTG-3’在肿瘤过程中发挥血管生成、细胞增殖、代谢、侵袭和转移、化学治疗耐受、免疫逃逸等作用[12]。本研究发现随着CoCl2浓度的升高,胃癌细胞SGC-7901细胞系中HIF-1α表达量逐渐升高;提示缺氧越严重,低氧诱导因子HIF-1α表达量越高,低氧刺激HIF-1α的表达,加重反应进程。
PCNA是反映细胞增殖能力的指标、IMP3调节胰岛素样生长因子2的表达促进肿瘤增殖,而胰岛素样生长因子2是HIF-1α的靶基因之一[13]。β-catenin参与细胞增殖、迁移、凋亡和血管生成,在缺血性微环境中HIF-1α/β-catenin/TCF3/LEF1信号通路中促进β-catenin分泌来促进血管生成[14]。本研究发现随CoCl2浓度升高,胃癌细胞SGC-7901细胞系中PCNA、IMP3、β-catenin表达量明显升高,提示细胞中影响细胞增殖、迁移蛋白表达量升高,可能是HIF-1α影响增殖、迁移蛋白的表达进而促进胃癌发生、发展。
进一步研究发现,miR-210可与多个靶基因结合影响缺氧条件下细胞功能,在缺氧条件下抑制靶基因内皮素-2进而影响排卵和黄体生成[15];抑制干扰素调节因子4导致骨髓瘤细胞抗凋亡[16]。HIF-1α是miR-210潜在靶基因,缺氧条件下抑制miR-210的表达HIF-1α表达水平降低。以往研究发现HIF-1α是miR-210靶基因[17],提示miR-210、HIF-1α作为缺氧刺激因子,直接作用相互影响促进下游细胞增殖、迁移蛋白的表达从而促进细胞增殖、迁移,加重疾病进程。
综上所述,miR-210在胃癌细胞中通过上调HIF-1α表达促进细胞的增殖和迁移,表明miR-210可作为潜在靶标应用于胃癌基因治疗。下一步可在缺氧条件下荧光素酶验证miR-210与HIF-1α的靶向关系,并探讨降低miR-210表达对胃癌细胞的影响。

