低位直肠癌保肛手术之ISR手术策略及疗效评价
杨春康,官申
福建省肿瘤医院/福建医科大学附属肿瘤医院胃肠外科六病区 福建福州 350014
我国结直肠癌发病特点相较于欧美国家主要表现在直肠癌所占比例高(约60%),其中低位直肠癌占65%~70%[1]。目前,直肠癌仍以手术治疗为主,对于肿瘤下缘距离齿状线小于3 cm 的低位直肠癌,其传统手术方式为经腹会阴联合切除术(abdominoperineal resection,APR),术后患者需接受永久性造口,这给患者生活及心理带来影响。随着对低位直肠解剖、生理功能及直肠癌肿瘤生物学行为认识的不断更新,1994 年Schiessel 首次提出括约肌间切除术(intersphincteric resection,ISR)[2],目的在于极限保肛,使得部分低位直肠癌患者在免遭切除肛门的痛苦同时又能获得理想的肿瘤学疗效。结合目前腹腔镜微创技术的发展现状,低位直肠癌的手术在肿瘤根治基础上提出了“保肛门、保功能”等更高要求。本文围绕低位直肠癌ISR手术相关概念、临床解剖关键点及手术技巧等方面问题进行阐述,以期为临床实践提供参考。
1 低位直肠癌的定义、分型及分期
按直肠的解剖学定义[3],低位直肠是指距离肛缘5 cm 以内的直肠。该部位主要部分亦成为外科肛管,即始于肛直肠环,止于肛缘。依据该部位解剖学特点,法国的Rullier 等[4]提出将低位直肠癌分为Ⅰ~Ⅳ型(亦称Bordeaux 分型),依次为肛管上型(supra-analtumor)、近肛管型(juxta-analtumor)、肛管内型(intra-analtumor)、经肛管型(trans-analtumor)。目前低位直肠癌术前临床分期主要通过MRI及直肠腔内B 超评估,“DISTANCE”评估体系已成为直肠癌术前影像学评估的基本报告形式之一并受到推崇。其中,MRI评估外科肛管内的直肠癌T分期如下:T1指肿瘤侵犯黏膜或黏膜下层,T2指肿瘤仅侵犯内括约肌,T3指肿瘤侵犯联合纵肌,T4指肿瘤侵犯外括约肌和(或)肛提肌。
2 低位直肠癌保肛的可行性及ISR术式的选择
目前低位直肠癌保肛术取得的进展主要得益于肿瘤生物学的研究、新辅助治疗及手术器械的应用。在肿瘤生物学方面,关于直肠癌远切缘距离的问题经历了不断探索的过程,Kwok 及Andreola 等[5-6]研究发现直肠癌远切缘可能不是决定局部复发的关键,在充分切除直肠系膜的前提下,低位直肠癌远切缘需大于1.5 cm。Heald 等[7]研究发现低位直肠癌向远端浸润的距离通常小于1 cm,由此认为远切缘1 cm 已经足够。Bujko 等[8]通过荟萃分析结果显示低位直肠癌新辅助治疗后远切缘<1 cm甚至<5 mm时对肿瘤预后无明显影响。因此,笔者认为在保证高质量的TME手术前提下远切缘1 cm已足够。同时,术前放化疗等新辅助治疗的应用进一步降低了局部复发率,从而增加了保肛的机会;加之腹腔镜、经肛手术器械的应用,即使是在狭小的盆腔内也能在直视下确保可靠的远切缘及肠管的低位吻合,提高保肛率及手术安全性,缩短手术时间。
依据低位直肠癌Bordeaux分型[9]:Ⅰ型指肿瘤距肛管直肠环上缘>1 cm,可行超低位直肠前切除并保留内括约肌;Ⅱ型指肿瘤距肛管直肠环上缘<1 cm,可行部分ISR;Ⅲ型指肿瘤下缘位于外科肛管内、仅浸润内括约肌,可行次全或完全ISR;Ⅳ型指肿瘤侵犯外括约肌和(或)肛提肌,多需行腹会阴联合切除术(APE),新辅助放化疗后应重新评估以选择合理的手术方式。
依据手术入路方式不同,ISR 手术分为经肛入路、经前会阴入路及经腹入路。传统经肛入路行ISR手术,经肛门括约肌间隙分离,操作视野小、显露困难、费时费力。腹腔镜下经腹ISR 通过延续TME外科平面达内外括约肌间,完成pISR 并采用器械吻合;如为保证下切缘的安全距离,可经腹分离至内外括约肌间后,再经肛入路于距离肿瘤下缘1 cm 处切断直肠,完成手工吻合。该入路优点是经腹行括约肌间分离较经肛容易。
ISR的适应证:(1)病理学确诊直肠癌且分化良好。(2)术前影像学分期cT1~cT2期的低位直肠癌,其在完成直肠末端系膜分离后,经肛检确定肿瘤下缘距肛直肠环上缘≤1 cm。若术前影像学提示cT3期,予先行新辅助放化疗后如有降期,可行该术式。(3)术前肛门功能良好,肛门括约肌紧张度正常(肛门括约肌紧张度可通过肛门指诊进行判断,指诊同时可判断肿瘤下缘与齿状线的距离以及与括约肌间隙的关系)。ISR 的禁忌证:(1)肿瘤分化较差(低分化或未分化);(2)新辅助放化疗后直肠癌影像学分期仍为cT3~cT4期(已经浸润至或超过联合纵肌者);(3)高龄、术前肛门功能差者;(4)黏膜逆向浸润范围大,安全切缘无法保证者[10]。
3 经腹ISR手术关键步骤与操作技巧
腹腔镜ISR主要关键步骤在于腹下神经至盆丛全程保护、肛提肌上平面相关解剖显露、括约肌间隙的分离、经肛入路剥离内括约肌。
腹腔镜ISR手术在肛提肌平面以上的操作与腹腔镜直肠TME 手术基本相同,其中需要注意两点:一是依据左半结肠长度决定是否保留左结肠动脉,同时充分游离结肠脾曲,从而确保无张力的结肠肛管吻合及其血供。分离裁剪系膜时切勿损伤左结肠边缘血管弓,避免切除过多的肠管,甚至需要游离结肠肝曲;二是全程保护肠系膜下神经丛、腹下神经、神经血管束及盆腔神经丛避免损伤,从而保护盆腔器官功能,保证术后生活质量。
肛提肌上平面相关解剖显露的第一步就是打开直肠骶骨筋膜(Waldeyer's筋膜)进入疏松结缔组织间隙,即肛提肌上间隙(见图1),进入该间隙既能延续直肠固有筋膜的完整性,又能避免损伤骶前血管,该部位分离技巧是由助手左手钳托起直肠上段背侧系膜并向头侧倾斜45°适当拖拽以保持直肠系膜张力,右手依据主刀分离部位利用对抗牵引原则适当反向加压,笔者习惯运用左手吸引器完成“挑拨离间”,同时将吸引器保持适当低流量吸引,既能在有限的盆腔空间里及时吸除能量器械产生的烟雾,保持手术画面的清晰,又不影响气腹的有效空间。手术路线仍然是紧贴直肠固有筋膜表面分离并始终保证其完整性,分离过程若组织张力维持理想可使用低功率电钩接触式分离组织间隙,基于正确手术平面的操作不易出血且在电钩下分离轻松高效。分离过程若遇较为凸显的静脉可换用超声刀进行凝闭分离。手术路线由中线向肛提肌裂孔方向分离并向两侧方进行充分拓展。两侧方的充分拓展有利于直肠侧方的离断,同时有助于保护双侧腹下神经及盆丛。
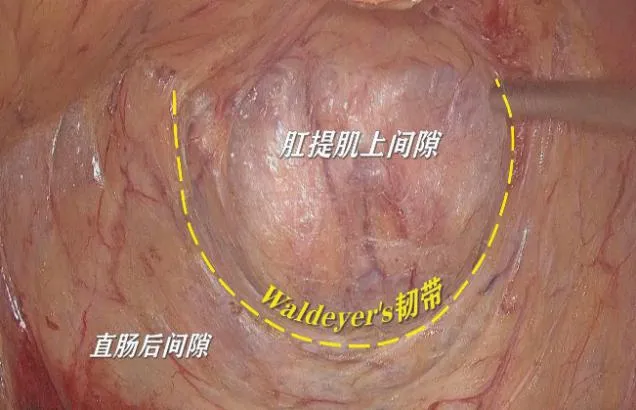
图1 切开Waldeyer's筋膜进入肛提肌上间隙
肛提肌上平面另一个解剖标记是直肠系膜终点线(见图2),它实质是直肠固有筋膜与盆底肌筋膜的融合间隙,它指向并终止于肛提肌裂孔,在直肠系膜游离过程中接近终点的系膜逐渐变薄,在4 点位、8点位较易观察到直肠系膜与盆底肌之间的一条白线,沿着该间隙逐渐分离就可显露Hiatal韧带及耻骨直肠肌。Hiatal韧带是一圈环绕覆盖在肛提肌裂孔表面的结缔组织(见图3),前侧方较为薄弱,向后方逐渐增厚[11-12]。切开该韧带才能完整显露围绕着直肠末端增厚的耻骨直肠肌,同时方便助手进一步拉直直肠后壁,此时需经肛检确定肿瘤下缘距肛提肌裂孔的距离以确定下一步的括约肌间隙分离深度。
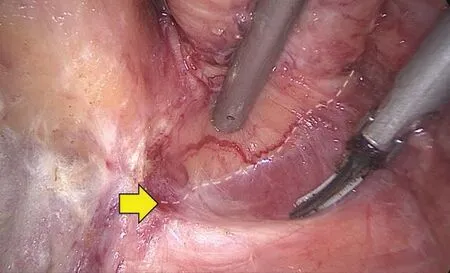
图2 直肠系膜终点线
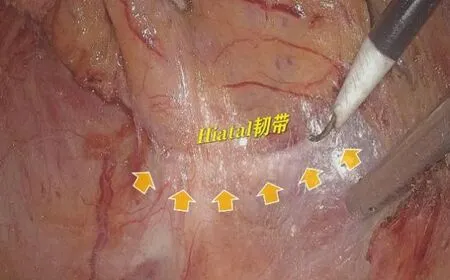
图3 Hiatal韧带
由直肠后方开始分离直肠与肛提肌,此时助手的左手持无损伤抓钳托起直肠上段背侧系膜向腹侧及向头侧托起直肠后壁并维持张力,助手的右手可予协助,在张力许可情况下,助手右手可换持吸引器将末段直肠挡向内上方,便于及时吸除烟雾;主刀左手持抓钳轻轻将肛提肌裂孔右侧边缘的耻骨直肠肌牵向外侧,右手持电钩小步点触式锐性分离括约肌间隙(见图4),此时注意电钩需偏向内侧肠壁,避免损伤外括约肌,同时注意避免直肠穿孔,括约肌间隙内为联合纵肌(组织较为致密且神经血供丰富),分离过程需用吸引器及时吸净焦痂、渗血渗液保持良好的术野以利于手术层面的判断。在操作时,一是建议在保证安全切缘的前提下,尽量多地保留内括约肌;另一建议是在括约肌间分离过程中若解剖间隙不清或角度不佳,可让一名助手用拳头顶起会阴部,改善术野角度及操作空间。当见到曲张的血管丛则表明已分离达齿状线水平,同法分离直肠后方、左侧及前方括约肌间隙。在分离过程中,要注意避免损伤男性患者后尿道,女性患者则要避免损伤阴道后壁。
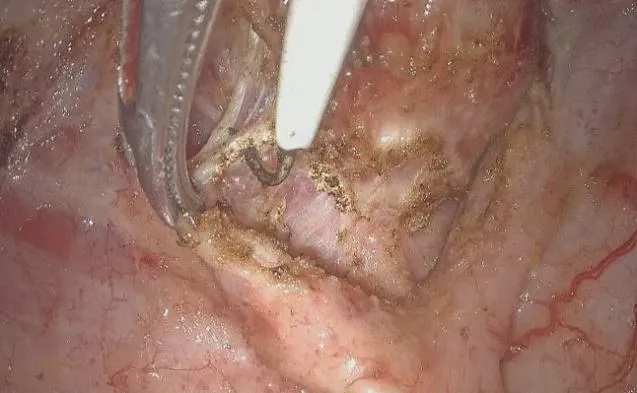
图4 电钩小步点触式锐性分离括约肌间隙
当直肠尽可能完全游离至齿状线水平后(见图5),应再次肛诊并提前适度扩肛,如确定直肠肿瘤下缘距齿状线≥2 cm,可经腹以45 mm或60 mm直线切割闭合器离断直肠,并选择25 mm 圆形吻合器完成吻合。选择该型号吻合器可尽量多地保留直肠肛管移行上皮区(anal transitional zone,ATZ),吻合时需注意避免耻骨直肠肌及阴道壁卷入吻合器中。

图5 游离括约肌间隙并保护耻骨直肠肌
如直肠肿瘤下缘距齿状线<2 cm 则有两种做法:一是在肿瘤近端10~15 cm 处切断乙状结肠,将直肠近端经肛门翻转出来,在直视下距肿瘤下缘1~2 cm处闭合切断肠管后将残端还纳,完成吻合;二是经肛入路切断肠管完成手工结肠肛管吻合,适用于肿瘤下缘距齿状线<2 cm者或因骨盆狭小等原因使得经腹部行直肠闭合切断无法保证安全下切缘等情况。将碘伏稀释后用于直肠冲洗,在进一步清洁肠道的同时吸去脱落肿瘤细胞,直视下以Lone-Star 盘状拉钩牵开肛缘,明确肿瘤下缘与括约肌间隙的距离。首先用电刀在距肿瘤下缘1.5 cm 处的直肠黏膜上点灼出环形预切线(见图6),若肿瘤直径不超过3 cm或不超过1/3周肠壁,可在肿瘤非癌侧适当保留部分内括约肌及齿状线,利于保留部分肛门功能;再由预切线开始直接切透肛管全层,在气腹状态下进入到已分离好的内、外括约肌间隙。沿外括约肌表面向两侧游离并与对侧会师后,要经腹腔镜检查肠管的张力及确认肠系膜无扭转,再将直肠经肛门拖出(见图7),切断肠管移去标本;调整近端结肠其断端与肛管全层间断缝合,通常以3-0可吸收线缝合12~16 针(见图8),注意针距及避免过多的缝合造成术后吻合口狭窄。为了保证肿瘤远端的安全切缘,必要时术中应行快速冰冻病理学检查,若无法保证安全切缘需改为APE 手术;最后常规行预防性末端回肠造口,经主操作孔放置盆腔引流管,同时放置肛管。最后剖开手术标本,检查肿瘤远切缘的距离(见图9)。
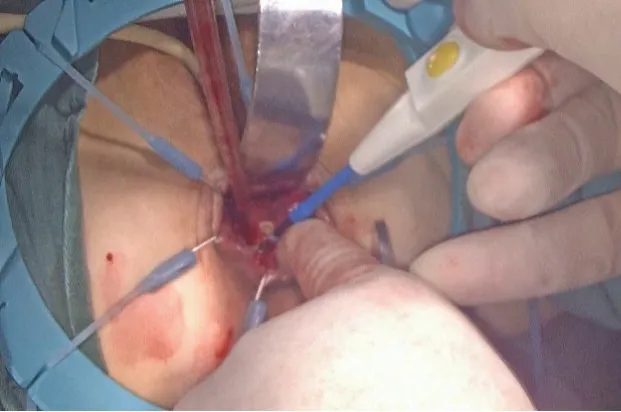
图6 经肛门用电刀环形切开直肠下切缘
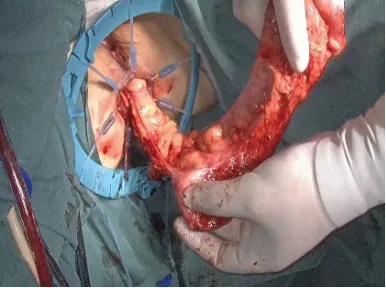
图7 确认系膜无扭转后将直肠经肛门拖出
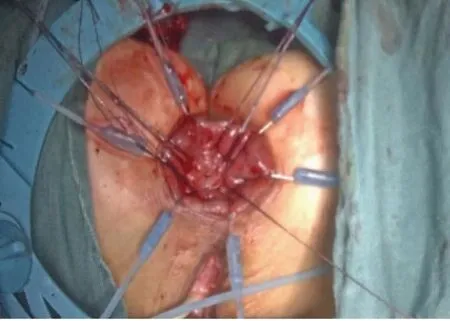
图8 近端结肠断端与肛管全层间断缝合
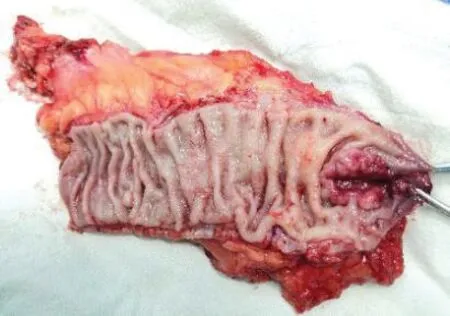
图9 直肠术后标本
4 低位直肠癌保肛手术疗效及功能评价
笔者认为良好的吻合口张力及血供是避免吻合口漏的重要条件,同时也可防止术后远期出现吻合口近端肠管狭窄、铅管样改变等影响术后排便功能。嘱患者在术后2周逐步开始进行恢复肛门功能的锻炼(如定期收缩肛提肌运动)、术后按时随诊及每2周行1次肛门指检评估有无吻合口狭窄,也需防止吻合口因炎性粘连造成闭锁。大便失禁是ISR术后主要的并发症。笔者认为盆腔神经损伤、过多切除内括约肌、盆底手术操作中电凝灼伤肌肉神经、吻合口距离齿状线或肛缘较近,以及新辅助放化疗均会对肛门功能造成一定影响。Konanz 等[13]对接受LAR、ISR及腹会阴联合切除术(APR)的患者术后生活质量进行配对分析研究后发现,ISR术后患者大便失禁发生率明显高于LAR,Wexner 评分也高于LAR;Kitaguchi等[14]比较不同ISR术后的肛门功能,发现次全ISR 组的肛门最大静息压(maximum resting pressure,MRP)相较于部分ISR 组降低,研究认为ISR切除了维持肛管静息压的内括约肌和神经末梢丰富的齿状线区域的黏膜,导致了术后肛门功能不佳。池畔教授等[15]研究发现新辅助放化疗和吻合口距肛缘<2 cm 是ISR 术后大便失禁的独立危险因素。因此须准确掌握ISR手术和新辅助放化疗的适应证,进行准确规范的临床分期和肛门功能评估有助于合理选择适用病例,并且需要充分做好术前沟通。术中高质量的操作控制可保证肿瘤的根治,保护重要血管、肌肉及神经功能,术后积极进行肛门功能锻炼有利于肛门功能恢复。
综上所述,ISR术式为低位直肠癌患者增加了保肛的机会,对低位直肠癌患者,在实施腹腔镜ISR手术前需根据术前影像学分期、肛门功能情况、外科技术条件及患者自身个体化情况综合考虑。腹腔镜技术的合理应用使得手术更加精细化,为手术安全性、保护功能方面提供保障。

