过氧化物酶体增殖物激活受体γ多态性与结直肠癌风险的相关性分析
张智 王璇 刘群 许丽玲
结直肠癌(CRC)是发达国家中发病率最高的癌症之一。西方发病率高、亚洲发病率低的地理格局表明,除了遗传决定因素外,生活方式和饮食因素可能是结肠癌发生的重要因素[1]。其中,肥胖症在西方人群中更为普遍,在病例控制和队列研究中,肥胖一直与男性和女性中较高的CRC风险相关[2]。随着越来越多的实验证据,这些流行病学数据表明肥胖引起的高胰岛素血症,高脂血症和胰岛素抵抗可能在结肠癌的发生中起作用[3]。作为一种核受体,它在调节脂肪细胞分化、葡萄糖和脂质稳态以及细胞内胰岛素信号事件中起着关键作用,过氧化物酶体增殖物激活受体(PPAR)g因其在CRC中的作用而受到越来越多的关注[4]。PPARγ的内源性配体包括多不饱和脂肪酸(PUFA)和花生四烯酸衍生物。实验证据表明,PPARγ在结肠中的激活导致了生长抑制和分化,降低了CRC细胞的恶性潜能[4,5]。此外,PPARγ配体曲格列酮对化学诱导的大鼠结肠炎和异常隐窝形成有明显的抑制作用。PPARγ基因通过差异启动子和选择性剪接产生四种不同的PPARγ mRNA,形成两种不同的蛋白质亚型[6]。PPARγ 1、PPARγ3和PPARγ 4转录本虽然具有不同的上游调控序列,但产生了由外显子1-6编码的相同蛋白质。PPARγ3转录本启动子区的功能C-to-G多态性681从a2外显子一开始就与体重增加和循环胆固醇水平有关。PPARγ2转录本产生一种由PPARγ2特异性外显子B编码的额外28个氨基酸的蛋白质。第B外显子的脯氨酸-丙氨酸替换密码子12的多态性与糖尿病和CRC的风险降低有关。研究对PPARγ2编码区和PPARγ3调控区的这两个多态性与CRC风险的关系进行研究。
1 资料与方法
1.1 一般资料 在2016年1月至2019年1月共有100名年龄45~74岁的中国男女人士加入这项研究。用一份结构化的问卷,要求了解过去一年的人口统计、终生使用烟草和乙醇、病史、癌症家族史和日常饮食方面的信息。评审委员会已经批准了这项研究。我们收集了100名受试者的血/颊细胞样本。在2003年5月31日前,排除了18名在招募时有CRC病史(N5)或第一次CRC(N13)的受试者,另外招募100名受试者构成本研究的参照(即对照)组。与其他队列成员相比,这些受试者在年龄、性别、方言组、受教育程度、体重指数、饮酒史、糖尿病史或CRC或任何癌症的家族史上有相似的分布(P>0.10)。对照组吸烟者的比例(27.8%)略低于其他队列参与者(31.6%,P=0.04)。
1.2 基因分型方法 用QIAamp 96 DNA试剂盒(QIAGEN,Valencia,ca)从外周血和口腔细胞样本中提取DNA。
1.2.1 PPARγ2 Pro12Ala多态性测定:通过多态区的直接测序,鉴定了PPARγ2 Pro12Ala多态性(rs1801282)的等位基因。用引物GC083对(5’-GGAACTGATGTCTTGACTCATG-3’)和GC083rev(5’-GCAGAGAGAGTTATCAGAGAGAGAGG-3’)进行PCR扩增。PCR反应用热启动Taq聚合酶(QIAGEN,巴伦西亚,ca)根据制造商的指示,使用20 ng的基因组DNA,2 mmol/L的MgCl2和300 μm的每个引物。在热循环(MWG Biotech,High Point,NC)上进行PCR扩增,初步步骤为95℃,15 min,35次周期,每25秒95℃,54℃/min,72℃/min。用MAF-nob PCR纯化板(Milli孔隙、Billerica、MA)对PCR反应进行纯化,去除dNTPs和引物。部分样品经琼脂糖凝胶电泳分析,证实PCR反应成功,阴性对照无产物。用引物GC083S(5’-ACTGATGTCTTGACTCATGGGTG-3’)进行DNA测序,用荧光标记的DDNTPS(ABI染料终止子测序试剂盒,应用生物系统)进行10~20 ng纯化PCR产物的循环测序,每15秒进行95℃,每3.5分钟进行50℃的循环测序。测序反应在abi3730xl毛细管DNA分析仪上进行。序列文件通过PHRED/PHRAPP(华盛顿大学)对序列进行比对,并标记可能的多态位置。在CONSED(华盛顿大学)中观察序列和多态位置评分。
1.2.2 PPARγ3C-681G多态性(Rs10865710测定:用荧光5’核酸酶分析(Taqman法)进行基因分型。TaqMan检测是根据制造商的指示使用TaqMan PCR核心试剂盒(Applied Biosystems,Foster City,CA)进行的。扩增PPARγ3多态区的引物为GC028(5’-CCTGATGATAAGGCTTGTTGTTGT-3’)和GC028rev(5’-ATCTTATGAATAGTCAAGGATCCT-3’)。此外,用于检测每个等位基因的荧光寡核苷酸探针(TaqMan MGB;ABI)是用6 FAM标记的GC028F(5’-TTTTCCATCAAGACAAAA-3’)标记的,用Vic标记的GC028V(5’-TTTTCCATGAAGACAAAA-3’)检测G等位基因。采用PCR扩增技术,在热循环中进行10 ng的基因组DNA扩增,起始时间为95℃,10 min,95℃周期为50次,周期为25 s,60℃周期为1 min。在ABI7900HT序列检测系统中对每口井的荧光剖面进行了测量,并用序列检测软件(应用生物系统)对结果进行了分析。实验样本与12名对照进行比较,分别在每个位点(G/G、G/C、C/C)鉴定3种基因型。在对照组定义的参数之外的样本被识别为非信息,并被重新测试。
1.3 统计学分析 应用SAS 9.1统计软件,采用精确试验对正常人的基因进行Hardy Weiberg平衡检查,采用χ2检验,以优势比(OR)及其95%置信区间(CIS)和P值来衡量某一特定基因-癌症关联的强度,P<0.05为差异有统计学意义。
2 结果
2.1 2组人群中CRC人口特征及潜在危险因素分析 100例中,57例为结肠癌,43例为直肠或直肠乙状结肠癌。诊断时患者平均年龄66.1岁。基线访谈与癌症诊断的时间间隔1个月~9.9年。与对照组相比,病例患者在招募时年龄较大,男性比例较高,受教育程度较低,BMI较高,更有可能吸烟和每天饮酒。更有可能有糖尿病病史,更有可能与CRC有一级亲属关系。见表1。
2.2 PPARγ rs10865710多态性与CRC风险的关系 对照组PPARγ2多态性的C、G等位基因频率分别为0.961和0.039,PPARγ3多态性的C等位基因和G等位基因频率分别为0.634和0.366。所有基因型分布处于Hardy Weinberg平衡(P>0.7)。PPARγ2 Pro12Ala和PPARγ3C-681G多态性位点等位基因相关的R2为0.07,表明缺乏LD。见表2、3。
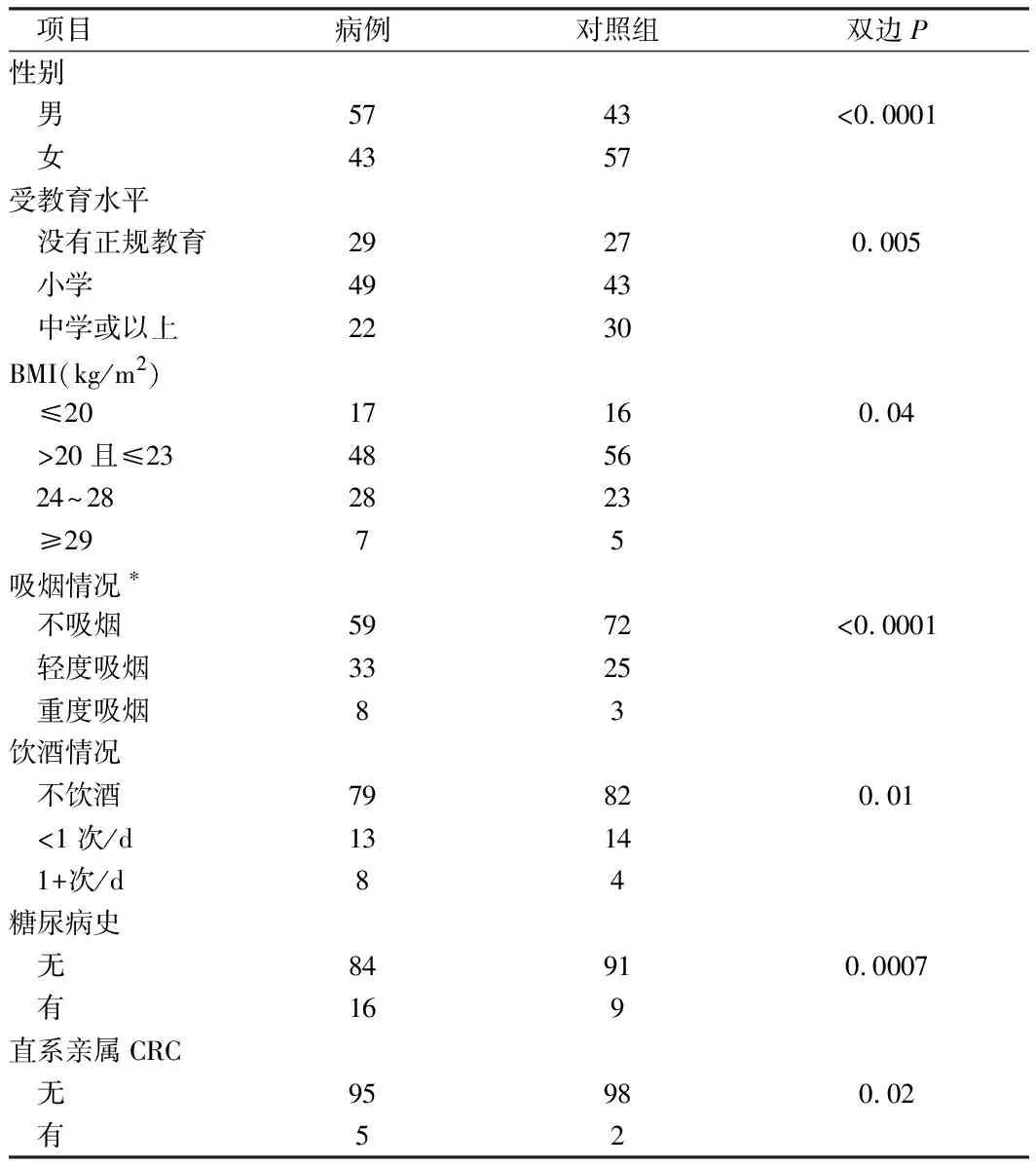
表1 研究人群中CRC的人口特征和潜在危险因素的分布 n=100,例
注:*轻度吸烟者是指15岁开始吸烟或每天吸烟<13支的人,而重度吸烟者是15岁前开始吸烟和每天吸烟≥13支的人
2.3 CRC危险因素中PPARγ多态性的单倍型频率与病例控制状态及优势比(OR)的关系 PPARγ2和PPARγ3基因型与CRC风险的关系。在PPARγ2基因多态性上,由于GG基因型频率较低,对GG和GG基因型进行了分组。具有至少一个G等位基因拷贝的受试者患CRC的风险降低50%(或0.53,95%CI 0.30~0.92)。就PPARγ3多态性而言,具有至少一个C等位基因拷贝的受试者与G等位基因纯合者相比,CRC风险降低了25%以上。拥有两个C等位基因副本并不意味着任何额外的风险降低。因此,PPARγ2,CG/GG基因型和PPARγ3 GC/CC基因型被认为是CRC的低危险基因型。当同时检测PPARγ2和PPARγ3基因多态性时,只有一个低危险基因型者的OR值(95%)为0.72(0.49~1.07),而具有两种低危险基因型者的OR值为0.19(0.07~0.51),与无低危险基因型者相比(P=0.25)。在任何基因风险关联的不同亚位点(即结肠和直肠癌)没有明显的差异。见表4。
2.4 癌旁非癌组织基因型与组织学评分的关系 我们还研究了PPARγ2和PPARγ3基因型在非糖尿患者群中与CRC发病的关系。在排除那些在招募时报告有医生诊断的糖尿病病史的受试者后,只有一种基因型和两种低风险基因型的患者的OR(95%顺铂)分别为0.66(0.43~1.01)和0.16(0.05~0.41),两种PPARγ基因多态性与无低风险基因型比较(P=0.0001)。我们还按年龄(<60岁和≥60岁)、性别、体重指数(<24 kg/m2和≥24 kg/m2)、吸烟(NO/YES)、饮酒(NO/YES)和CRC家族史(NO/YES)进行分组分析。PPARγ2和PPARγ3的联合基因型与CRC风险之间的负相关关系在任何分层变量的亚组之间具有可比性(数据未显示)。见表5。
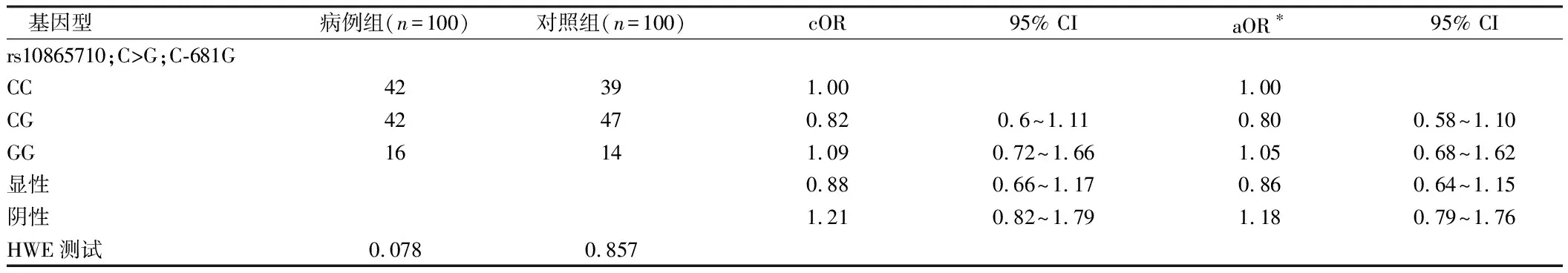
表2 PPARγ rs10865710多态性与CRC风险的关系
注:*除了登记日期和禁食状态的匹配因素外,再根据登记年龄、腰围和雌激素关键暴露时间对OR进行进一步调整
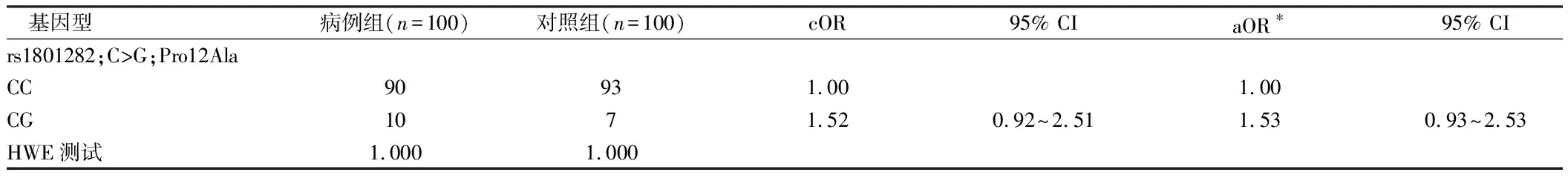
表3 PPARγ rs1801282多态性与CRC风险的关系
注:*除了登记日期和禁食状态的匹配因素外,再根据登记年龄、腰围和雌激素关键暴露时间对OR进行进一步调整

表4 CRC危险因素中PPARγ多态性的单倍型频率与病例控制状态及优势比(OR)的关系
注:*单倍型由PPAR-681C>G,Pro12Ala,1431C 基因型(n)Pro/Pro(130)Pro/Ala(21)P值嗜中性白血球浸润0.85±0.461.00±0.320.14单核细胞浸润1.65±0.620.90±0.640.10萎缩1.09±0.761.40±0.820.09肠上皮化生1.42±1.031.85±0.460.08 在这个群体中,我们报告了PPARγ2 Pro12Ala和PPARγ3 C-681G基因多态性对CRC风险的影响。尽管与PPARγ2变异体相关的风险降低与报告的西班牙人群中的CRC和美国人群中的大肠腺瘤相似[7],但这是第一次将PPARγ3基因多态性与CRC风险相关的研究。 本研究中PPARγ2基因多态性为C-to-G错义突变,导致PPARγ2特异外显子B密码子12处脯氨酸(proline,PRO)取代丙氨酸(Ala)。这种替代是在蛋白质的一个区域内,它增强了不依赖配体的激活[8]。据报道,该变异的等位基因频率在不同人群中存在差异,从白人为0.12[9],墨西哥裔美国人为0.10[10],非裔美国人为0.03,中国大陆华人为0.01[11]。我们的Ala等位基因频率在中国人群中为0.039,与以前报道的新加坡华人的频率一致。我们发现这两个多态位点之间缺乏较强的LD,这与HapMap数据是一致的[12]。HapMap数据显示,汉族和高加索人的R2值分别为0.08和0.31。与R2相比,Lewontin在我们的数据集(1.0,95%CI=0.92~1.0)和HapMap数据集(95%CI=0.11~0.99)中的D’值较高;1.0%,95%CI=0.69~1.0(欧洲白人),表明LD高。然而,在低等位基因频率的情况下,例如PPARγ2的情况(在我们的研究人群中为0.039;在HapMap白人中为0.075),D’可能无效,因为它可以被极大地膨胀。因此,在我们的研究中,我们认为使用R2而不是D’更合适,而在我们的研究中R2的低值表明我们缺乏LD[13]。一项西班牙参与者的病例对照研究发现,带有G等位基因的受试者的CRC风险降低了45%,这与我们在研究中注意到的降低风险的程度相似[14]。这些经验数据表明,推测的低风险G等位基因可能与生物学上较高的PPARγ2活性有关[15]。 虽然PPARγ2和PPARγ3亚型均在脂肪组织中表达,但PPARγ蛋白在正常结肠上皮细胞和肿瘤性结肠上皮细胞中的表达主要是γ3亚型。PPARγ3 mRNA在人结肠癌细胞系中的分布在基础条件下比G2同工型多100倍,在诱导分化的G2上增加了600倍以上[16]。PPARγ激动剂对体外培养的人CRC细胞的生长抑制作用与G1期阻滞、多种分化标志和细胞凋亡有关。此外,PPARγ配体通过抑制核因子-kappa B的激活,显著降低结肠癌细胞中细胞因子基因的表达,提示PPARγ3可能在调节肠道炎性反应中起重要作用[17]。对人CRC细胞的检测显示,55名无关个体的7%的肿瘤中PPARγ基因出现了功能缺失突变。这些实验研究为PPARγ3在大肠癌中的抑癌作用提供了证据[18]。 综上所述,PPARG在CRC中的作用。这些发现可能具有临床意义。其中一种可能针对药物开发中的PPARG激活途径,作为CRC预防和治疗策略的一部分。
3 讨论

