健脾补肾方对再生障碍性贫血患者和Fas表达的影响
吕丽丽 张琳琳 曹宇峰 王磊 边月平

1 资料与方法
1.1 一般资料 将2016年1月至2018年6月我院收治的90例再生障碍性贫血患者纳入研究范围,按照随机数字表法随机分为对照组和治疗组,每组45例。对照组男25例,女20例;年龄32~61岁,平均(39.12±5.42)岁;病程1~12年,平均(5.12±0.73)年;中医症候分型:脾肾阴虚型10例,脾肾阳虚型19例,脾肾阴阳两虚型16例;治疗组男23例,女22例;年龄30~65岁,平均(40.00±5.51)岁;病程1~14年,平均(5.78±0.82)年;中医证候分型:脾肾阴虚型12例,脾肾阳虚型18例,脾肾阴阳两虚型15例。2组年龄、性别比、病程、中医证候分型等一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 2组一般资料比较 n=45
1.2 纳入及排除标准 纳入标准:(1)符合《血液病诊断及疗效标准》制定的再生障碍性贫血诊断标准,且经临床症状体征、血常规指标、骨髓涂片及病理学检查确诊为AA;(2)符合《中药新药临床研究指导原则》制定的中医辨证分型诊断标准;(3)入组前2周内未接受过激素、化疗药物治疗者;(4)患者均自愿参加本研究,且签署知情同意书。排除标准:(1)合并PNH、白血病等其他血液系统疾病;(2)合并心﹑肝﹑肺﹑肾等重要脏器功能不全者;(3)妊娠或哺乳期女性;(4)对本研究药物过敏或有禁忌症者。
1.3 治疗方法 对照组给予环孢素A(杭州中美华东制药有限公司)治疗,口服,4 mg·kg-1·d-1,2次/d;同时根据病情给予抗感染、补血及止血药物。治疗组给予健脾补肾方治疗,组成:黄芪24 g,女贞子15 g,太子参24 g,白术芍15 g,炒丹皮15 g,制半夏10 g,小蓟草15 g,菟丝子24 g,炒枳壳10 g,炙甘草6 g。1个月为1个疗程,共治疗2个疗程。针对不同中医辨证分型,健脾补肾方中分别配伍不同中药,脾肾阴虚型可选择滋阴生精的药物,如生地黄、黄柏等;脾肾阳虚型可选择填精助阳的药物,如补骨脂、淫羊藿;脾肾阴阳两虚型可选择阴阳双补的药物,如杜仲、制首乌等。
1.4 观察指标及方法

1.4.2 BMNC自噬、凋亡相关基因mRNA表达:采用Real time-PCR法测定BMNC LC3-Ⅱ、Bcl-2、caspase-3、PARP mRNA表达。按照TRizol说明书进行BMNC总RNA的提取和逆转录,SYBR Green染料法进行目的基因扩增,根据RQ=2-ΔΔCt计算目的基因相对表达量。引物序列由上海生工生物工程有限公司合成。见表2。

表2 Real time-PCR引物序列
1.4.3 BMNC自噬、凋亡相关基因蛋白表达:采用Western blot检测BMNC LC3-Ⅱ、Bcl-2、caspase-3、PARP蛋白表达。提取BMNC总蛋白,BCA法定量蛋白,SDS-PAGE电泳后转至PVDF膜,5%脱脂奶粉封闭2 h,加入特异性一抗(1∶5 000稀释),4℃过夜,加入辣根过氧化物酶标记的抗兔 IgG(1∶5 000稀释),室温孵育1 h,PBS洗膜3次,以GAPDH为内参照基因,ECL反应,采用Image-Pro Plus软件分析目的蛋白相对表达量。
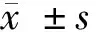
2 结果
2.2 2组BMNC细胞凋亡率比较 治疗前2组BMNC细胞凋亡率比较差异无统计学意义(P>0.05)。治疗后2组BMNC细胞凋亡率均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组凋亡率低于对照组(P<0.05)。见表4。


组别CD+34Fas对照组 治疗前0.31±0.0445.16±5.89 治疗后0.48±0.06∗30.32±3.67∗治疗组 治疗前0.33±0.0543.87±6.46 治疗后0.65±0.09∗#17.36±2.50∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05


组别凋亡率对照组 治疗前7.25±0.87 治疗后4.90±0.65∗治疗组 治疗前7.29±0.96 治疗后2.12±0.33∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组BMNC自噬相关基因表达比较 治疗前2组BMNC LC3-Ⅱ mRNA和蛋白表达比较差异无统计学意义(P>0.05)。治疗后2组BMNC LC3-Ⅱ mRNA和蛋白表达均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组LC3-Ⅱ mRNA和蛋白表达高于对照组(P<0.05)。见表5。


组别LC3-Ⅱ mRNALC3-Ⅱ蛋白 对照组 治疗前0.34±0.050.30±0.04 治疗后0.55±0.08∗0.49±0.07∗治疗组 治疗前0.32±0.040.29±0.05 治疗后0.87±0.10∗#0.80±0.11∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.4 2组BMNC凋亡相关基因表达比较 治疗前2组BMNC Bcl-2、caspase-3、PARP mRNA和蛋白表达比较差异无统计学意义(P>0.05)。治疗后2组BMNCBcl-2 mRNA和蛋白表达均明显高于治疗前,caspase-3、PARP mRNA和蛋白表达均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组Bcl-2 mRNA和蛋白表达高于对照组,caspase-3、PARP mRNA和蛋白表达低于对照组(P<0.05)。见表6。


组别Bcl-2mRNA蛋白caspase-3mRNA蛋白PARPmRNA蛋白对照组 治疗前0.42±0.060.37±0.051.02±0.150.98±0.120.95±0.120.89±0.10 治疗后0.63±0.09∗0.60±0.08∗0.79±0.11∗0.72±0.09∗0.67±0.11∗0.60±0.09∗治疗组 治疗前0.40±0.050.34±0.040.99±0.120.95±0.130.97±0.130.91±0.12 治疗后0.99±0.12∗#0.90±0.10∗#0.40±0.06∗#0.35±0.05∗#0.38±0.07∗#0.31±0.04∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
3 讨论

自噬是真核细胞内自噬溶酶体介导的大分子物质降解为氨基酸等基础物质的过程,对细胞生长发育、分化、凋亡等发挥重要调控作用[11]。自噬异常时细胞内代谢紊乱从而引发肿瘤、心血管、自身免疫等多种急慢性疾病发生。越来越多的证据表明自噬参与调控骨髓造血过程,自噬异常与AA等多种恶性血液系统疾病密切相关,自噬水平变化在AA发生发展中的作用已经成为当前研究的热点[12-14]。自噬作用的激活往往伴随着LC3-Ⅱ表达升高,该因子在调控自噬体形成及成熟中发挥重要作用,可作为反映细胞自噬程度的可靠指标。临床研究表明,AA患者造血干(祖)细胞LC3-Ⅱ表达较健康人显著降低,且与疾病严重程度呈负相关,经免疫抑制剂治疗后LC3-Ⅱ表达有所恢复,说明AA患者存在自噬缺陷,这可能是导致造血干(祖)细胞凋亡的重要原因[15]。但是,自噬缺陷在AA发病机制中的作用尚不清楚。基础研究表明,敲除小鼠造血干细胞自噬基因后不仅不能够维持细胞静息状态,还会影响其自我更新,同时导致细胞过度增殖分化。体外实验表明,自噬基因敲除后造血干细胞集落形成能力显著降低[16]。此外,造血微环境作为骨髓造血干细胞增殖分化的场所,参与调控造血干细胞的自我更新及定向分化,造血微环境的破坏会影响造血干细胞的分化增殖能力,从而导致AA发生[17]。研究发现,AA患者骨髓腔脂肪细胞数量显著增加,造血干细胞数量减少,导致造血微环境损伤,这是AA发生发展的重要原因[18,19]。而采用自噬激活剂雷帕霉素通过上调骨髓间充质干细胞自噬水平降低其成脂性和脂肪细胞数量,改善骨髓造血微环境,这有利于造血干细胞增殖分化。近年来,随着免疫抑制剂在AA临床治疗中的广泛应用,免疫紊乱导致的造血组织损伤是AA发生发展的重要病理机制,而自噬在维持免疫稳态中的作用也越来越受到重视,自噬异常通过破坏免疫平衡导致AA等自身免疫性疾病发生。Pileston等[20]研究发现敲除小鼠自噬基因后将会破坏Th1/Th2细胞平衡,从而导致免疫紊乱。以上研究表明,自噬通过调控造血干细胞增殖分化、静息态维持、免疫功能等多种机制导致AA等免疫相关疾病发生发展。但健脾补肾方是否通过调控自噬活性发挥治疗作用尚不明确。本研究通过Real time-PCR和Western blot检测AA患者BMNC自噬、凋亡相关基因表达变化,结果显示,治疗后2组BMNC LC3-Ⅱ、Bcl-2 mRNA和蛋白表达均明显高于治疗前,caspase-3、PARP mRNA和蛋白表达均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组Bcl-2 mRNA和蛋白表达高于对照组,caspase-3、PARP mRNA和蛋白表达低于对照组(P<0.05)。说明自噬缺陷和细胞凋亡在AA发病中发挥一定作用,健脾补肾方能够通过上调自噬标志性基因表达,下调凋亡基因表达诱导细胞自噬并抑制其凋亡,这可能是其发挥治疗作用的分子机制之一。


