健康体检人群13C呼气试验与血清胃蛋白酶原检查结果相关性分析
王文雅 刘敬 郭上玮 张华 刘敬雅 刘玮
13C呼气试验和血清胃蛋白酶原(pepsinogen,PG)检测是临床常用的实验室检查方法,前者是公认的检测幽门螺杆菌(helicobacter pylori,H.Pylori)感染的金标准,后者则是目前新兴的胃癌早期筛查指标[1]。因此,目前在健康体检中许多医师倾向于对患者联合开展两项检查。然而有研究表明,13C呼气试验和血清胃蛋白酶原可能具有一定相关性[2,3],因此笔者认为两项检查在某些情况下可能可以互相替代。因此笔者对1 902例体检者13C呼气试验和血清胃蛋白酶原检测结果的相关性进行了研究,报道如下。
1 资料与方法
1.1 一般资料 选取2018年8~10月在我院体检的1 902人作为研究对象,其中男1 219例,女683例;年龄22~67岁,平均年龄(37.19±7.41)岁。
1.2 纳入与排除标准
1.2.1 纳入标准:①2018年某单位在我院进行体检者;②患者自愿参与本研究,并签署知情同意书。
1.2.2 排除标准:①既往确诊胃炎、胃溃疡、胃癌等胃肠道疾病或其他可能影响13C呼气试验和血清胃蛋白酶原检测结果的疾病的患者;②既往接受过胃切除术、迷走神经切断术等胃部手术治疗的患者;③研究前1个月内曾口服抗生素、胃黏膜保护剂、抑酸剂等可能影响研究结果的药物的患者;④研究前未严格禁食的患者;⑤合并智力、精神异常无法配合研究的患者。
1.2.3 剔除标准:①试验前隐瞒自身病情的患者;②体检发现影响研究结果的胃肠道疾病的患者。
1.3 研究方法
1.3.1 试验设计:通过查阅既往文献估算样本量后,与衡水市某单位进行协调沟通后,确定以该单位为研究对象,并在组织体检前设计并统一发放调查问卷,了解该单位员工性别年龄分布、既往消化道疾病和其他可能影响到研究的疾病病史、用药史,以及患者参加研意愿,同意参加研究者可在原体检项目基础上免费增加血清PG检测,并对患者参加体检前禁食水>6 h、停用部分药物进行说明和指导。之后按单位分期分批组织人员体检,最终按照纳入和排除标准,在实际参加体检的2 375例,排除456例,剔除17例,最终将1 902例体检对象纳入研究。
1.3.2 检测方法
1.3.2.113C呼气试验:体检人员检查前禁食水4~6 h,体检时嘱患者静坐休息5 min,之后以正常呼吸节律向吹气卡内吹满气体,拧紧吹气卡盖子并标记为本底样本。之后嘱患者通过80~100 ml温水嚼服尿素(13C)药片(北京海德润医药集团生产,国药准字号:H20174047,规格:10片/板/袋,2袋/盒),之后安静休息并禁食、水,待20 min后再次以正常呼吸节律向第二个吹气卡内吹满气体,标记为实验样本。采用北京万联达信息科技有限公司生产的WLD60013C呼气分析仪,采用红外光谱法对两袋样本进行分析,通过仪器按照δ=[(13CO2/12CO2)样品/(13CO2/12CO2)标准品-1]×1000‰的公式自动测量本地样品和实验样品的δ值,由δ实验样本-δ本底样本即可得出DOB值(delta over baseline)值,DOB值≥4.0即为检查结果阳性,提示存在HP的感染。
1.3.2.2 血清胃蛋白酶原检测:血清PG检测采用必欧瀚试剂,使用雅培i2000检测仪采用化学发光微粒子免疫检测法进行检测。受试者空腹采集静脉血5 ml,离心分离血清后,按照说明书规定程序混匀试剂盒并装机,依次进行校准、进样、稀释、测定等操作,由仪器自动完成测定并显示受试者PGⅠ、PGⅡ和PGⅠ/PGⅡ比值。
1.3.3 试验分组:根据受试者年龄<35岁、35~45岁、46~55岁和年龄≥55岁划段,并根据13C呼气试验结果划分为<35岁阳性组、<35岁阴性组、35~45岁阳性组、35~45岁阴性组、46~55岁阳性组、46~55岁阴性组、>55岁阳性组、>55岁阴性组6组,比较同一年龄段13C呼气试验结果为阳性及阴性受试者PGⅠ、PGⅡ和PGⅠ/PGⅡ比值差异情况;根据受试者性别及13C呼气试验结果划分为男性阳性组、男性阴性组、女性阳性组、女性阴性组,比较同一性别13C呼气试验结果为阳性及阴性受试者PGⅠ、PGⅡ和PGⅠ/PGⅡ比值差异情况。
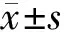
2 结果
2.1 不同性别受试者13C呼气试验阳性组与阴性组胃蛋白酶原水平差异情况分析 男性13C呼气试验阳性组受试者PGⅠ、PGⅡ水平明显高于阴性组,差异有统计学意义(PGⅠ:U=8.261,P=0;PGⅡ:U=13.492,P=0);受试者PGⅠ/PGⅡ明显低于阴性组,差异有统计学意义(U=-11.073,P=0)。女性13C呼气试验阳性组受试者PGⅠ、PGⅡ水平明显高于阴性组,差异有统计学意义(PGⅠ:U=4.647,P=0;PGⅡ:U=7.424,P=0);受试者PGⅠ/PGⅡ明显低于阴性组,差异有统计学意义(U=-11.153,P=0)。见表1、2。
2.2 不同年龄段受试者13C呼气试验结果阳性组与阴性组胃蛋白酶原水平差异情况分析 <35岁13C呼气试验阳性组受试者PGⅠ、PGⅡ水平明显高于阴性组,差异有统计学意义(PGⅠ:U=8.14,P=0;PGⅡ:U=10.60,P=0);受试者PGI/PGⅡ水平明显低于阴性组,差异有统计学意义(U=-9.56,P=0)。35~45岁以下13C呼气试验阳性组受试者PGⅠ、PGⅡ水平明显高于阴性组,差异有统计学意义(PGⅠ:U=6.32,P=0;PGⅡ:U=8.63,P=0);受试者PGⅠ/PGⅡ水平明显低于阴性组,差异有统计学意义(U=-9.94,P=0)。46~55岁13C呼气试验阳性组受试者PGⅠ、PGⅡ水平明显高于阴性组,差异有统计学意义(PGⅠ:U=2.25,P=0.03;PGⅡ:U=6.385,P=0);受试者PGⅠ/PGⅡ水平明显低于阴性组,差异有统计学意义(U=-9.94,P=-6.26)。>55岁13C呼气试验阳性组受试者PGⅠ水平与阴性组差异无统计学意义(U=-0.34,P=0.734);受试者PGⅡ水平明显高于阴性组,其差异有统计学意义(U=2.04,P=0.04);受试者PGⅠ/PGⅡ水平明显低于阴性组,差异有统计学意义(U=-2.35,P=0.02)。见表3~6。
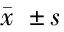

组别PGⅠPGⅡPGⅠ/PGⅡ13C呼气试验阳性组(n=460)57.42±21.3911.24±6.405.78±1.8913C呼气试验阴性组(n=759)47.17±20.316.99±2.836.954±1.63U值8.26113.492-11.073P值000
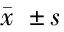

组别PGⅠPGⅡPGⅠ/PGⅡ13C呼气试验阳性组(n=231)51.19±19.0410.68±5.625.34±1.6013C呼气试验阴性组(n=452)40.87±30.876.57±8.786.79±1.61U值4.6477.424-11.153P值000
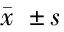

组别PGⅠPGⅡPGⅠ/PGⅡ<35岁13C呼气试验阳性组(n=258)55.18±21.1911.07±6.705.65±1.81<35岁13C呼气试验阴性组(n=450)42.93±15.336.42±2.476.94±1.68U值8.1410.6-9.56P值000
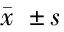

组别PGⅠPGⅡPGⅠ/PGⅡ35~45岁13C呼气试验阳性组(n=313)55.38±20.9711.02±0.345.66±1.7935~45岁13C呼气试验阴性组(n=553)44.53±29.216.92±7.956.86±1.53U值6.328.63-9.94P值000
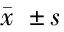

组别PGⅠPGⅡPGⅠ/PGⅡ46~55岁13C呼气试验阳性组(n=100)55.98±19.3411.20±5.215.50±1.7646~55岁13C呼气试验阴性组(n=177)48.61±29.377.35±4.046.86±1.72U值2.256.385-6.26P值0.0300
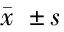

组别PGⅠPGⅡPGⅠ/PGⅡ>55岁13C呼气试验阳性组(n=20)53.29±22.4310.48±5.395.60±2.35>55岁13C呼气试验阴性组(n=31)55.60±24.258.12±2.877.00±1.87U值-0.342.04-2.35P值0.7340.040.02
2.3 受试者13C呼气试验结果与PG原检测结果相关性分析 通过上述分析表明,不同性别、年龄段人群PG原水平与13C呼气试验结果和HP感染状态具有一定相关性,其中>55岁组PGⅠ未检出统计学差异的主要原因在于样本过小。故采用Pearson相关分析以进一步量化PG原水平与13C呼气试验结果的相关关系,结果表明受试者PGⅠ水平与13C呼气试验结果呈正相关(r=0.187,P<0.05);受试者PGⅡ水平与13C呼气试验结果呈正相关(r=0.306,P<0.05);受试者PGI/PGⅡ水平与13C呼气试验结果呈负相关(r=-0.325,P<0.05)。见表7。

表7 受试者13C呼气试验结果与胃蛋白酶原检测结果相关性分析
2.4 不同年龄组受试者13C呼气试验结果与PG原检测结果相关性分析 <35岁组受试者PGⅠ、PGⅡ与13C呼气试验结果呈正相关(PGⅠ:r=0.322,P<0.05;PGⅡr=0.445,P<0.05);受试者PGⅠ/PGⅡ水平与13C呼气试验结果呈负相关(r=-0.333,P<0.05)。35~45岁组受试者PGⅠ、PGⅡ与13C呼气试验结果呈正相关(PGⅠ:r=0.176,P<0.05;PGⅡr=0.26,P<0.05);受试者PGI/PGⅡ水平与13C呼气试验结果呈负相关(r=-0.336,P<0.05)。46~55岁组受试者PGⅡ与13C呼气试验结果呈正相关(r=0.061,P<0.05);受试者PGⅠ/PGⅡ水平与13C呼气试验结果呈负相关(r=-0.366,P<0.05);受试者PGⅠ水平与13C呼气试验结果呈正相关(r=0.061,P>0.05),但无统计学意义。>55岁组受试者PGⅠ、PGⅡ与13C呼气试验结果(PGⅠ:r=0.09,PGⅡr=0.091),受试者PGⅠ/PGⅡ水平与13C呼气试验结果(r=-0.109),差异均无统计学意义(P>0.05)。见表8。

表8 不同年龄组受试者13C呼气试验结果与胃蛋白酶原检测结果相关性分析
3 讨论
PG是由375个氨基酸组成的胃蛋白酶的无活性前体,平均分子量为4 000。根据其细胞来源、组织分布、生化特征和免疫原性又可细分为1~7组,其中1~5组主要由胃体和胃底腺体的黏液颈细胞、主细胞形成和分泌,加之免疫原性近似,故统称为PGⅠ或PG A;6~7组主要由胃窦、胃体、胃底、幽门腺体细胞形成和分泌,十二指肠上段Brunner腺、前列腺和胰腺也可产生少量PGⅡ,加之免疫原性相近,故统称为PGⅡ或PG C[4]。其中胃黏膜产生的PGⅠ约占PG总量的75%,PGⅡ约占PG总量的25%。PG产生后99%直接经胃黏膜分泌如胃腔,并在胃酸的作用下脱掉44个氨基酸而形成胃蛋白酶;1%的PG则通过胃黏膜毛细血管进入血液循环[5]。由于PG原几乎是全部由胃黏膜分泌,且具有明显的分布位置区别,因此可以通过测定血清内PGⅠ、PGⅡ其分泌量及其比例的变化来反映胃黏膜病变的部位。大量研究表明血清PGⅠ、PGⅡ和PGI/PGⅡ比值的变化与各类胃黏膜病变具有相关性,且可以作为早期胃癌的筛查指标,甚至有“血清学活检”之称[6]。如《中国早期胃癌筛查流程专家共识意见(草案)》[7]中即提出将可将PGⅠ≤70 μg/L且PGⅠ/PGⅡ≤3作为无症状健康人群的胃癌筛查界限值。13C呼气试验则是目前体检筛查H.pylori感染的金标准,H.pylori是一种嗜酸性螺旋形革兰氏阴性菌,是目前所知的唯一能够在人体胃酸环境中生存的微生物。它存在于胃黏膜上皮表面和黏液底层,胃窦部为定植的最佳部位,胃体和胃底较少,其可通过毒素、有毒性作用的酶和诱导的黏膜炎性反应造成胃黏膜损害,从而导致胃和(或)十二指肠溃疡,而这些疾病都又是重要的癌前病变,因此WHO下属国际癌症研究机构(IACR)于1994年将H.pylori列为人类胃癌第Ⅰ类致癌原[8];《中国早期胃癌筛查流程专家共识意见(草案)》进一步指出,胃癌的发生时H.pylori感染、遗传和环境因素共同作用的结果,其中环境因素的作用次于H.pylori感染,并将H.pylori感染筛查作为胃癌必要的筛查内容之一。鉴于此,目前一些研究提出可联合应用血清PG和13C呼气试验,从而提高胃部疾病的检出率和诊断准确性,如顾蓁等[9]研究表明两者联用可提高儿童慢性胃炎筛查准确性,苑萌等[10]报道血清PG和13C呼气试验联用可提高老年人胃癌癌前病变的诊断效能等。因此目前部分临床医师倾向于将两者联合用应用以提高诊断效能,此举虽然可提高诊断效率,但也增加了体检者的检查费用,一定程度上降低了体检者的受检意愿[11]。因此,考虑到PG和13C呼气试验结果可能具有一定相关性,如果在一定范围内能够使用其中一种结果替代另一种检验结果,则可以有效降低体检费用,从而提高居民体检意愿和检出率。
本次研究表明,在性别方面,男、女性13C阳性者的血清PGⅠ、PGⅡ水平明均显高于阴性组,PGⅠ/PGⅡ水平低于阴性组;在年龄方面,<55岁人群PGⅠ、PGⅡ水平与13C检测结果呈显著正相关关系,与PGⅠ/PGⅡ水平呈显著负相关关系,证明在一定条件范围内,两种检查存在相互替代的可能性,这与闻华等[12]的研究结果相一致。其具体原因目前尚不明确,推测可能与H.pylori对胃窦部破坏作用明显有关。对于年龄>55岁组所有PG指标与H.pylori感染均无明显相关性,考虑可能与老年人胃酸的分泌降低有关。当然,本研究也存在样本量过小的缺点,且仅探明了PG水平于13C呼气试验结果在<45岁人群中存在相关性,但并未能阐明其具体机制,也没有进行准确的定量研究揭示两者的具体关系。对于上述问题,笔者将在今后进行进一步研究,并做后续报道。

