氧化苦参碱对CUMS抑郁模型小鼠抑郁样行为的改善作用研究
张景正 陈娴 鲍真真 钟嫄 张思访
抑郁症是一种情感障碍性疾病,严重困扰着患者的工作、学习和生活。随着社会的不断发展,人们的生活和升学压力日趋增加,使人们长期处于高度紧张的应激状态,越来越多的人因此遭受到抑郁症的威胁,预计到2020年,抑郁症将成为全球第二大疾病,给更多的人带来隐形的负担[1]。尽管目前的抗抑郁药物多种多样,但是均存在着较多的不良反应,如心血管系统毒性、恶心、嗜睡、便秘、失眠、体位性低血压和中枢神经系统毒性等[2-5]。近年来,国家将中医药发展纳入了国家发展战略,而且中药是汉族传统医术指导下应用的药物,与西药相比存在不良反应较少的特点,因此从天然产物中寻找具有抗抑郁活性的中药活性成分,成为抗抑郁药物研究的一个重要方面。氧化苦参碱是从豆科槐属植物苦参中提取出的生物碱,具有四环喹嗪啶类结构。临床实验表明其具有广泛的药理学作用,如抗心律失常、抗肿瘤、保肝、抗炎抗过敏等等[6-8]。近年来研究表明,氧化苦参碱可通过对抗氧自由基,对小鼠脑缺血产生保护作用[9]。另有研究表明氧化苦参碱可以通过降低体内自由基和炎性反应,对于中枢神经系统具有较好的保护作用[10],而抑郁症的发病也多伴随氧化应激紊乱及炎症的发生。除此之外,氧化苦参碱对于癫痫及阿尔茨海默病大鼠均具有较好的改善作用[11],但是其能否改善慢性不可预知性刺激(chronic unpredicted mild stess,CUMS)导致的小鼠抑郁样行为,目前尚未见研究报道。因此本研究通过建立CUMS抑郁小鼠模型,采用氧化苦参碱干预,观察氧化苦参碱对于抑郁小鼠行为学的影响,并在此基础上测定小鼠血清中单胺类神经递质的变化,初步探究氧化苦参碱对于小鼠抑郁症状的影响。
1 材料与方法
1.1 材料 雄性昆明小鼠[合格证号:SYXK(苏)2010-0011],体重20~25 g,南京君科生物科技有限公司提供。氧化苦参碱购自陕西昂盛生物医药科技有限公司,含量98%,5-羟色胺(5-HT)酶联免疫试剂盒,去甲肾上腺素(NE)酶联免疫试剂盒,皮质醇(CORT)酶联免疫试剂盒购自美国R&D公司,丙二醛(MDA)测定试剂盒,GSH(谷胱甘肽)测定试剂盒和过氧化氢酶(CAT)测定试剂盒购自南京建成生物工程研究所。
1.2 主要仪器设备 UV-754紫外可见分光光度计、SSH-2型电热恒温水浴均为上海精密科学仪器有限公司产品,TGL-16G 台式高速离心机为上海安亭科学仪器厂。
1.3 实验方法
1.3.1 小鼠慢性不可预知性刺激模型建立:将昆明小鼠随机分为6组,每组10只,分别为正常组(Contrlol)、模型组(CUMS)、氧化苦参碱低剂量组(OMT+Low)、氧化苦参碱中剂量组(OMT+Middle)、氧化苦参碱高剂量组(OMT+Hight)、氟西汀组(Fluoxetine)。适应3 d后,除正常组外,其他各组采取孤养模式,并且每天随机给予1~2种刺激,以复制慢性应激抑郁模型,刺激包括禁食(12 h)、禁水(12 h)、昼夜颠倒、冷水游泳(4℃,5 min)、热水游泳(45 min,5 min)、倾斜鼠笼、潮湿垫料、束缚、夹尾、电击足底(1 min)、震荡,相同刺激因子不连续出现,持续接受35 d,在造模第1周开始给药,给药时间为每天上午9∶00,模型组注射与治疗组体积相同的溶媒,氧化苦参碱低剂量组给予剂量为40 mg/kg,氧化苦参碱中剂量组给予剂量为60 mg/kg,氧化苦参碱高剂量组给予剂量为80 mg/kg,氟西汀组给予剂量为3.3 mg/kg,溶媒均为0.9%氯化钠溶液,连续给药5周。
1.3.2 糖水偏好实验:造模开始前在安静的环境内先训练小鼠适应1%的蔗糖水,单笼饲养小鼠,每笼同时放置两个完全相同的水瓶。在第1个24 h内,两瓶均装有浓度为1%的蔗糖水;第2个24 h,1瓶装有浓度为1%的蔗糖水,1瓶装有纯水,之后取走2瓶水并称重。实验前和实验第5周,分别对每只小鼠进行1次糖水偏好实验,实验前先禁食禁水24 h,随后给予小鼠事先定量好的两瓶水:1瓶为浓度1%的蔗糖水,1瓶纯水,24 h后取走称重,分别记录蔗糖水和纯水的消耗量。计算糖水偏好率,糖水偏好率 =(糖水消耗量/总液体消耗量)× 100%。
1.3.3 强迫游泳实验:将小鼠置于高24 cm,直径15 cm的玻璃圆缸内,水温(25±1)℃条件下,强迫游泳6 min,观察并记录后4 min内小鼠的累计不动时间,当小鼠不再挣扎,浮在水中保持不动,或仅做一些必要的轻微动作保持头部浮在水面上的时间视为累计不动时间。
1.3.4 悬尾实验:将小鼠尾部(离尾尖约1 cm)固定于自制悬尾装置上(由不透明材料制成,长、宽、高均为40 cm 的正方体,利用铁架台固定小木夹制成),使鼠头离箱底约10 cm,3人同时观察小鼠6 min内的活动情况,记录后4 min内小鼠的累计不动时间,计算取平均值。
1.3.5 旷场实验:Open-field行为检测箱:由不透明材料制成,底面为50 cm × 50 cm的正方形,高为20 cm的箱体,敞底面为黑色,周壁为绿色。将小鼠置于旷场中央方格内,底面被等分为25个等边方格。观察小鼠在5 min内水平穿越格子数和直立次数,直立次数计数标准包括两前爪腾空、单爪或双爪攀附箱壁,除了直立次数利用人工记录外,其余指标采用SLY-ETS小动物行为活动记录分析系统记录。
1.3.6 Morris水迷宫实验:采用Morris水迷宫检测小鼠的学习记忆能力。水迷宫直径为120 cm,高60 cm的圆形水池,水深15.5 cm,在第一象限正中离池壁25 cm 处放置一个直径为10 cm,高14 cm的圆形平台,平台低于水面1.5 cm,水温保持在(25±2)℃,实验前水池中加入墨汁。小鼠连续接受4 d的训练,每天4次,分别记录小鼠从四个象限不同入水点入水找到平台所需的时间,即潜伏期,4次潜伏期的平均值作为当日最终成绩进入最后统计。如果小鼠在90 s内未找到平台,应将小鼠放到平台上,使其学习记忆,此种情况下潜伏期即为90 s,并记录小鼠每天的游泳速度。第5天撤掉平台,进行空间探索测试,观察小鼠90 s内在水池内的活动,记录小鼠到达平台的潜伏期、在目标象限停留时间百分比以及穿越平台的次数。
1.3.7 样本采集及生化指标测定:实验结束后,摘眼取血,分离血清,用于测定血清中5-HT、DA和CORT水平。断头取脑,采用酶联免疫法测定小鼠脑中中谷胱甘肽(GSH)和丙二醛(MDA)的含量以及超氧化物歧化酶(SOD)的活性。
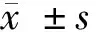
2 结果
2.1 对小鼠糖水偏好率的影响 造模前,6组小鼠的糖水偏好率接近且均无显著性差异(P>0.05)。造模和给药5周后,与正常组相比,模型组小鼠糖水偏好率显著降低(P<0.01),与模型组比较,氧化苦参碱低剂量组小鼠糖水偏好率升高(P<0.05),中高剂量组及氟西汀组小鼠糖水偏好率均显著升高(P<0.01)。见表1。
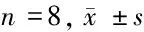
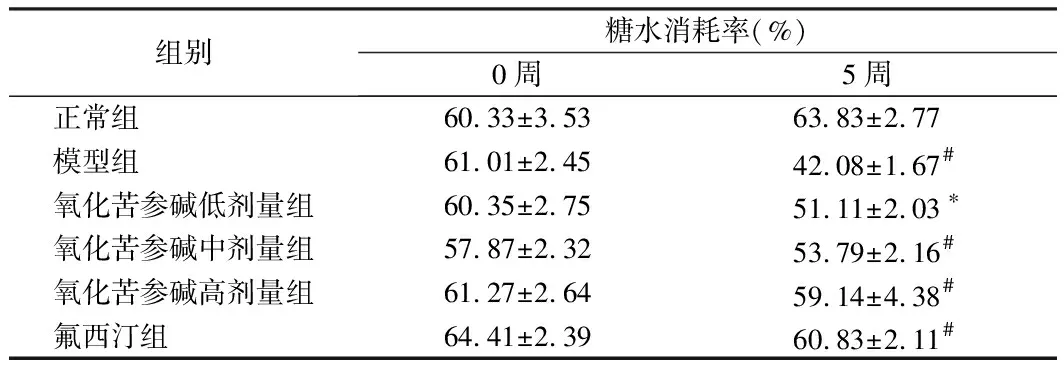
组别糖水消耗率(%)0周5周正常组 60.33±3.5363.83±2.77模型组 61.01±2.4542.08±1.67#氧化苦参碱低剂量组60.35±2.7551.11±2.03∗氧化苦参碱中剂量组57.87±2.3253.79±2.16#氧化苦参碱高剂量组61.27±2.6459.14±4.38#氟西汀组 64.41±2.3960.83±2.11#
注:与正常组比较,*P<0.05,#P<0.01
2.2 对小鼠旷场实验的影响 实验开始时,用旷场实验对小鼠进行筛选,各组小鼠水平穿越格子数和直立次数均没有明显的变化(P>0.05),造模和给药5周后,与正常组相比,模型组小鼠水平穿越格子数和直立次数显著降低(P<0.05),与模型组相比,氧化苦参碱低剂量组小鼠水平穿越格子数和直立次数升高(P<0.05),氧化苦参碱中高剂量组和氟西汀组小鼠水平穿越格子数和直立次数均显著升高(P<0.05或<0.01)。见表2。
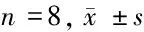
注:与正常组比较,*P<0.05,#P<0.01
2.3 对小鼠强迫游泳实验和悬尾实验不动时间的影响 造模和给药5周后进行强迫游泳实验,与正常组相比,模型组小鼠强迫游泳和悬尾不动时间均显著升高(P<0.01),与模型组相比,氧化苦参碱低剂量组小鼠强迫游泳和悬尾不动时间均降低(P<0.05),氧化苦参碱中高剂量组及氟西汀组小鼠强迫游泳和悬尾不动时间均显著降低(P<0.01)。见表3。
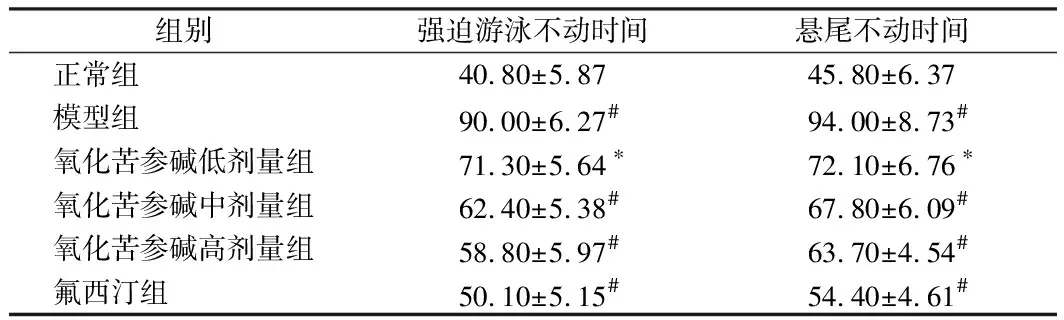
组别强迫游泳不动时间悬尾不动时间正常组 40.80±5.8745.80±6.37模型组 90.00±6.27#94.00±8.73#氧化苦参碱低剂量组71.30±5.64∗72.10±6.76∗氧化苦参碱中剂量组62.40±5.38#67.80±6.09#氧化苦参碱高剂量组58.80±5.97#63.70±4.54#氟西汀组 50.10±5.15#54.40±4.61#
注:与正常组比较,*P<0.05,#P<0.01
2.4 对抑郁小鼠学习记忆能力的影响
2.4.1 采用Morris水迷宫实验检测抑郁小鼠的学习记忆能力,在5 d的实验中6组小鼠的平均潜伏期都有所下降。从第2天起,与正常组相比,模型组小鼠的潜伏期显著升高(P<0.01),与模型组相比,氧化苦参碱高剂量组和氟西汀组小鼠的潜伏期显著降低(P<0.01),其他给药组较模型组无显著性差异(P>0.05);从第3天起,与模型组相比,氧化苦参碱低剂量组,小鼠的潜伏期降低(P<0.05),氧化苦参碱中剂量组,小鼠的潜伏期显著降低(P<0.01);从第4天起,与模型组相比,氧化苦参碱中高剂量组及氟西汀组,小鼠的潜伏期均显著降低(P<0.01)。见表4。
2.4.2 在目标探索实验中,模型组小鼠在目标象限所待的百分比以及穿越平台次数较正常组均显著降低(P<0.01)。与模型组相比,氧化苦参碱低剂量组,小鼠在目标象限的百分比及穿越平台次数升高(P<0.05),氧化苦参碱中高剂量组和氟西汀组,小鼠在目标象限的百分比以及穿越平台次数均显著升高(P<0.01)。说明抑郁小鼠的学习记忆能力较正常组显著降低,而分别给予氧化苦参碱,氟西汀治疗后,小鼠的学习记忆能力得到改善。在5天的实验中6组小鼠的游泳速度无显著性的差异(P>0.05),说明6组小鼠的运动性并没有对小鼠的潜伏期、目标象限停留时间百分比以及穿越平台的次数造成影响。见表5、6。
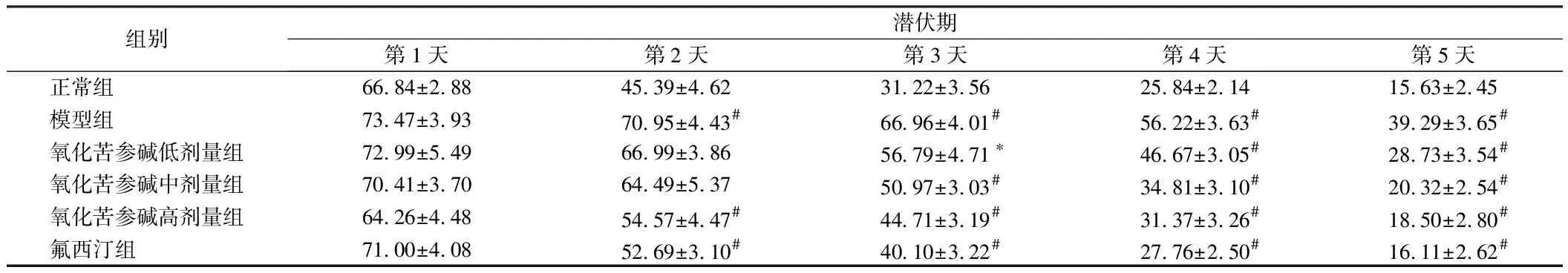
组别潜伏期第1天第2天第3天第4天第5天正常组 66.84±2.8845.39±4.6231.22±3.5625.84±2.1415.63±2.45模型组 73.47±3.9370.95±4.43#66.96±4.01#56.22±3.63#39.29±3.65#氧化苦参碱低剂量组72.99±5.4966.99±3.8656.79±4.71∗46.67±3.05#28.73±3.54#氧化苦参碱中剂量组70.41±3.7064.49±5.3750.97±3.03#34.81±3.10#20.32±2.54#氧化苦参碱高剂量组64.26±4.4854.57±4.47#44.71±3.19#31.37±3.26#18.50±2.80#氟西汀组 71.00±4.0852.69±3.10#40.10±3.22#27.76±2.50#16.11±2.62#
注:与正常组比较,*P<0.05,#P<0.01

组别潜伏期第1天第2天第3天第4天第5天正常组 24.36±2.3824.49±3.1425.01±2.4620.13±2.0224.71±3.74模型组 27.13±2.1427.06±2.4626.54±2.3523.67±2.5028.42±1.31氧化苦参碱低剂量组23.42±1.5222.51±1.8922.37±2.6220.05±1.7527.28±2.43氧化苦参碱中剂量组27.57±2.2925.31±1.5228.05±1.1427.52±2.4732.31±1.96氧化苦参碱高剂量组27.42±4.9123.61±0.6121.56±1.6923.76±1.4226.92±4.65氟西汀组 27.22±0.9927.23±2.7623.77±2.2625.30±1.0526.29±4.03
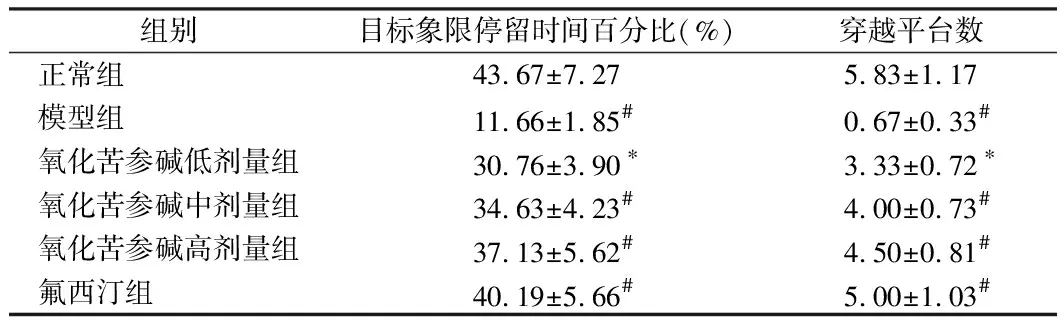
组别目标象限停留时间百分比(%)穿越平台数正常组 43.67±7.275.83±1.17模型组 11.66±1.85#0.67±0.33#氧化苦参碱低剂量组30.76±3.90∗3.33±0.72∗氧化苦参碱中剂量组34.63±4.23#4.00±0.73#氧化苦参碱高剂量组37.13±5.62#4.50±0.81#氟西汀组 40.19±5.66#5.00±1.03#
注:与正常组比较,*P<0.05,#P<0.01
2.5 对小鼠血清中5-HT、DA和CORT水平的影响 与正常组相比,模型组小鼠血清中5-HT、DA水平显著降低(P<0.01),CORT水平显著升高(P<0.01),与模型组相比,氧化苦参碱低剂量组小鼠血清中5-HT、DA水平升高(P<0.05),CORT水平降低(P<0.05),与模型组相比,氧化苦参碱中高剂量组和氟西汀组小鼠血清中5-HT、DA水平显著升高(P<0.01),血清中CORT水平显著降低(P<0.01)。见表7。

组别5-HT含量(ng/ml)DA含量(ng/μl)CORT含量(ng/ml)正常组 86.66±6.697.03±0.5619.01±4.48模型组 76.14±5.62#5.81±0.51#30.39±4.87#氧化苦参碱低剂量组82.56±6.71∗6.50±0.63∗25.48±5.38∗氧化苦参碱中剂量组83.52±6.75#6.72±1.03#24.91±5.59#氧化苦参碱高剂量组85.26±5.61#7.03±0.62#21.70±4.58#氟西汀组 88.25±3.97#7.05±0.49#22.28±4.44#
注:与正常组比较,*P<0.05,#P<0.01
2.6 对小鼠脑组织中谷胱甘肽含量(GSH)和丙二醛(MDA)的含量及超氧化物歧化酶(SOD)的活性的影响 与正常组相比,模型组小鼠脑中MDA含量显著升高(P<0.01),GSH含量显著降低(P<0.01),SOD活性显著降低(P<0.01),与模型组相比,氧化苦参碱低剂量组小鼠脑中MDA含量降低(P<0.05),GSH含量升高(P<0.05),SOD活性升高(P<0.05),氧化苦参碱中高剂量组及氟西汀组小鼠脑中MDA含量均显著降低(P<0.01),GSH含量均显著升高(P<0.01),SOD活性均显著升高(P<0.01)。见表8。
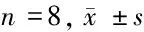

组别SOD活性(U/mgprog)MDA含量(nmol/mgprog)GSH含量(mg/gprog)正常组 68.38±6.5427.20±3.8120.11±2.81模型组 56.75±7.27#34.48±6.47#15.62±2.74#氧化苦参碱低剂量组63.72±8.10∗29.18±3.74∗18.85±3.80∗氧化苦参碱中剂量组66.72±5.87#28.12±3.63#19.45±1.83#氧化苦参碱高剂量组67.45±5.31#25.49±3.15#20.07±1.66#氟西汀组 69.96±7.07#26.71±3.89#20.58±2.02#
注:与正常组比较,*P<0.05,#P<0.01
3 讨论
抑郁症是一种复杂的情感障碍性疾病,促发因素多种多样,而我们现代社会比较常见的就是高压力的应激性生活,这类应激性生活事件具有慢性、低强度、长期存在的特点。为了较好的模拟这种生活状态,本文采用慢性不可预知性刺激建立抑郁小鼠模型,它也是目前国际认可的科学评价抗抑郁药物的主要动物模型[12,13]。本实验成功复制CUMS小鼠抑郁模型,与正常组相比,模型组小鼠糖水偏好率、水平穿越格子数和直立次数明显降低,强迫游泳和悬尾实验中小鼠不动时间明显延长,水迷宫实验结果显示,与正常组相比,模型组小鼠的潜伏期明显降低,目标象限停留时间及穿越平台次数明显升高,以上结果表明通过35 d的慢性不可预知性刺激,小鼠明显产生兴奋度降低,自主活动度降低,认知功能降低的现象,而此类行为学变化恰好为抑郁症患者的主要表现。给予氧化苦参碱干预后,小鼠以上行为学上的异常明显得到改善,给予氟西汀干预组小鼠的行为学异常也明显得到改善。由此表明氧化苦参碱可能具有一定的抗抑郁作用。
HPA轴作为神经内分泌系统的重要成分是机体应对应激刺激的主要反应途径,在机体受到应激刺激时,HPA轴会在CRH的作用下被启动,进而产生一系列的连锁反应[14],导致HPA轴过度激活,其中血清CORT大量分泌是HPA轴亢进的重要指标,并且有研究表明高浓度的CORT可选择性的损伤大脑的海马神经元,是抑郁症产生的生理生化基础之一[15]。本实验结果显示,慢性不可预知性刺激导致小鼠血清中CORT含量明显升高,HPA功能明显亢进,而不同剂量的氧化苦参碱与阳性给药组表现出一致的作用,由此可以看出氧化苦参碱在一定程度上抑制HPA轴的亢进,显著降低血清中CORT水平。
抑郁症的发病机制多种多样,其中比较公认的就是“单胺假说”,该学说认为,抑郁症的生物学基础是:由于相关脑区神经递质的合成或储存减少、降解增加或受体功能的改变,导致特定的神经传导通路上的单胺的功能下降[16]。单胺类神经递质包括5-HT、DA、多巴胺等,这些神经递质,主要影响人的精神活动、情绪反应和学习记忆等功能。因此,本研究,通过测定小鼠血清中5-HT和DA的含量来检测各组小鼠的抑郁情况。实验结果表明,慢性不可预知性刺激可以明显降低小鼠血清中5-HT和DA的含量,再次验证了相关文献的结论,除此之外,不同剂量的氧化苦参碱与阳性给药组均可以明显降低小鼠血清中5-HT和DA的含量,这可能与其改善小鼠抑郁样行为密切相关。
抑郁症的发生除了与HPA轴功能亢进有关之外,还与神经系统的氧化应激失衡密切相关[17,18]。脑组织对于氧自由基导致的损伤非常敏感,过度的氧自由基堆积,容易引起机体的氧化损伤,而这种损伤可能会引起精神障碍,因而氧化应激系统激活可能是导致抑郁症患者认知功能损伤的重要原因之一。SOD是体内重要的自由基清除剂,其功能受到影响是导致大量自由基堆积的重要原因。GSH和MDA的含量直接代表着小鼠脑内氧化应激的水平。由此本研究,通过测定小鼠脑中GSH和MDA的含量以及SOD的活性来探究其可能的作用机制。实验结果表明,抑郁小鼠脑中氧化应激系统出现明显失衡,而给予氧化苦参碱及氟西汀分别进行干预后,其氧化应激系统得到改善,这可能与其认知功能得到改善密切相关。

