子宫内膜癌组织中miR-143、HIF-1α mRNA表达及与患者临床病理参数的关系
陈红林,曾庆维,,陈晓宇,李桂荣,刘静云
1开滦总医院林西医院,河北唐山063000;2唐山市妇幼保健院
子宫内膜癌发病率上升且呈低龄化趋势,严重威胁女性健康[1]。子宫内膜癌术后远处转移率较高,患者5年生存率低[2],因此,明确子宫内膜癌发病相关分子生物学机制,对探索新治疗靶点、改善患者预后有重要意义[3]。miRNA-143(miR-143)编码位于人染色体5q32,被证实在多类恶性肿瘤中呈相对高表达或低表达,参与肿瘤的发生与进展[4]。目前国内针对miR-143与子宫内膜癌关系的研究甚少。缺氧诱导因子1α(HIF-1α)在子宫内膜癌等多种恶性肿瘤中过表达,与肿瘤细胞的增殖、转移等密切相关[5]。近期研究发现,HIF-1α作为miR-143的靶基因参与恶性肿瘤的发生进展[6,7]。基于此,本研究观察了子宫内膜癌组织中miR-143、HIF-1α mRNA的表达变化,分析二者与子宫内膜癌临床病理参数的关系。
1 资料与方法
1.1 组织标本和临床资料 2017年1月~2019年7月行手术治疗的子宫内膜癌患者126例,收集手术切除的子宫内膜癌组织标本及相应癌旁组织标本(距肿瘤边缘至少5 cm)。所有标本在离体后30 min内快速置入液氮,存于-80 ℃冰箱中备测。纳入标准:①子宫内膜癌组织标本经病理学证实,癌旁组织标本经病理学证实无肿瘤细胞侵犯;②患者在术前未接受过免疫治疗、放化疗等抗肿瘤治疗。排除标准:①合并其他恶性肿瘤;②合并严重心脑血管疾病;③合并血液系统疾病。126例子宫内膜癌患者年龄31~72(54.68±8.79)岁,肿瘤最大直径≤2 cm 40例、>2 cm 86例,FIGO分期Ⅰ+Ⅱ期89例、Ⅲ+Ⅳ期37例,肿瘤分化程度为低分化59例、中分化36例、高分化31例,有淋巴结转移79例、无淋巴结转移47例,绝经85例、未绝经41例。本研究获得医院医学伦理委员会批准,患者均知情同意。
1.2 miR-143及HIF-1α mRNA检测 采用qRT-PCR法。根据miRNA提取试剂盒说明提取组织中总RNA,紫外分光光度仪检测总RNA含量、纯度,逆转录合成cDNA。将cDNA作为模板,进行qRT-PCR检测。miR-143上游引物序列为5′-TGTAGTTTTCGGAGTTAG-TGTCGCGC-3′,下游引物序列为5′-CCTACGATCGAAAAC-GACGCGAACG-3′;内参U6上游引物序列为5′-GTTTTGTAGTTTTTGGAGTTAGTGTTGTGT-3′,下游引物序列为5′-CTCAACCTACAATCAAAAACAACACAAACA-3′。HIF-1α上游引物序列为5′-ATCCATGTGACCATGAGGAAATG-3′,下游引物序列为5′-TCGGCTAGTTAGGGTACACTTC-3′;内参GAPDH上游引物序列为5′-ATCAAGAAGGTGGTGAAGCAGG-3′,下游引物序列为5′-CGTCAAAGGTGGAGGAGTGG-3′。PCR反应条件:95 ℃预变性4 min,95 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。以2-ΔΔCt表示miR-143及HIF-1α mRNA相对表达量。实验均重复3次。
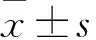
2 结果
2.1 子宫内膜癌组织和癌旁组织中miR-143、HIF-1α mRNA表达比较 子宫内膜癌组织及癌旁组织中miR-143相对表达量分别为0.35±0.05、1.12±0.13,HIF-1α mRNA相对表达量分别为2.64±0.27、0.97±0.09,子宫内膜癌组织中miR-143相对表达量低于癌旁组织,HIF-1α mRNA相对表达量高于癌旁组织(P均<0.05)。
2.2 miR-143及HIF-1α mRNA表达与子宫内膜癌临床病理参数的关系 miR-143在子宫内膜癌有淋巴结转移患者中表达低于无淋巴结转移患者(P<0.05),在FIGO分期Ⅲ+Ⅳ期患者中表达低于Ⅰ+Ⅱ期患者(P<0.05)。HIF-1α mRNA在子宫内膜癌有淋巴结转移患者中表达高于无淋巴结转移患者(P<0.05),在FIGO分期Ⅲ+Ⅳ期患者中表达高于Ⅰ+Ⅱ期患者(P<0.05)。miR-143和HIF-1α mRNA表达在不同年龄、肿瘤最大直径、肿瘤分化程度及绝经情况患者中差异均无统计学意义。详见表1。
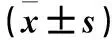
表1 miR-143、HIF-1α mRNA表达与子宫内膜癌临床病理参数的关系
2.3 子宫内膜癌组织中miR-143与HIF-1α mRNA表达的相关性 子宫内膜癌组织中miR-143与HIF-1α mRNA表达呈负相关(r=-0.952,P<0.01)。
3 讨论
子宫内膜癌的发生发展涉及复杂的生物学过程,目前临床诊治尚缺乏特异分子标志物,故分析肿瘤生物学特性、探寻潜在生物标志物成为研究重点。miRNA是基因转录过程中的重要调控因子。研究显示,miRNA参与细胞生命活动过程,可作用于特殊靶点,进而起抑癌基因或癌基因作用,参与肿瘤发生发展[8,9]。miR-143是miRNA家族重要成员,研究发现,miR-143在宫颈癌[10]、膀胱癌[11]、胃癌[12]等多种恶性肿瘤中呈相对低表达,通过作用于靶基因抑制肿瘤转移、侵袭,提高抗肿瘤药敏感性;而在肝细胞癌中miR-143呈相对高表达,发挥癌基因作用[13]。Wang等[14]通过体外实验发现,miR-143可结合靶基因的3′UTR,激活MAPK/ERK、PI3K/Akt信号途径,进而参与肿瘤细胞的转移。目前国内关于子宫内膜癌组织中miR-143表达情况的研究甚少。本研究表明,子宫内膜癌组织中miR-143表达水平低于癌旁组织,提示miR-143在子宫内膜癌中可能起抑癌基因作用。进一步分析显示,miR-143在子宫内膜癌有淋巴结转移患者中表达低于无淋巴结转移患者,在FIGO分期Ⅲ+Ⅳ期患者中表达低于Ⅰ+Ⅱ期患者,提示miR-143异常表达与子宫内膜癌的发生、发展关系密切。
HIF-1α是缺氧条件下的特异感受性转录因子,在血管新生、血管舒缩调节、维持肿瘤细胞能量代谢、促肿瘤细胞转移等方面具有多样生物学效应[15]。目前国内外研究证实,HIF-1α在肺癌、大肠癌、宫颈癌等肿瘤的发生与进展中起癌基因作用[16,17]。肿瘤细胞快速生长过程中,易导致子宫内膜癌组织内部缺氧,从而诱导HIF-1α表达。HIF-1α表达上调可与HIF-1β亚单位结合,再与目的基因缺氧反应元件结合,进而激活糖酵解酶、VEGF、促红细胞生成素、环氧合酶2等多种基因转录,从而促进血管新生。赵宁等[18]研究表明,HIF-1α在子宫内膜癌组织中表达增高,且与患者临床分期、淋巴结转移密切相关。另有资料显示,HIF-1α在子宫内膜不典型增生、正常组织中表达增高不明显,而在子宫内膜癌组织中表达增加显著[19]。本研究中,子宫内膜癌组织中HIF-1α mRNA表达水平高于癌旁组织;HIF-1α mRNA在有淋巴结转移患者中表达高于无淋巴结转移患者,在FIGO分期Ⅲ+Ⅳ期患者中表达高于Ⅰ+Ⅱ期患者,进一步证实HIF-1α参与了子宫内膜癌的发生发展,可作为潜在生物学标志物。
Zhao等[6]研究发现,miR-143过表达可降低肿瘤细胞中HIF-1α mRNA和蛋白表达水平,双荧光素酶报告基因测定表明HIF-1α是miR-143的直接靶标。He等[20]研究表明,在体外,miR-143模拟物的加入明显抑制了肿瘤细胞的迁移、增殖,进一步分析发现,miR-143通过下调HIF-1α表达发挥抑癌作用。以上研究提示,miR-143可能通过调控HIF-1α表达,进而共同影响肿瘤的产生、进展。本研究Pearson相关性分析显示,子宫内膜癌组织中miR-143与HIF-1α mRNA表达负相关,提示miR-143与HIF-1α在子宫内膜癌中可能存在靶向调控关系。
综上所述,子宫内膜癌组织中miR-143低表达,HIF-1α mRNA高表达,二者与子宫内膜癌的发生、发展关系密切,可能共同作用于子宫内膜癌的发生发展过程。但关于miR-143靶向调控HIF-1α在子宫内膜癌中的具体作用机制尚需进一步明确。

