颅骨与骨髓源性间充质干细胞移植治疗大鼠缺血性脑卒中疗效对比观察
苏红军,相蕾
1天津市宝坻区人民医院,天津301800;2天津环湖医院
近年来,中枢神经系统疾病的药物和手术治疗方面取得了较多进展,但尚不能提供根治性治疗。间充质干细胞(MSCs)移植作为一种治疗中枢神经系统疾病的新方法受到了广泛关注。有研究报道,在卒中模型中,MSCs移植可修复受损脑组织,促进神经功能恢复[1, 2]。一些研究表明,不同来源的MSCs的特征可能有所不同[3,4]。因此,MSCs移植的效果可能受MSCs来源的影响。在MSCs的来源中,颅骨穹窿和面部的一些骨组织来自颅神经嵴,四肢、髂骨和椎骨的骨组织来自中胚层[5]。Ullah等[6]研究显示,牙髓源性干细胞来源于颅神经嵴细胞,具有显著的神经源性活性,这是其他成人体细胞所没有的。基于这些发现,我们推测颅骨来源的MSCs(cMSCs)对中枢神经系统疾病(包括缺血性卒中)具有很高的治疗潜力。2017年6月~2019年6月,本研究对比观察了cMSCs与骨髓间充质干细胞(bMSCs)移植治疗大鼠缺血性脑卒中的效果。现报告如下。
1 材料与方法
1.1 实验动物与主要实验材料 雄性SD大鼠100只,4~10周龄,体质量250~300 g,购自上海斯莱克实验动物有限责任公司(动物使用许可证标号:SCXK沪2016-0005)。生长培养基购自美国Invitrogen公司。TrypLETMSelect购自美国Thermo Fisher Scientific公司。抗大鼠CD45、CD90、CD29、CD44和CD34均购自美国BD Biosciences公司。FACSVerse系统购自美国BD Biosciences公司。成骨诱导分化培养基购自德国Promocell公司。茜素红染液购自美国Sigma-Aldrich公司。油红O染色(10 μmol/L)购自美国Sigma-Aldrich公司。Eclipse TE300倒置荧光显微镜购自日本Nikon公司。TRIzolTM试剂盒购自美国Thermo Fisher Scientific公司。RT-PCR试剂盒购自美国Thermo Fisher Scientific公司。TUNEL溶液购自美国Roche公司。二氨基联苯胺(DAB)购自北京英特利根生物科技有限公司。
1.2 cMSCs与bMSCs的分离、鉴定 取6只4~5周龄雄性SD大鼠的股骨和胫骨作为骨髓标本,接种在生长培养基上,将黏附于培养皿底部的细胞作为第一代的bMSCs并传代数次,分离出bMSCs。取6只雄性SD大鼠的颅骨,将骨膜、肌肉、硬脑膜和嗅神经完全取出,将标本接种于生长培养基上,分离出cMSCs。收集第3代的bMSCs和cMSCs,通过流式细胞术检测MSCs特异性标志物进行鉴定,bMSCs :CD29、CD90、CD44、CD34、CD45阳性表达率分别为98.7%、99.1%、95.8%、0.3%、0.3%;cMSCs :CD29、CD90、CD44、CD34、CD45阳性表达率分别为99.2%、96.2%、98.1%、0.3%、0.3%。取80%~90%融合的P3代bMSCs和cMSCs,检测其成骨分化和成脂分化的能力以鉴定MSCs。结果见图1。
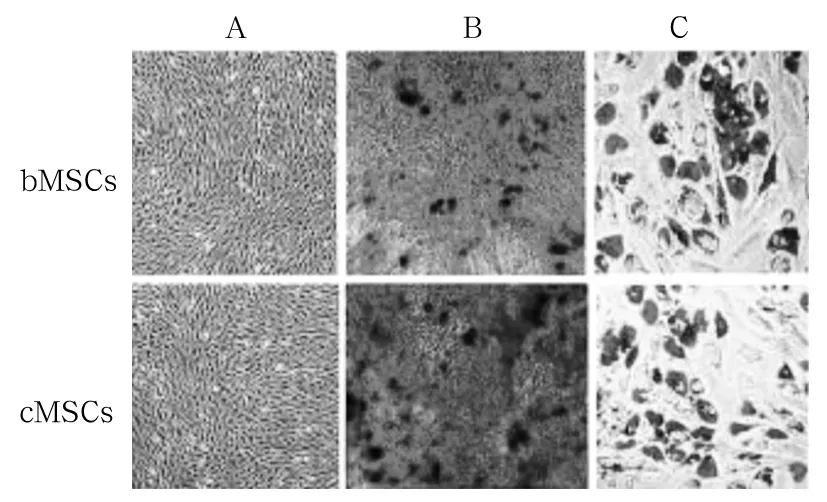
注:A为bMSCs和cMSCs的原细胞;B为分化后的成骨细胞;C为分化后的脂肪细胞。
图1 bMSCs和cMSCs向成骨细胞和脂肪细胞的分化潜能
1.3 cMSCs与bMSCs中神经嵴相关基因、神经营养因子检测 采用qRT-PCR法检测cMSCs与bMSCs中神经嵴相关基因(Snail、Slug)和神经营养因子(Bdnf、Gdnf、Ngf)的mRNA。
1.4 大脑中动脉闭塞模型(MCAO)建立与分组处理 随机选择90只大鼠建立MCAO模型。大鼠腹腔注射2%戊巴比妥钠(2 mL/kg)进行麻醉。取颈部中间切口,并在锁骨肌和胸腹肌之间找到右颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。将ECA的分叉结扎,同时将ECA与CCA的连接处结扎。动脉夹夹住CCA的近端部分。将3-0尼龙缝合线穿过ECA的近分叉的底部并打结,不完全收紧。在CCA的分叉距离1.0 mm处使用微剪刀仪器切口。将单丝尼龙缝合线轻轻插入ICA中,使其尖端达到大脑中动脉(MCA)起始点,将缝合线收紧以阻断MCA血液供应。将切口分层缝合,并将末端约1 cm的单丝尼龙缝合线留在外面。在缺血2 h后,小心拉出左单丝直至感觉到阻力,表明尖端已至CCA分叉处。恢复MCA血供。在再灌注21 d后处死大鼠并取出大脑,以供制备各种组织切片。另选择20只大鼠为假手术组,仅手术暴露CCA、ECA和ICA,但不对其进行处理。对建模大鼠进行Bederson评分[7],评分高于1分判定为建模成功。90只建模大鼠中,排除4只死亡大鼠,排除Bederson评分为0或4分的5只大鼠,在剩余81只大鼠中选择60只,随机分为模型组、bMSCs组、cMSCs组各20只。模型组单纯给予PBS,bMSCs组和cMSCs组大鼠分别在MCAO后24 h经尾静脉注射bMSCs、cMSCs(1.0×106/300 μL PBS)。模型组和假手术组在相同时间注射等体积的PBS。
1.5 运动功能评价 术后2、7、14、21 d分别进行平衡木实验和Garcia评分。每项测试进行3次,结果取均值。平衡木实验:将大鼠放在一条狭窄的木条(30.0 cm×1.3 cm)上平衡进行测定;四肢均在木条上平衡计1分,单侧肢体能抓住木或在木头上摇晃计2分,一条或两条肢体从木上滑落计3分,三条肢体从木上滑落计4分,在木上挣扎后摔倒计5分,悬挂在木头上挣扎后摔倒计6分,完全不挣扎立即摔倒计7分。Garcia评分包括评估自发活动、四肢对称运动、前爪伸直、攀爬、身体本体感觉和对触碰振动的反应。
1.6 海马组织病理观察 再灌注21 d后处死大鼠并取出大脑,将制成的海马组织石蜡切片在二甲苯Ⅰ和二甲苯Ⅱ中浸泡10 min。然后将切片依次用100%、95%、90%、75%乙醇洗涤5 min,苏木精染色10 min,再用1%苏红染色5 min,用中性树脂固定。在BZ-9000多功能显微镜下观察海马组织病理变化。
1.7 海马组织局灶性脑梗死(CI)面积测算 再灌注21 d后处死大鼠并取出大脑,将制备好的海马组织作2.0 mm厚冠状切片浸泡在TTC溶液中,37 ℃恒温黑暗中孵育,直到正常区域被染成亮红色、梗死区域被染成白色。将染色切片放入4%甲醛溶液固定24 h,取出脑切片,滤纸脱水。每组5个切片,随机抽取3个切片,用Image J软件分析并计算CI面积(梗死区面积占大脑总面积的百分比)。
1.8 海马组织神经元凋亡率测算 再灌注21 d后处死大鼠并取出大脑,取各组大鼠海马组织,用4%多聚甲醛固定,石蜡包埋,做3 μm厚切片,室温孵育15 min,PBS洗涤后,加入50 μL的TUNEL溶液,37 ℃培养60 min,然后加入50 μL转化剂过氧化物酶37 ℃中孵育30 min,再加入50 μL的DAB室温孵育10 min。苏木精再次用于细胞核染色,并在光学显微镜下对封闭切片进行图像分析。被染色呈黄色或棕色的细胞为TUNEL阳性细胞。每个切片选取6个不同的高倍视野进行观察,记录每个高倍视野下的 TUNEL阳性细胞数和细胞总数。根据公式计算细胞凋亡率。细胞凋亡率=TUNEL阳性细胞/总细胞数×100%。
2 结果
2.1 cMSCs与bMSCs中神经嵴相关基因、神经营养因子表达比较 cMSCs中Snail、Slug、Bdnf、Gdnf、Ngf mRNA相对表达量均高于bMSCs(P均<0.05)。见表1。
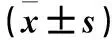
表1 bMSCs和cMSCs中Snail、Slug、Bdnf、Gdnf、Ngf mRNA表达比较
注:与bMSCs相比,*P<0.05。
2.2 各组大鼠运动功能评分比较 假手术组均未发现明显的神经功能障碍,其他三组大鼠均表现出不同程度的神经功能障碍。随着时间的推移,各组从平衡木实验得分逐渐下降,Garcia评分逐渐升高。模型组、bMSCs组、cMSCs组在各时点平衡木实验得分高于假手术组,Garcia评分低于假手术组(P均<0.05)。bMSCs组、cMSCs组建模后7、14、21 d的平衡木实验得分低于模型组,Garcia评分高于模型组(P均<0.05);cMSCs组建模后7、14、21 d平衡木实验得分低于bMSCs组,Garcia评分高于bMSCs组(P均<0.05)。详见表2。
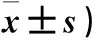
表2 大鼠运动功能评分比较(分,
注:与同时点假手术组相比,*P<0.05;与同时点模型组相比,#P<0.05;与同时点bMSCs组相比,△P<0.05。
2.3 各组大鼠海马组织病理变化 假手术组海马组织结构完整且均匀排列,具有清晰的核仁,皮质锥体细胞的核大而圆,且细胞膜清晰,细胞数量相对较大。模型组脑组织结构消失,神经元损伤加重,细胞体积减小,细胞变圆形或卵形,核固缩,间质水肿加重,细胞间隙扩大。在bMSCs组中,海马组织结构不清晰、混乱,锥体细胞松散排列,体积减小,细胞间隙扩大,核固缩,部分细胞坏死。与bMSCs组相比,cMSCs组的损伤相对减轻,坏死区域缩小,细胞结构不完整,核固缩程度下降,间质水肿减轻(见图2)。

注:A为假手术组;B为模型组;C为bMSCs组;D为cMSCs组。
图2 各组大鼠海马组织病理变化
2.4 各组大鼠海马组织CI面积比较 在TTC染色后,假手术组大鼠脑切片显示为红色,没有CI区。模型组大鼠右侧大脑皮层和海马区与正常组比较,呈现白色CI病变。假手术组、模型组、bMSCs组、cMSCs组CI面积分别为0、28.94%±2.07%、20.54%±1.13%、15.17%±1.04%。bMSCs组、cMSCs组CI面积小于模型组,cMSCs组CI面积小于bMSCs组(P均<0.05)。见图3。
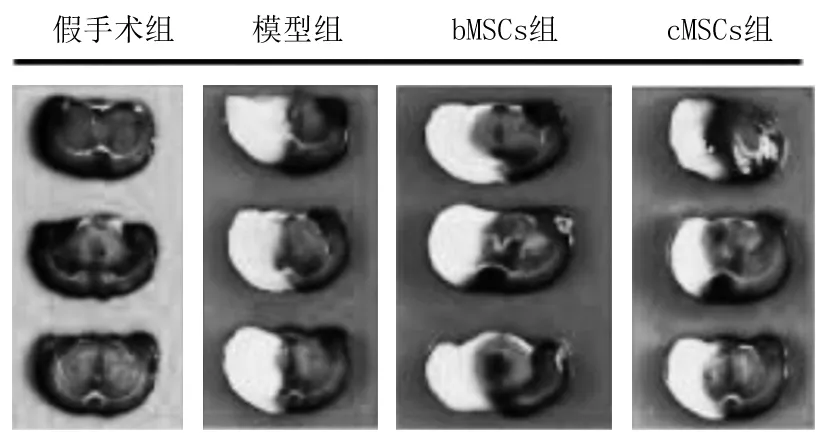
图3 各组大鼠海马组织CI面积(TTC染色)
2.5 各组大鼠海马组织神经元凋亡率比较 假手术组、模型组、bMSCs组、cMSCs组海马组织神经元凋亡率分别为6.02%±0.89%、74.30%±4.82%、56.21%±4.06%、33.99%±3.84%。模型组、bMSCs组、cMSCs组海马组织中神经元凋亡率高于假手术组,bMSCs组、cMSCs组神经元凋亡率低于模型组,cMSCs组神经元凋亡率低于bMSCs组(P均<0.05)。见图4。
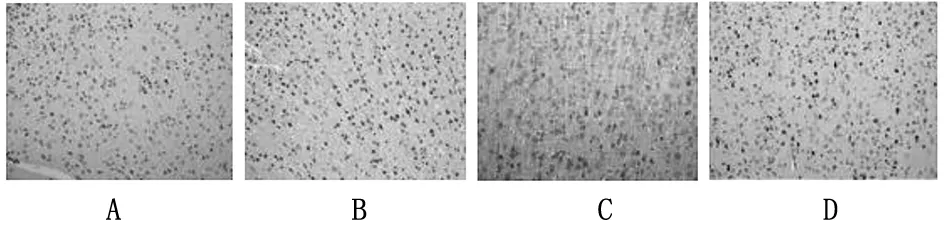
注:A为假手术组;B为模型组;C为bMSCs组;D为cMSCs组。
图4 TUNEL法检测各组大鼠海马神经元细胞凋亡情况
3 讨论
颅骨主要来源于颅神经嵴,是通过膜内而不是软骨内骨化发育形成的扁平骨。尽管颅骨具有一个狭小的骨髓空间,但Zhao等[8]研究显示颅骨缝合线为MSCs提供了一个生存环境。而四肢、髂骨和椎骨的骨骼来自中胚层[5],长骨或髂骨的骨髓中存在MSCs。以往的研究表明,MSCs在体外表现出神经分化的潜力[9,10]。而目前普遍认为MSCs移植对体内缺血性脑损伤的治疗作用与其分泌的一系列营养因子有关,进而促进了缺血性脑组织修复[11]。神经营养因子发挥多种神经保护作用,包括刺激组织内的干细胞增殖和分化[12]。Bdnf是一种重要的神经营养因子,可促进神经发育和血管生成,提供神经保护,减轻炎症和细胞凋亡,改善缺血性脑损伤后的突触可塑性[13]。Matsuda等[14]报道,Bdnf有助于预防IL-1β和TNF-α诱导的内皮屏障功能障碍和调节炎症反应。曹景丽等[15]研究表明,Bdnf通过增加抗凋亡蛋白Bcl-2的表达和抑制细胞内钙超载来减少心肌细胞凋亡。Ngf也是一种神经营养因子,体外研究已证实其神经保护作用[16]。Bianco等[17]报道Ngf能够快速激活抗氧化防御系统,抑制活性氧(ROS)的生成。本研究成功分离和鉴定了cMSCs和bMSCs,并通过检测显示cMSCs组比bMSCs组表达更多的神经嵴相关基因Snail、Slug和神经营养因子Bdnf、Gdnf、Ngf。这些结果提示cMSCs来源于神经嵴,而不是中胚层; cMSCs大量表达神经营养因子Bdnf和Ngf,cMSCs的发育特异性可能使得神经营养因子大量表达。
缺血性脑卒中的神经细胞凋亡与许多事件有关。细胞凋亡最初是由钙内流、线粒体受损和能量消耗引起的,随后是由于氧和葡萄糖消耗引起谷氨酸兴奋性毒性[18]。NO、氧自由基和其他ROS的释放会进一步损伤神经元。此外,内皮细胞释放MMP和其他蛋白酶破坏血脑屏障,导致免疫细胞浸润,而免疫细胞释放的细胞因子也会增强炎症反应,加重脑损伤[19]。至于运动缺陷的恢复,有研究报告,初始运动缺陷水平和随后的恢复依赖于皮质纤维投射纤维的完整性[20]。本研究发现,与模型组相比,bMSCs和cMSCs移植治疗有效改善了MCAO大鼠的神经功能障碍,并且cMSCs组改善效果优于bMSCs组。因此,cMSCs移植较bMSCs可以诱导MCAO大鼠神经功能更好的恢复。此外,与bMSCs组相比,cMSCs组大鼠海马组织CI面积和海马神经元凋亡率均显著降低,从而解释了cMSCs组大鼠运动功能改善程度优于bMSCs组,进一步说明减少细胞凋亡可能是bMSCs、cMSCs移植治疗缺血性脑卒中的一个机制。
鉴于cMSCs可分泌丰富的神经营养因子,cMSCs移植可促进缺血性脑卒中模型大鼠神经功能恢复且效果优于bMSCs移植,因此,颅骨可能是用于治疗中枢神经系统疾病的理想MSCs来源。下一步还应考虑使用源自人颅骨的MSCs进行移植治疗研究。

