TRIM59在人肝癌细胞中表达变化及其对细胞增殖、P53蛋白表达的影响
卢光辉,孙纲,刘子源,徐鹏,邵润东,陈琦,鲍丰羽
1锦州医科大学中国人民解放军联勤保障部队第九六七医院研究生培养基地,辽宁大连116021;2中国人民解放军联勤保障部队第九六七医院
人肝细胞癌(HCC)是最常见的恶性肿瘤之一,发病率逐年增加[1,2]。我国每年约36.9万人死于肝癌,约占全球肝癌死亡病例总数的47.2%。由于缺乏早期敏感的诊断标志物及方法,HCC通常于晚期确诊,预后不良,患者5年生存率低于7%[4]。因此,如何更好地明确HCC发生的分子机制、寻找早期诊断方法、改进治疗方案是相关研究的重点。三结构域蛋白59(TRIM59)是一种存在于不同肿瘤细胞中的新型生物标志物[5~8],其具有高度结构稳定性及广泛的生物学活性。TRIM59被认为是一种癌基因,TRIM59的过表达可能参与细胞中一些致癌基因的突变,导致恶性肿瘤发生、发展[9]。关于TRIM59在HCC细胞中的作用及功能,目前国内外文献报道尚少。2018年12月~2019年2月,本研究观察了TRIM59在不同HCC细胞中的表达变化,及其对细胞增殖、p53蛋白表达的影响,探讨可能的分子机制。
1 材料与方法
1.1 细胞与主要实验材料 6种HCC细胞系(Huh7、Hep3B、HepG2、SK-Hep1、BEL7402、SMMC7721)及人正常肝细胞系LO2均购自ATCC公司。细胞培养基RPMI-1640、EMEM、DMEM、10%胎牛血清购自GIBCO公司。1%青霉素-链霉素购自Beyotime公司。小鼠E17 cDNA文库来自Clontech实验室。脂质体3000购自Invitrogen公司。抗TRIM59及TRIM59的慢病毒颗粒购自Santa Cruz公司。pcDNA3.1-TRIM59质粒和pcDNA3.1-Vector对照质粒购自Gene Copoeia公司。普罗霉素购自Sigma公司。抗p53和GAPDH购自Cell Signaling Technology公司。RNeaseMini试剂盒购自QIAGEN公司。SsoFastEvaGreen超级混合物、增强化学发光系统购自Bio-Rad公司。裂解缓冲液购自Roche公司。
1.2 HCC细胞与正常肝细胞中TRIM59 mRNA及蛋白检测 用RNeaseMini试剂盒从细胞中提取总RNA。采用qRT-PCR法检测TRIM59 mRNA。PCR反应体积10 μL,包括SsoFast EvaGreen超级混合物5 μL、cDNA模板1 μL、两对引物各1 μL。TRIM59 mRNA上游引物序列为5′-TACGAGAGCAGCTGGAA-3′,下游引物序列为5′-ACGGGTTGAACCTCAGGAAG-3′。PCR反应条件为95 ℃ 1 min、95 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,共30个循环。实验重复3次。目标基因的表达针对内参基因house keeping水平进行标准化,表示TRIM59 mRNA相对表达量,实验重复3次。采用Western blotting法检测HCC细胞系及正常肝细胞中的TRIM59蛋白,以GAPDH为内参。实验重复进行3次,使用Image J软件进行图像处理,分析灰度值。
1.3 TRIM59对HCC细胞增殖及p53蛋白表达影响观察
1.3.1 细胞分组与转染 选择预实验中TRIM59 mRNA和蛋白表达水平相对较高的HepG2、Huh7细胞系进行实验。将HepG2细胞分为shTRIM59组和shControl组,shTRIM59组感染TRIM59慢病毒,shControl组感染TRIM59慢病毒阴性对照。将Huh7细胞分为pcDNA3.1-TRIM59组和pcDNA3.1-Vector组;采用PCR法从小鼠E17 cDNA文库中扩增TRIM59,将含有TRIM59 cDNA的片段亚克隆到pcDNA3.1质粒上;用脂质体3000将pcDNA3.1-TRIM59质粒和阴性对照分别导入至pcDNA3.1-TRIM59组和pcDNA3.1-Vector组Huh7细胞。感染或转染后继续培养48 h。提取各实验组总RNA和蛋白。采用Western blotting法检测TRIM59蛋白。shTRIM59组、shControl组的HepG2细胞中TRIM59蛋白相对表达量分别为0.46±0.06、1.03±0.02(P<0.05)。pcDNA3.1-TRIM59组、pcDNA3.1-Vector组的Huh7细胞中TRIM59蛋白相对表达量分别为0.60±0.01、0.13±0.01(P<0.05)。表明两种细胞均感染或转染成功。
1.3.2 细胞增殖能力检测 取感染或转染后的两种HCC细胞,用0.25%胰蛋白酶消化,按1×103/孔平铺于6孔板内,于37 ℃、5%CO2条件下在完全培养基中培养。每3 d更换1次培养基,约14 d后形成肉眼可见的细胞集落(每个集落≥50个细胞)。用0.1%结晶紫染色,光学显微镜下计算集落形成数,表示细胞增殖能力。实验重复进行3次,使用Image J软件进行图像处理。
1.3.3 p53蛋白检测 当两种HCC细胞融合率达到90%时,提取总蛋白,并用Bradford法进行鉴定。用聚丙烯酰胺电泳分离蛋白,转膜之后,将硝酸纤维素滤膜(NC)与一抗共同孵育,4 ℃过夜,TBST洗膜3次。加入二抗,室温孵育1 h,TBST洗膜3次。ECL发光液显影,以GAPDH为内参。实验重复进行3次,采用Image J软件分析蛋白条带灰度值。
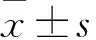
2 结果
2.1 HCC细胞、正常肝细胞中TRIM59 mRNA及蛋白表达比较 BEL7402、Hep3B、HepG2、Huh7、SMMC7721、SK-Hep1、LO2细胞中TRIM59 mRNA相对表达量分别为10.86±0.97、8.74±0.23、62.41±7.53、63.99±5.91、30.51±3.21、9.99±0.20、0.03±0.01,TRIM59蛋白相对表达量分别为0.14±0.01、0.13±0.02、0.68±0.04、0.72±0.03、0.33±0.02、0.12±0.02、0.00±0.01,各HCC细胞中TRIM59 mRNA及蛋白相对表达量均高于LO2细胞(P均<0.05)。在6种HCC细胞系中,HepG2细胞TRIM59 mRNA及蛋白相对表达量均高于BEL7402、Hep3B、SMMC7721、SK-Hep1细胞(P均<0.05);Huh7细胞TRIM59 mRNA及蛋白相对表达量均高于BEL7402、Hep3B、SMMC7721、SK-Hep1细胞(P均<0.05)。选取HepG2细胞及Huh7细胞为下一阶段的实验细胞。
2.2 TRIM59对HepG2、Huh7细胞增殖能力的影响 shControl组、shTRIM59组HepG2细胞集落形成数分别为(137.00±2.65)、(57.67±2.01)个,shTRIM59组集落形成数低于shControl组(P<0.05)。pcDNA3.1-Vector组、pcDNA3.1-TRIM59组Huh7细胞集落形成数分别为(87.67±2.52)、(150.33±1.15)个,pcDNA3.1-TRIM59组集落形成数高于pcDNA3.1-Vector组(P均<0.05)。见图1。
2.3 TRIM59对HepG2、Huh7细胞中p53蛋白表达的影响 shControl组、shTRIM59组HepG2细胞中p53蛋白相对表达量分别为0.71±0.05、1.32±0.06,shTRIM59组p53蛋白相对表达量高于shControl组(P<0.05)。pcDNA3.1-Vector组、pcDNA3.1-TRIM59组Huh7细胞中p53蛋白相对表达量分别为0.93±0.02、0.77±0.03,pcDNA3.1-TRIM59组p53蛋白相对表达量低于pcDNA3.1-Vector组(P<0.05)。
3 讨论

注:A为shControl组;B为shTRIM59组;C为pcDNA3.1-Vector组;D为pcDNA3.1-TRIM59组。
图1 TRIM59表达对HepG2、Huh7细胞增殖能力的影响
HCC在肝脏疾病中占有相当一部分比例[10]。HCC早期无典型临床表现,恶性度高、转移率高、复发率高,多数患者一经确诊就已发展为进展性,错过了最佳治疗时期。加之部分肿瘤细胞先天或后天的耐药性,多数患者经规范化手术治疗联合术后化疗后预后仍不乐观[11,12]。从分子生物学层面解读HCC的发病机制,寻找更有效的治疗方法尤为重要。作为一种新发现的癌基因,TRIM59有着典型的RBCC结构域,即从N端到C端依次为锌指结构域(RING finger)、B-BOX结构域、卷曲螺旋(Coiledcoil)结构域[13],被证明存在于不同的肿瘤细胞中,并参与肿瘤细胞增殖、转移和侵袭的调控[14~16]。但是,TRIM59在HCC中的表达情况及具体作用机制少见报道。
本研究结果显示,与正常肝细胞相比,HCC细胞中TRIM59 mRNA高表达。上调HepG2细胞中TRIM59表达后,HCC细胞的增殖能力明显增强;降低Huh7细胞中TRIM59表达后,细胞增殖能力明显减弱。由此可见,TRIM59高表达有利于HCC细胞的增殖。
为进一步探究TRIM59对HCC细胞的作用机制,我们查阅相关文献发现,TRIM59在胃癌细胞中可促进p53的泛素化和降解[17],从而使p53失去了对细胞增殖的抑制而导致胃癌;TRIM59可通过对p53的泛素化和降解而导致一些肿瘤细胞的增殖和侵袭[18,19]。而在HCC细胞中,TRIM59能否对p53的表达产生影响仍不明确。本研究通过调节TRIM59在HCC细胞中的表达,探讨TRIM59的作用及与p53的关系。研究结果显示,上调Huh7细胞中TRIM59表达后,p53表达水平明显下调;而下调HepG2细胞中TRIM59表达后,p53表达水平显著上调。这表明干预HCC细胞中TRIM59的表达后,p53的表达可相应发生改变,提示TRIM59可能通过调节p53信号通路进而对HCC细胞产生影响。
p53作为一种广泛存在于机体细胞中的抑癌基因,可通过对细胞周期进程的阻断和促使细胞凋亡来有效抑制肿瘤细胞的生长,阻遏恶性肿瘤的进展[20]。人类MDM2同源基因是一种可在多种肿瘤细胞中高表达的E3泛素连接酶,它能与p53结合并辅助p53在肿瘤细胞中发生降解,被认为是调节p53降解最重要的一种泛素连接酶,是p53的抑制因子。从分子结构来看,在降解p53的过程中,MDM2的RING结构域起到了主要作用,而TRIM59在其N末端也有着类似的RING结构域,这种结构相似性表明TRIM59和MDM2在对p53的调控中可能也有着类似的机制。因此推测,在HCC中TRIM59的RING结构域可能与p53存在着某种关联,促使p53发生降解。高表达的TRIM59可能通过上述途径降解p53,p53低表达失去对HCC细胞的抑制作用而导致肿瘤细胞生长;相反,低表达的TRIM59不足以降解p53,p53高表达调控肿瘤细胞增殖、抑制了HCC的进展。
综上所述,HCC细胞中TRIM59 mRNA及蛋白高表达;上调TRIM59表达,HCC增殖能力增强、p53低表达,下调TRIM59表达则HCC增殖能力减弱、p53高表达;TRIM59对HCC细胞增殖的影响可能是通过调节p53表达实现的。具体影响机制仍有待进一步研究。

