磁共振化学位移成像联合体质指数评估青年骨量减少的价值
王珊珊,陈祖钦,贺思健,张 泉,周 欣,毕 珣,袁 飞
骨质疏松是由多种原因导致的骨密度和骨质量下降,骨微结构破坏,造成骨脆性增加,从而容易发生骨折的一种全身性骨病[1, 2]。过去认为,骨量减少所导致的骨质疏松是一种随年龄增长不可避免的退行性改变,近年来研究表明,随着饮食结构、生活习惯的改变,骨量减少在青年中并非个例[3]。双源X线吸收法(dual-energy X-ray absorptiometry, DXA)是目前检测骨密度的常规方法,但其具有电离辐射,并不推荐作为青年人的常规体检项目之一。磁共振化学位移成像通过测定组织信号计算脂肪分数来反映组织脂肪含量的变化。此方法既往用于软组织结构及病变的报道很多。骨髓内脂肪含量增多被认为与骨质疏松相关[4],此方法评价骨质疏松时较多应用于腰椎[5, 6],而评估膝关节骨髓脂肪含量的研究鲜见。本研究在此基础上,探讨应用磁共振化学位移成像评价青年人骨量减少的可行性,并结合BMI进行综合分析比较。
1 对象与方法
1.1 对象 招募某大学2018年一年级新生共624名,均为男性,所有被试者均接受了指端骨骨密度初筛,其中58例Z值<-2者纳入进一步研究。排除标准:(1)曾经或现在患有影响骨代谢疾病(例如恶性肿瘤、下丘脑或垂体疾病、糖尿病、维生素D缺乏、甲状旁腺疾病等);(2)曾经或正在应用影响骨代谢药物(例如双膦酸盐、激素替代药物、 糖皮质激素等);(3)膝关节或者腰椎等大关节骨折、各种原因致卧床超过1个月;(4)曾有过金属植入物等可能影响测量结果因素的病史。本研究方案获本院伦理委员会批准,所有被试均签署知情同意书。
58例接受腰椎骨密度(bonemineraldensity,BMD)检查,其中41例Z值<-1,达到骨质减少标准,其中3例因存在既往药物治疗及骨折病史被排除,共38例纳入骨量偏少组。另行招募30名志愿者中,除1例既往有过腓骨近端骨折病史被排除外,其余29例Z值均大-1,纳入骨量正常组。
1.2 检查方法
1.2.1 BMD检查 使用Hologic QDR2000型骨密度仪,对指端骨Z值<-2者进行复查,DXA检测受检人员腰椎,通过自带软件生成Z值。
1.2.2 MRI检查 使用SiemensVerio 3.0T MRI扫描仪,DXA检查当天进行膝关节磁共振检查。采用仰卧位,足先进,八通道膝关节线圈。检查序列包括:(1)常规序列,横断位T2WI/TSE/FS,冠状位T2WI/TSE/FS,矢状位PDW/TSE。(2)DIXON法,采用3D容积内插屏气检查(3D volume interpolation breath-hold examination,3D VIBE)序列,扫描参数为重复时间5.65 ms,第一回波时间2.46 ms,第二回波时间3.69 ms,层厚2 mm,FOV=160×160 mm2,翻转角9°,矩阵384x384,NEX=2。扫描结束后得到同相位图、反相位图,水像图、脂像图。
1.3 其他资料 利用电子测量仪对身高、体重进行测量,计算受试者的体质指数(body mass index,BMI)值。
1.4 图像处理 利用工作站后处理软件得到膝关节脂肪分数(fatfraction,FF)图,计算公式:FF(%)=[SIfat/(SIfat+SIwater)]×100%,SIfat、SIwater分别代表脂像及水像中的信号强度。测量方法:选择髌骨最大层面及其相邻的两个层面,避开骨皮质,对髌骨轮廓进行手动勾画,每个层面分别测量两次,取其平均值作为该层面的髌骨FF值,以三个层面髌骨FF值的平均值作为最终结果(图1)。
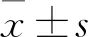
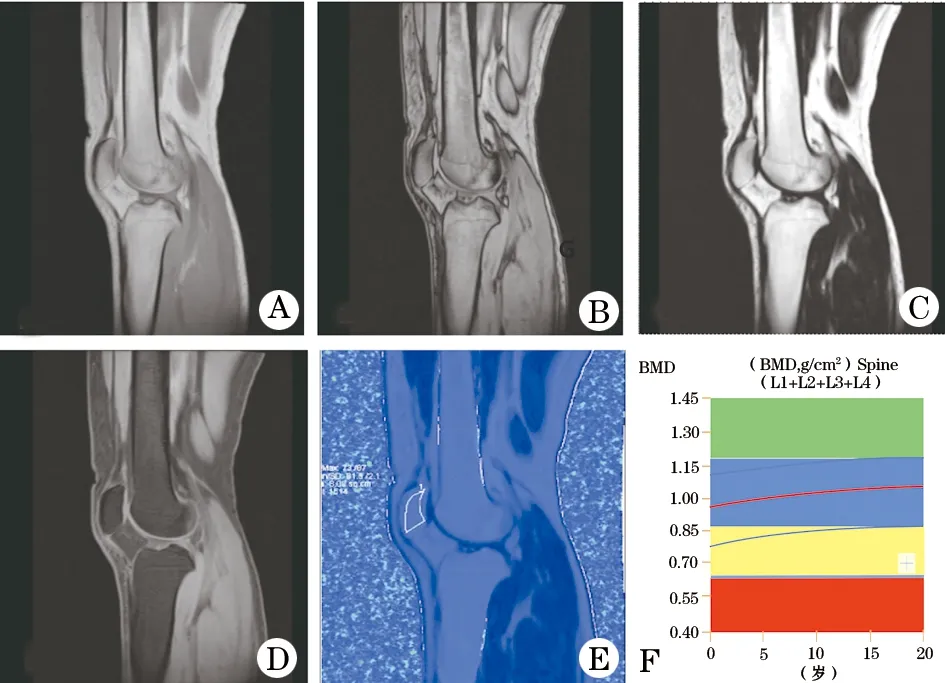
图1 一名受试者应用磁共振化学位移成像
A.同相位;B.反相位;C.脂像;D.水像;E.FF值mapping图;F.L1-L4椎体平均骨密度Z值
2 结 果
2.1 髌骨FF值及BMI值分析 骨量偏少组与骨量正常组之间髌骨FF值、BMI值比较,两组所有数据均符合正态分布,年龄差异无统计学意义(P=0.618)。BMI值比较,骨量偏少组低于骨量正常组,FF值比较,骨量偏少组显著高于骨量正常组(P<0.01,表1)。

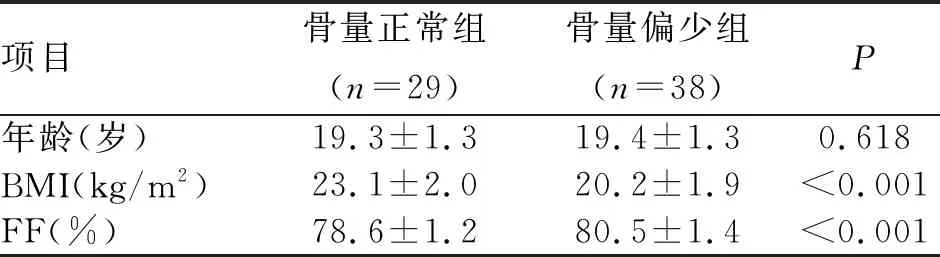
项目骨量正常组(n=29)骨量偏少组(n=38)P年龄(岁)19.3±1.319.4±1.30.618BMI(kg/m2)23.1±2.020.2±1.9<0.001FF(%)78.6±1.280.5±1.4<0.001
2.2 FF、BMI及两指标联合判定骨量减少分析 应用ROC对FF、BMI及两指标联合方法进行分析(图2):FF判定骨量减少的敏感度、特异度、AUC、临界点分别为68.4%,75.9%,0.808(95%CI:0.693~0.894),79.6%;BMI判定骨量减少的敏感度、特异度、AUC、临界点分别为73.4%,89.7%,0.858(95%CI:0.751~0.931),21.1 kg/m2;两指标联合诊断骨量减少敏感度、特异度、AUC分别为86.8%、86.2%、0.920(95%CI:0.858~0.982)。联合检测与FF及BMI单独检测相比,准确率提高,差异有统计学意义(P=0.0136,P=0.0187,图2)。
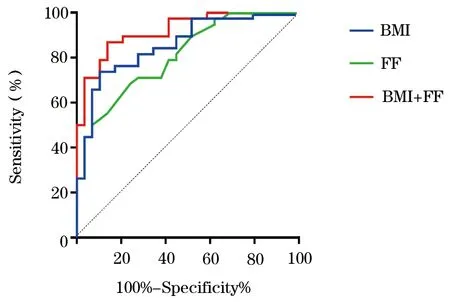
图2 BMI+FF两指标单独与联合诊断骨量减少的ROC曲线比较
3 讨 论
既往认为,青年人并不是骨质疏松的好发人群,65岁以下无骨质疏松症状的女性是否需要进行DXA检测目前仍存在争议[7]。但在此次对青年人群的骨质情况调查研究发现,骨量减少在青年人群中并不少见。骨量减少将增加患者骨折的风险,老年时期骨质疏松性骨折的发生与青年时期骨峰值的累计息息相关。骨峰值是指人一生中获得的最大的骨密度值,一般在骨骺愈合后几年内达到。骨峰值每增加10%,未来骨质疏松性骨折的发病将减少50%[8]。而峰值骨量在个体达到18岁时,已基本达到90%[3],所以青少年时期是骨峰值形成的关键时期。
骨骼成分包括有机物(骨皮质、骨小梁)及无机物(骨髓组织)。既往研究中对于有机物研究较多,无机物对骨质量的影响在近年才逐渐被重视起来。骨髓内脂肪细胞与成骨细胞均起源于间充质干细胞[9, 10],骨髓内脂肪细胞增多将抑制成骨细胞的活动,进而抑制骨生成[11]。越来越多的证据表明,骨质疏松与骨内脂肪沉积直接相关[12]。
目前用磁共振方法评估骨质疏松的常用方法主要包括磁共振氢质子波谱成像(1H-Magnetic resonance spectroscopy,1H-MRS)、动态对比增强MRI(dynamiccontrast-enhancedMRI,DCE-MRI)及化学位移成像三种。作为一种可以无创测定活体组织代谢及生化指标的功能性磁共振检查方法,MRS被认为是骨髓脂肪定量的金标准[9, 12],但由于检查时间过长及感兴趣区的选择限制[10]使其无法广泛使用;DCE-MRI通过注射对比剂后获取Ktrans、Ve等参数来评定骨质的情况,Zhu等[13]发现,DCE-MRI的测量参数之一Ktrans可以早期反映骨髓灌注情况,数值降低代表血管收缩增强和血管内皮细胞间隙缩小,这可能是骨质疏松症早期的原因。但由于对比剂的使用及扫描时间过长的原因,限制了其在实际临床中的应用。
磁共振化学位移成像技术通过脂肪质子和水质子共振的频率不同,在一个重复时间内设定两个或多个特定回波时间,在很短的扫描时间内就可以得到同相位及反相位图,再通过简单计算即可得出脂肪分数图。其操作简便、耗时短等优势被认为是1H-MRS的最佳替代检查[12]。临床上,磁共振化学位移成像技术多用于肝脏及肾上腺的病变的检查[14],朱进等[15]也将其应用于脊旁肌脂肪浸润的评估,但在膝关节进行骨髓脂肪定量测量的报道不多。
目前,膝关节骨密度的测定在感兴趣区的选择,测量的长度、体位,甚至测量软件等问题上尚未达成一致标准[16-18]。Murohy等[19]发现,髌骨骨量可以反映整体膝关节骨质的情况,敏感度较高。
BMI作为目前常用的衡量人体肥胖程度的指标,综合体现饮食、运动及遗传因素对身体的影响。BMI容易获得,应用广泛[20],且在既往研究中发现BMI与骨密度值存在正相关性[21]。但不能反映全身及局部脂肪量的多少,而脂肪组织对骨量的影响是多方面且不容忽视的[22, 23]。利用BMI及FF联合的方法进一步提高了青年骨量减少的检出率,联合应用两种方法AUC达到0.920(95%CI:0.858~0.982),说明两指标联合诊断具有较高的诊断效能。并且联合方法量化了骨髓内脂肪的含量,相对于单纯的骨密度检测,其对骨质疏松性骨折的预测性更强[24]。
综上所述,骨髓脂肪组织与体质指数联合检测,对骨量减少的检出具有较高的效能,并且可以提供骨内脂肪组织的定量信息,有助于对尚未形成统一规范的测量部位骨量及骨髓脂肪进行检查,具有较好的应用前景及临床价值。

