丹参多糖促进自噬抑制脂多糖诱导心肌细胞凋亡的实验研究
张建成 林淑琴 胡鹏飞
脓毒症是由感染引起的高死亡率全身炎症反应综合征[1]。脂多糖(LPS)诱导的心肌损伤是脓毒症患者死亡的主要原因,病死率高达90%[2-3]。LPS 诱导脓毒症大鼠心肌功能发生障碍,心肌组织氧化水平升高,细胞凋亡增多[4]。自噬作为细胞内降解损伤细胞器、冗余蛋白质的主要方式之一,调控细胞凋亡生理进程[5]。LPS 处理心肌细胞,细胞凋亡及自噬水平显著升高,心肌收缩功能异常[6]。丹参多糖(SMP)是丹参的有效成分,具有免疫调节、抗氧化及抗凋亡等生理功效[7-8]。丹参显著改善缺血再灌注损伤,抑制心肌细胞凋亡,改善心功能[9]。长期口服SMP 增强内源性抗氧化剂和抗高血脂活性,对异丙肾上腺素诱导的大鼠心脏损伤具有显著的保护作用[10]。提示SMP 可能对LPS 诱导的脓毒症心肌细胞损伤有保护作用,但目前尚未见报道。本文通过分离SD 大鼠心肌细胞,探究SMP 对LPS 诱导的心肌细胞损伤的调节机制。
1 实验材料
1.1 动物 12 月龄健康雄性实验清洁级Sprague-Dawley(SD)大鼠20 只,体质量250~300g,浙江省实验动物中心提供,动物合格证号:SYXK(浙)2018-0012,伦理批号:2018154,动物房保持通风,干燥,室温22~25℃,湿度维持在50%~70%,自由饮水,鼠料定量喂养,动物饲养及实验操作严格遵守实验动物的使用和管理原则。
1.2 试剂 DMEM/F12(Gibco,#12 400024),GAPDH(Cell Signaling Technology,#5174T)、Bax(Cell Signaling Technology,#2772)、Caspase3(Cell Signaling Technology,#9662)、cleaved-Caspase3(Cell Signaling Technology,#9664)、LC3(Cell Signaling Technology,#3868)和Beclin1(Cell Signaling Technology,#3738),CQ(北京华美互利生物化工,#54057),Torin1(碧云天,#SC0245),Annexin V-FITC 细胞凋亡检测试剂盒(碧云天,#C1062S),MTT 试剂盒(上海威奥生物有限公司,#WH1197)。
2 实验方法
2.1 SMP 制备 取丹参(广锐生物,#1490)2kg,碾碎呈粉末,加入15 倍量水,20℃下进行搅拌提取,每次0.5h,重复2 次。真空干燥滤液获得SMP。
2.2 大鼠心肌细胞分离与培养 大鼠心肌细胞分离方法参考文献[11]报道。大致过程:取出生1~2 天大鼠心脏,生理盐水(PBS)冲3 次,取心室肌剪碎,含0.125%胰蛋白酶的PBS 消化4 次,每次15min。添加10%胎牛血清终止消化。250g/min,离心8min,加入含10%胎牛血清DMEM/F12 复苏。复苏的细胞在10cm的培养皿中培养12h,使非心肌细胞(主要是心肌成纤维细胞)黏附在塑料上,细胞用含1%溴脱氧尿苷DMEM 培养48h。消化离心收取心肌细胞,-80℃冻存。
2.3 大鼠心肌细胞分组及SMP 处理方法 将大鼠心肌细胞分为五组:对照组、LPS 组、0.5mg/mL SMP干预组、1mg/mL SMP 干预组和2mg/mL SMP 干预组。LPS 组:终浓度1μg/mL LPS 刺激大鼠心肌细胞24h;SMP 干预组:不同浓度SMP 预处理大鼠心肌细胞12h,然后用1μg/mL LPS 刺激24h;对照组:加入等量生理盐水。
2.4 MTT 检测SMP 对心肌细胞活力的影响 5000个心肌细胞种植于96 孔板,分为五组:对照组、LPS组、0.5mg/mL SMP 干预组、1mg/mL SMP 干预组和2mg/mL SMP 干预组。处理24h 后,加入5%MTT,37℃培养箱中孵育1h,分光光度计在450nm 波长下测定细胞吸光度改变,统计存活率,进行3 次独立重复实验。
2.5 流式细胞仪检测SMP 对心肌细胞凋亡的影响心肌细胞种植于6 孔板,分为五组:对照组、LPS 组、0.5mg/mL SMP 干预组、1mg/mL SMP 干预组和2mg/mL SMP 干预组。处理24h 后,胰酶消化制成0.1mL 的含2×105单细胞悬液,预冷的70%乙醇4℃固定2h。离心弃去固定液,3mLPBS 重悬,清洗3 次。1mL PI 染液染色,4℃避光30min。流式细胞仪检测细胞凋亡比例,进行3 次独立重复实验,统计细胞凋亡比例。
2.6 Western blot 检测SMP 处理的心肌细胞自噬及凋亡相关蛋白改变 心肌细胞分为五组:对照组、LPS 组、0.5mg/mL SMP 干预组、1mg/mL SMP 干预组和2mg/mL SMP 干预组。处理24h 后,收集细胞蛋白,BCA 测定蛋白含量,高温加热蛋白变性,进行聚丙烯酰胺凝胶电泳(SDS-PAGE),转移到聚偏二氟乙烯膜(PVDF),转膜结束后,5%脱脂牛奶封闭常温孵育1h,按一抗浓度Bax(1:10000)、Caspase3(1:1000)、cleaved -Caspase3(1:1000)、LC3(1:5000)、Beclin1(1:5000)和GAPDH(1:10000)孵育一抗,4°C孵育过夜,洗膜液洗3 次,每次15min,二抗浓度(1:10000)孵育2h,洗膜液洗3 次,每次15min,化学发光法(ECL)显影,凝胶成像系统检测Bax、Caspase3、cleaved-Caspase3、LC3 和Beclin1 蛋 白 表 达,以GAPDH 为内参。进行3 次独立重复实验。
2.7 SMP 调控自噬对心肌细胞存活率的影响 将大鼠心肌细胞分为五组:对照组、LPS 组、LPS+2mg/mL SMP 干预组、LPS+2mg/mL SMP+氯喹(CQ)干预组和LPS+2mg/mL SMP+Torin1 干预组。LPS 组:终浓度1μg/mL LPS 刺激大鼠心肌细胞24h;LPS+2mg/mL SMP 干预组:2mg/mL SMP 预处理大鼠心肌细胞12h,然后用1μg/mL LPS 刺激24h;LPS+2mg/mL SMP+CQ 干预组:2mg/mL SMP 和50μM CQ 预处理大鼠心肌细胞12h,然后用1μg/mL LPS 刺激24h;LPS+2mg/mL SMP+Torin1 干预组:2mg/mL SMP 和250nM Torin1 预处理大鼠心肌细胞12h,然后用1μg/mL LPS 刺激24h;对照组:加入等量生理盐水。
2.8 MTT 检测SMP 调控自噬对心肌细胞活力的影响 5000 个心肌细胞种植于96 孔板中,分为五组:对照组、LPS 组、LPS+2mg/mL SMP 干预组、LPS+2 mg/mL SMP+CQ 干预组和LPS+2mg/mL SMP+Torin1干预组。加入5%MTT,37℃培养箱中孵育1h,分光光度计在450nm 波长下测定细胞吸光度改变,统计存活率,进行3 次独立重复实验。
2.9 流式细胞仪检测SMP 调控对心肌细胞凋亡的影响 心肌细胞种植于6 孔板,分为五组:对照组、LPS 组、LPS+2mg/mL SMP 干 预 组、LPS+2mg/mL SMP+CQ 干预组和LPS+2mg/mL SMP+Torin1 干预组。胰酶消化制成0.1mL 的含2×105单细胞悬液,预冷的70%乙醇4℃固定2h。离心弃去固定液,3mL PBS 重悬,清洗3 次。1mL PI 染液染色,4℃避光30min。流式细胞仪检测细胞凋亡比例,进行3 次独立重复实验,统计细胞凋亡比例。
2.10 Western blot 检测SMP 调控自噬对LPS 处理的心肌细胞自噬及凋亡相关蛋白改变 心肌细胞分为五组:对照组、LPS 组、LPS+2mg/mL SMP 干预组、LPS+2mg/mL SMP+CQ 干预组和LPS+2mg/mL SMP+Torin1 干预组。收集细胞蛋白,BCA 测定蛋白含量,高温加热蛋白变性,进行SDS-PAGE,转移到PVDF,转膜结束后,5%脱脂牛奶封闭常温孵育1h,按一抗浓度Bax(1:10000)、Caspase3(1:1000)、cleaved-Caspase3(1:1000)、LC3(1:5000)、Beclin1(1:5000)和GAPDH(1:10000)孵育一抗,4°C 孵育过夜,洗膜液洗3 次,每次15min,二抗浓度(1:10000)孵育2h,洗膜液洗3 次,每次15min,ECL 显影,凝胶成像系统检 测Bax、Caspase3、Cleaved-Caspase3、LC3 和Beclin1 蛋白表达,以GAPDH 为内参。进行3 次独立重复实验。
2.11 统计学方法 应用SPSS 19.0 软件进行统计分析,所有实验重复3 次,数据以均数±标准差表示,采用单因素方差分析和t 检验比较组间差异。P<0.05 表示差异有统计学意义。
3 实验结果
3.1 SMP 对LPS 诱导的心肌细胞存活率的影响 与对照组比较,LPS 处理的心肌细胞活力显著降低(P<0.01);与LPS 组比较,SMP 预处理显著抑制LPS 诱导的心肌细胞活力降低,且随着SMP 浓度增大,细胞活力显著升高,差异有统计学意义(P<0.05,P<0.01),见表1。
3.2 SMP 对LPS 诱导的心肌细胞凋亡的影响 与对照组比较,LPS 处理心肌细胞,细胞凋亡比例显著升高(P<0.01),与LPS 组比较,SMP 预处理显著抑制LPS 诱导的心肌细胞凋亡,且随着SMP 浓度增大,细胞凋亡比例显著降低,差异有统计学意义(P<0.05,P<0.01),见表2、图1。
表1 SMP 对LPS 处理的心肌细胞存活率的影响(%,±s)

表1 SMP 对LPS 处理的心肌细胞存活率的影响(%,±s)
注:n=3 代表3 次独立重复实验;LPS 为脂多糖;SMP 为丹参多糖;与对照组比较,aaP<0.01;与LPS 组比较,bP<0.05,bbP<0.01
表2 SMP 对LPS 诱导心肌细胞凋亡率的影响(%,±s)

表2 SMP 对LPS 诱导心肌细胞凋亡率的影响(%,±s)
注:n=3 代表3 次独立重复实验;LPS 为脂多糖;SMP 为丹参多糖;与对照组比较,aP<0.01;与LPS 组比较,bP<0.05,bbP<0.01
3.3 SMP 对LPS 处理的心肌细胞自噬和凋亡蛋白表达的影响 与对照组比较,LPS 处理心肌细胞,细胞促凋亡相关蛋白Bax 和Cleaved-Caspase3 表达增多,自噬相关蛋白Beclin1 和LC3II 蛋白表达增多,表明LPS 诱导心肌细胞自噬。与LPS 组比较,SMP 预处理显著抑制LPS 诱导的心肌细胞Bax 和Cleaved-Caspase3 蛋白表达,促进Beclin1 和LC3II 蛋白表达进一步增加,表明SMP 可能参与LPS 诱导的自噬和凋亡途径,见图2。

图1 SMP 抑制LPS 诱导的心肌细胞凋亡

图2 SMP 对LPS 诱导的心肌细胞自噬和凋亡蛋白表达的影响
3.4 SMP 促进自噬抑制LPS 诱导的心肌细胞活力下降和细胞凋亡 与对照组比较,LPS 处理心肌细胞后,细胞活力明显降低(P<0.01);SMP+LPS 组比较,SMP+CQ+LPS 组细胞活力下降,SMP+Torin1+LPS组细胞活力升高(P 均<0.01);流式结果表明,与SMP+LPS 组比较,SMP+CQ+LPS 组细胞凋亡增多,SMP+Torin1+LPS 组细胞凋亡减少(P 均<0.05)。见表3~4、图3。
表3 SMP 促进自噬抑制LPS 诱导细胞活力(%,±s)

表3 SMP 促进自噬抑制LPS 诱导细胞活力(%,±s)
注:n=3 代表3 次独立重复实验;LPS 为脂多糖;SMP 为丹参多糖;CQ为氯喹;与对照组比较,aaP<0.01;与LPS 组比较,bbP<0.01;与SMP+LPS 组比较,cP<0.05
表4 SMP 促进自噬抑制LPS 诱导的细胞凋亡率(%,±s)

表4 SMP 促进自噬抑制LPS 诱导的细胞凋亡率(%,±s)
注:n=3 代表3 次独立重复实验;LPS 为脂多糖;SMP 为丹参多糖;CQ为氯喹;与对照组比较,aaP<0.01;与LPS 组比较,bbP<0.01;与SMP+LPS 组比较,cP<0.05
3.5 SMP 促进自噬抑制LPS 诱导的心肌细胞促凋亡蛋白表达 与SMP+LPS 组比较,SMP+CQ+LPS 组Bax、cleaved-Caspase3 和LC3II 表达增多,Beclin1 表达减少,SMP+Torin1+LPS 组,Bax、cleaved-Caspase3、LC3II 和Beclin1 表达增多,表明SMP 促进自噬抑制LPS 诱导的心肌细胞促凋亡蛋白表达。见图4。

图3 SMP 促进自噬抑制LPS 诱导的细胞凋亡
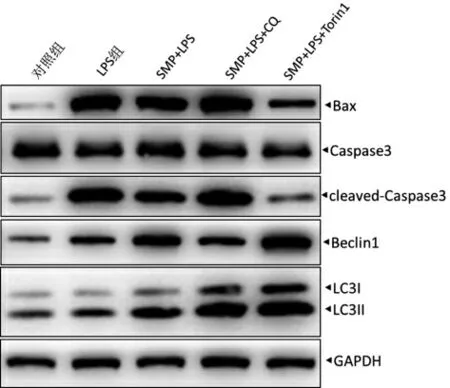
图4 SMP 调控自噬参与LPS 诱导的细胞凋亡
4 讨论
心肌损伤作为脓毒症的重要病征,导致多器官衰竭。LPS 诱导的脓毒症小鼠发生心肌缺血损伤,促凋亡蛋白表达增多[12]。自噬作为机体重要生理过程,在脓毒症心肌损伤中发挥重要功能。心肌细胞自噬升高减轻心肌梗死引起的心肌损伤,增强心肌细胞自噬对心肌细胞线粒体损伤有保护作用。米诺环素通过增强心肌细胞线粒体自噬和心肌细胞自噬,改善心肌功能[13]。LPS 处理肺上皮细胞,自噬水平随着LPS 处理时间的延长,显著增加[14]。我们前期研究发现,LPS 处理心肌细胞,细胞自噬及凋亡水平显著升高,表现为自噬相关蛋白表达增加,凋亡细胞比例增多,细胞活力下降。
SMP 作为丹参的主要成分,现已广泛应用于免疫性肝损伤、肿瘤及高血压等疾病研究[15-16]。经SMP预处理后,暴露于H2O2的大鼠心肌细胞H9C2 超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性下降,丙二醛(MDA)升高,抑制线粒体功能障碍、增强抗氧化和抗凋亡能力[17]。本研究发现大鼠心肌细胞经SMP 预处理,LPS 诱导的细胞凋亡减少,细胞活力升高,促凋亡蛋白表达减少,同时伴随自噬水平升高。另一方面,我们通过自噬抑制剂或激活剂联合SMP 预处理LPS 诱导的心肌细胞损伤模型,发现SMP 促进自噬抑制LPS 诱导的心肌细胞损伤。
综上所述,LPS 诱导脓毒症心肌细胞发生严重的细胞凋亡,导致心肌损伤加重。SMP 通过增强自噬抑制LPS 诱导的心肌细胞损伤,发挥心肌保护作用。

