STEME系统:一种助力体内定向进化的新工具
胡风越,王克剑
前沿聚焦
STEME系统:一种助力体内定向进化的新工具
胡风越,王克剑
中国水稻研究所,水稻生物学国家重点实验室,杭州 310006
通过定向进化(directed evolution)可以快速进行蛋白工程改良及重要基因功能研究,以获得新型农艺性状突变体。近期,中国科学院遗传与发育生物学研究所高彩霞团队和李家洋团队合作构建了新型的饱和靶向内源诱变编辑器(saturated targeted endogenous mutagenesis editors, STEMEs),并在植物中实现了基因的定向进化和功能筛选。该系统融合了现有的2种单碱基编辑技术,成功实现在植物体内同时诱导C:G>T:A、A:T>G:C双碱基编辑,通过靶向羧基转移酶结构域编码序列定向进化出水稻除草剂抗性植株。这种在体内进行基因定向进化的新方法,对于今后农作物重要农艺性状的筛选和功能基因研究具有重要作用。本文对STEME系统的组成、编辑效率和应用原理进行介绍,并与已有的定向进化方法进行比较,为加速作物种质资源创新研究提供参考。
STEME;双碱基编辑;定向进化;种质创新
育种是通过改变遗传信息进而筛选获得具有优良性状的生物材料的过程。相较于传统的通过物理(如紫外线)、化学(如甲烷磺酸乙酯)诱变产生随机突变的方式,定向进化(directed evolution)技术具有靶向诱导变异、进化周期短和劳动节约型等优势[1],因此在植物种质创新研究中颇具潜力。
目前,定向进化方法多用于蛋白工程改良[3],且常需借助大肠杆菌、酵母等进行体外培养。这些方法包括诱导产生随机突变的epPCR (error-prone PCR)、位点饱和突变(site saturation mutagenesis)技术和基于基因重组的DNA shuffling、StEP重组(staggered extension process)等技术。然而,这种脱离原始基因组和细胞环境的体外培养方式并不能完全表现突变基因的重要性状及功能[4]。近年来,CRISPR/Cas (clustered regularly interspaced short palindromic repeats-associated protein)基因编辑系统的快速发展为创制作物新品种提供了一种更加高效的技术手段,也为高等真核生物体内定向进化研究打开了大门。2019年,Butt等[5]搭建了诱变和选择相结合的CRISPR/Cas定向进化平台(CRISPR/Cas- directed evolution, CDE),在水稻中成功创制出抗GEX1A剪接抑制剂的转录组核心剪接因子突变株,实现了植物体内重要性状的定向进化和以结构域为中心的蛋白定向进化。但是,利用CRISPR/ Cas9产生的突变绝大多数都是插入和缺失,造成移码突变或无义突变,常常导致蛋白功能丧失甚至植株死亡[6],不能应用于研究其他突变类型与基因功能、农艺性状之间的关系。
近期,中国科学院遗传与发育生物学研究所高彩霞团队和李家洋团队合作设计了可以从头突变并促进植物定向进化的饱和靶向内源诱变编辑器(saturated targeted endogenous mutagenesis editors, STEMEs)[7],作为加快植物和作物性状发展与进化的平台,为快速获得新的优良农艺性状提供了可能。
1 STEME系统有效实现C:G>A:T和A:T>G:C双碱基编辑
单碱基编辑是基于CRISPR/Cas系统的可实现单个碱基精准替换的基因编辑工具,即在不产生基因组DNA双链断裂的情况下,利用胞嘧啶脱氨酶或人工进化的腺嘌呤脱氨酶对靶位点进行精准的单碱基转变。此前,多个课题组已经在植物中成功构建了诱导胞嘧啶(C)向胸腺嘧啶(T)、腺嘌呤(A)或鸟嘌呤(G)转变的胞嘧啶碱基编辑器(cytidine base editors, CBEs),以及A向G转换的腺嘌呤碱基编辑器(adenine base editors, ABEs)[8]。单碱基编辑器的发展为STEME系统的建立奠定了基础。
第一代STEME双碱基编辑系统是基于植物A3A-PBE[14](一种CBE系统)和PABE-7[16](一种ABE系统),将胞嘧啶脱氨酶APOBEC3A和腺嘌呤脱氨酶ecTadA-ecTadA7.10同时融合在nCas9(D10A)的N端,并将尿嘧啶DNA糖基化酶抑制剂(uracil DNA glycosylase inhibitor, UGI)以融合或自由表达的形式置于nCas9(D10A)的C端构建形成。其所包含的4种组合形式STEME-1、STEME-2、STEME-3和STEME-4,均能在一个sgRNA(single guide RNA)的引导下诱导C:G>T:A和A:T>G:C同时突变,显著增加突变和功能遗传的多样性。其中,各元件以5'- APOBEC3A-ecTadA-ecTadA7.10-nCas9(D10A)-UGI-3'方式组合的STEME-1的编辑效果最佳。此外,由于第一代STEME系统STEME-1仅识别原型间隔序列毗邻基序(protospacer adjacent motif, PAM)为NGG的序列,第二代STEME系统在STEME-1的基础上将nCas9 (D10A)换成nCas9-NG (D10A),形成STEME-NG,识别PAM为NG的序列,极大地扩展了靶基因的可编辑范围。
同时,该研究比较了双碱基编辑器STEME与胞嘧啶碱基编辑器A3A-PBE、腺嘌呤碱基编辑器PABE-7各自的诱变效率。在水稻原生质体中的实验结果显示:STEME-1系统对C:G>T:A的单碱基诱导效率(平均25.14%)比A3A-PBE系统(平均17.25%)高约1.5倍,STEME-1系统对C:G>T:A的诱导效率最高达61.61%;STEME-1系统对A:T>G:C的单碱基诱导效率(0.69%~15.50%)比PABE-7系统(1.74%~ 21.57%)略低;而STEME-1系统对C:G>T:A和A:T> G:C的双碱基编辑效率为0.49%~15.10%,这已足以为改进的定向进化策略提供所需的突变多样性。所以,STEME系统是非常有效且靶向广泛的双碱基编辑系统,为实现靶基因的近饱和突变提供可能。
2 STEME系统加速新品种创制和作物工程研究
在建立STEME系统之后,研究人员利用该系统进行定向进化水稻抗除草剂新种质的研究。定向进化工作主要包括以下6个步骤[5]:(1)基于PAM序列要求,设计针对基因整个编码序列的所有可能的sgRNAs;(2)通过Oligo合成和退火产生sgRNAs文库;(3)将sgRNAs分别构建到双元载体上;(4)双元载体质粒按照等摩尔比进行混池,转化农杆菌,侵染水稻愈伤;(5)经潮霉素筛选及目标药物筛选获得稳定的抗性愈伤组织,继续在选择压力下再生抗性幼苗;(6)对抗性幼苗及子代进行详细的基因型分析和表型分析,鉴定蛋白变异类型。利用STEME-NG系统,研究者设计了20个sgRNA覆盖基因上编码羧基转移酶结构域的168 bp碱基序列。在水稻原生质体中,该系统诱导产生的碱基突变类型和平均碱基编辑效率为C>T (11.50%)、A>G (0.35%)、G>A (13.33%)、T>C (0.45%),相比A3A-PBE-NG载体,突变多样性显著增加。此外,168 bp序列编码的56个氨基酸中有41个氨基酸发生多种类型的突变(无义突变、错义突变和沉默突变),氨基酸突变率高达73.21%,实现了近似饱和诱变。随后,研究者综合应用STEME-1和STEME-NG系统,设计了200个sgRNA靶向羧基转移酶结构域上400个氨基酸编码序列,利用农杆菌转化和组织培养技术形成抗性愈伤组织,在高效氟吡甲禾灵(haloxyfop)筛选条件下成功获得抗除草剂幼苗。值得一提的是,周焕斌团队[17]和魏鹏程团队[18]同样基于单碱基编辑系统,分别在水稻中近似饱和诱变除草剂靶标基因全长编码区和基因羧基转移酶结 构域编码序列,成功定向进化出水稻抗除草剂优良种质。
3 STEME系统与其他植物体内定向进化方法的比较
突变多样性的构建是植物蛋白工程的基础。其中,运用较多的突变文库构建方式为epPCR、位点饱和突变和DNA shuffling[19~22],广泛应用于获得除草剂(如草甘膦)抗性[23]、提升光合作用效率[24]、生物降解[25]等酶工程改造(表1对部分植物定向进化突变多样性构建方法进行了比较)。STEME可在高等真核生物体内进行靶向诱变,这弥补了以往植物蛋白体内诱变方法的缺陷[26]。此外,相较于其他植物体内定向进化方法,STEME系统还具有以下突出 优势:
(1)一步实现近似饱和诱变,减少筛选次数,有效避免有害突变的积累。目前用于植物定向进化的方法依赖PCR技术,需要经多轮循环积累突变多样性,并通过筛选来剔除不必要的有害突变和中性突变,以提升突变文库质量,再进一步对转化到异种宿主中的突变体进行功能筛选。因此,传统的定向进化方法往往需要多步筛选,操作繁琐。相反,STEME系统的运用仅需要将其导入植物原生质体或愈伤组织中,一次转化即实现在体内同时编辑多位点,无需重复编辑,避免了有害突变的积累。
(2)在体内诱变产生突变文库为转化效率低的物种提供一个可行的选择。传统的定向进化方法需要在体外构建突变文库,再转化至异种细胞中进行筛选。然而,Engqvist等[26]曾表示植物蛋白工程定向进化面临着转化率低的问题,改进现有的转化方法或开发新的转化方法将是扩大植物蛋白工程应用的关键。目前,CRISPR技术已经广泛应用于多种植物,有效编辑芽、根或子叶等多种组织中的基因组[27,28],为转化效率低的问题提供了一个解决方案。STEME系统基于CRISPR技术,直接在植物体内诱导突变,有效降低了突变文库的转化损失。
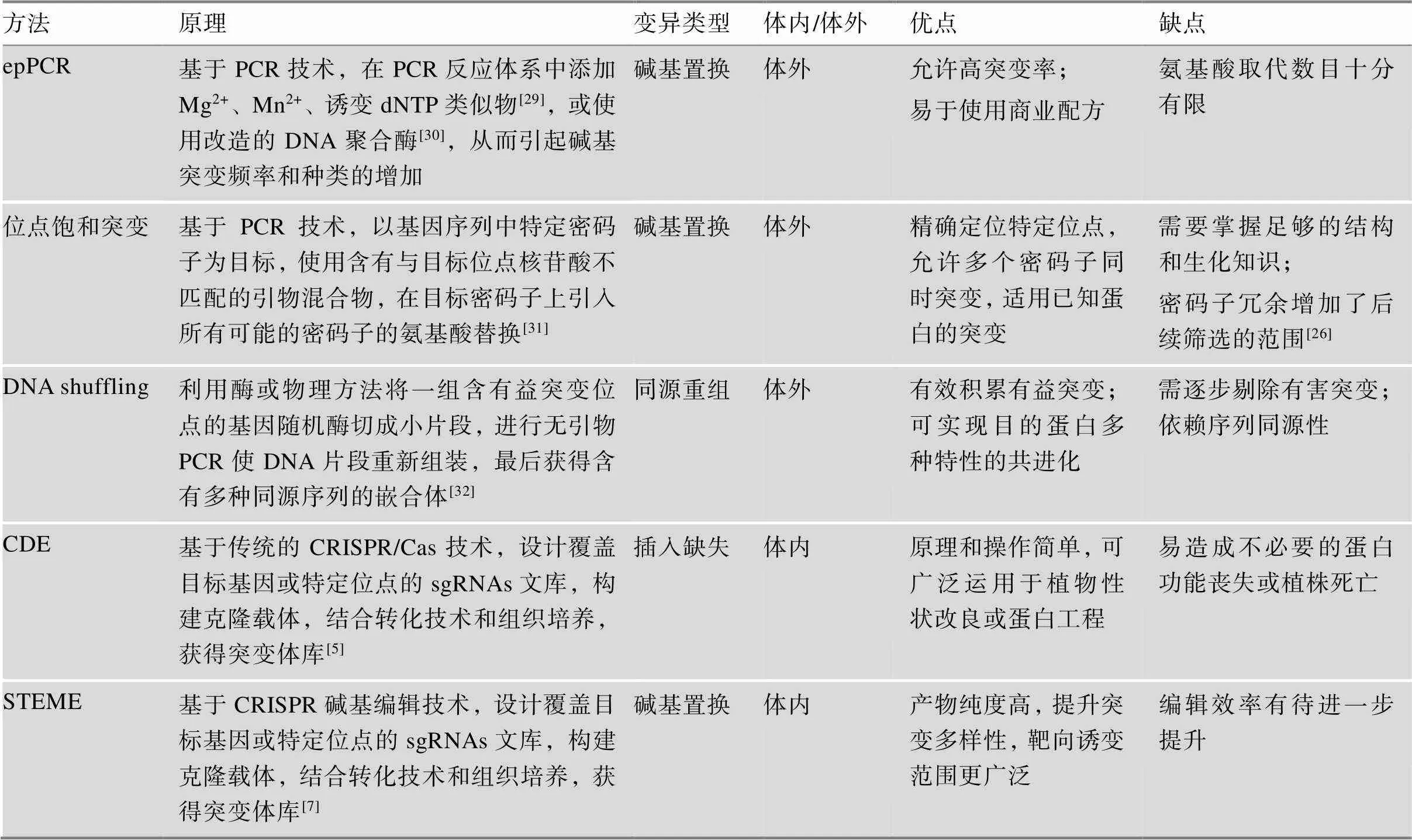
表1 部分植物定向进化突变文库构建方法的介绍与比较
4 结语与展望
传统的植物育种方式可能已经无法满足日益增长的粮食需求和环境挑战,基因编辑技术的发展正逐步为现代农业提供可预测、精准、快速的育种技术手段。STEME双碱基编辑系统的建立拓展了植物碱基突变多样性,加速农作物新种质创制和功能蛋白的定向进化。未来,我们期待能够在现有基础上进一步优化该快速定向进化系统,如效率更高、更稳定,或识别更多的PAM类型以扩大靶向范围,或同时实现12种类型的碱基转变、小范围插入或缺失与碱基编辑的组合突变以增加突变多样性。同时,CRISPR/Cas系统的递送困难也是农业中采用CRISPR/ Cas基因组编辑技术的一个瓶颈。研究证明,农杆菌转化传递sgRNAs所产生的突变多样性不如粒子攻击方法所产生的突变多样性[17],且传统组织培养方式耗时长、劳动密集,容易产生随机的体细胞突变,这些都降低了CRISPR工具原本能产生的效应[33]。因此有必要优化传递方法,最大限度地将包含sgRNA文库的CRISPR复合物转化到植物中,充分提高各种作物的转化效率。综上所述,真核生物体内定向进化的大门已经打开,随着CRISPR/Cas技术的发展完善或其他新的技术的崛起,这一领域将得到更快发展,加速种质资源创新与应用的步伐。
[1] Slade AJ, Fuerstenberg SI, Loeffler D, Steine MN, Facciotti D. A reverse genetic, nontransgenic approach to wheat crop improvement by TILLING., 2005, 23(1): 75–81.
[2] Henikoff S, Till BJ, Comai L. TILLING. Traditional mutagenesis meets functional genomics., 2004, 135(2): 630–636.
[3] Packer MS, Liu DR. Methods for the directed evolution of proteins., 2015, 16(7): 379–394.
[4] Peck SH, Chen I, Liu DR. Directed evolution of a small-molecule-triggered intein with improved splicing properties in mammalian cells., 2011, 18(5): 619–630.
[5] Butt H, Eid A, Momin AA, Bazin J, Crespi M, Arold ST, Mahfouz MM. CRISPR directed evolution of the spliceosome for resistance to splicing inhibitors., 2019, 20(1): 73.
[6] Zhang YX, Qi YP. CRISPR enables directed evolution in plants., 2019, 20(1): 83.
[7] Li C, Zhang R, Meng XB, Chen S, Zong Y, Lu CJ, Qiu JL, Chen YH, Li JY, Gao CX. Targeted, random mutagenesis of plant genes with dual cytosine and adenine base editors., 2020, 10.1038/s41587-019-0393-7.
[8] Hua K, Tao XP, Yuan FT, Wang D, Zhu JK. Precise A.T to G.C base editing in the rice genome., 2018, 11(4): 627–630.
[9] Lu YM, Zhu JK. Precise editing of a target base in the rice genome using a modified CRISPR/Cas9 system., 2017, 10(3): 523–525.
[10] Ren B, Yan F, Kuang YJ, Li N, Zhang DW, Lin HH, Zhou HB. A CRISPR/Cas9 toolkit for efficient targeted base editing to induce genetic variations in rice., 2017, 60(5): 516–519.
[11] Yan F, Kuang YJ, Ren B, Wang JW, Zhang DW, Lin HH, Yang B, Zhou XP, Zhou HB. Highly efficient A·T to G·C base editing by Cas9n-guided tRNA adenosine deaminase in rice., 2018, 11(4): 631–634.
[12] Wei Y, Zhang XH, Li DL. The “new favorite” of gene editing technology—single base editors., 2017, 39(12): 1115–1121.魏瑜, 张晓辉, 李大力. 基因编辑之“新宠”—单碱基基因组编辑系统. 遗传, 2017, 39(12): 1115–1121.
[13] Zong Y, Gao CX. Progress on base editing systems., 2019, 41(9): 777–800.宗媛, 高彩霞. 碱基编辑系统研究进展. 遗传, 2019, 41(9): 777–800.
[14] Zong Y, Song QN, Li C, Jin S, Zhang DB, Wang YP, Qiu JL, Gao CX. Efficient C-to-T base editing in plants using a fusion of nCas9 and human APOBEC3A., 2018, 36(10): 950–953.
[15] Li ZX, Xiong XY, Li JF. New cytosine base editor for plant genome editing., 2018, 61(12): 1602–1603.
[16] Li C, Zong Y, Wang YP, Jin S, Zhang DB, Song QN, Zhang R, Gao CX. Expanded base editing in rice and wheat using a Cas9-adenosine deaminase fusion., 2018, 19(1): 59.
[17] Kuang YJ, Li SF, Ren B, Yan F, Spetz C, Li XJ, Zhou XP, Zhou HB. Base-editing-mediated artificial evolution ofin planta to develop novel herbicide-tolerant rice germplasms., 2020, S1674-2052(20)30010-1.
[18] Liu XS, Qin RY, Li J, Liao SX, Shan TF, Xu RF, Wu DX, Wei PC. A CRISPR-Cas9-mediated domain-specific base-editing screen enables functional assessment of ACCase variants in rice., 2020, 10.1111/pbi.13348.
[19] Brühlmann F, Bosijokovic B, Ullmann C, Auffray P, Fourage L, Wahler D. Directed evolution of a 13-hydroperoxide lyase (CYP74B) for improved process performance., 2013, 163(3): 339–345.
[20] Castle LA, Siehl DL, Gorton R, Patten PA, Chen YH, Bertain S, Cho H-J, Duck N, Wong J, Liu D, Lassner MW. Discovery and directed evolution of a glyphosate tolerance gene., 2004, 304(5674): 1151–1154.
[21] Tian YS, Xu J, Peng RH, Xiong AS, Xu H, Zhao W, Fu XY, Han HJ, Yao QH. Mutation by DNA shuffling of 5-enolpyruvylshikimate-3-phosphate synthase fromfor improved glyphosate resistance., 2013, 11(7): 829–838.
[22] Zhan T, Zhang K, Chen YY, Lin YJ, Wu GB, Zhang LL, Yao P, Shao ZZ, Liu ZD. Improving glyphosate oxidation activity of glycine oxidase from Bacillus cereus by directed evolution., 2013, 8(11): e79175–e79175.
[23] Zhou M, Xu HL, Wei XL, Ye ZQ, Wei LP, Gong WM, Wang YQ, Zhu Z. Identification of a glyphosate-resistant mutant of rice 5-enolpyruvylshikimate 3-phosphate synthase using a directed evolution strategy., 2006, 140(1): 184–195.
[24] Smith SA, Tabita FR. Positive and negative selection of mutant forms of prokaryotic (cyanobacterial) ribulose-1,5- bisphosphate carboxylase/oxygenase., 2003, 331(3): 557–569.
[25] Álvarez C, Reyes-Sosa FM, Díez B. Enzymatic hydrolysis of biomass from wood., 2016, 9(2): 149–156.
[26] Engqvist MKM, Rabe KS. Applications of protein engineering and directed evolution in plant research., 2019, 179(3): 907–917.
[27] Jaganathan D, Ramasamy K, Sellamuthu G, Jayabalan S, Venkataraman G. CRISPR for crop improvement: an update review., 2018, 9(985).
[28] Li J, Zhang Y, Chen KL, Shan QW, Wang YP, Liang Z, Gao CX. CRISPR/Cas: a novel way of RNA-guided genome editing.2013, 35(11): 1265–1273.李君, 张毅, 陈坤玲, 单奇伟, 王延鹏, 梁振, 高彩霞. CRISPR/Cas系统:RNA靶向的基因组定向编辑新技术. 遗传, 2013, 35(11): 1265–1273.
[29] Zaccolo M, Williams DM, Brown DM, Gherardi E. An approach to random mutagenesis of DNA using mixtures of triphosphate derivatives of nucleoside analogues., 1996, 255(4): 589–603.
[30] Leung DW, Cachianes G, Kuang WJ, Goeddel DV, Ferrara N. Vascular endothelial growth factor is a secreted angiogenic mitogen., 1989, 246(4935): 1306.
[31] Zheng L, Baumann U, Reymond JL. An efficient one-step site-directed and site-saturation mutagenesis protocol., 2004, 32(14): e115–e115.
[32] Hiraga K, Arnold FH. General method for sequence- independent site-directed chimeragenesis., 2003, 330(2): 287–296.
[33] Gao CX. The future of CRISPR technologies in agriculture., 2018, 19(5): 275–276.
The STEME system: a novel tool for directed evolution
Fengyue Hu, Kejian Wang
Directed evolution can be rapidly applied for engineering proteins, studying gene functions, and obtaining mutants with important agronomic traits. Recently, Caixia Gao and Jiayang Li’s team from the Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, worked together to engineer novel saturated targeted endogenous mutagenesis editors (STEMEs), realizingdirected evolution and function selection in plants. This system integrated the existing two single-base editing techniques, successfully induced C:G>T:A and A:T>G:C double-base editing in plants, and artificially evolved into herbicide-resistant rice through targeting thecarboxyltransferase domain coding sequence. This new method of gene directed evolutiondisplays great application potential in important agronomic trait screening and plant functional gene researches. Here we introduce the composition, editing efficiency, and application principle of the STEME system, and compare it with the existing directed evolution methods, so as to provide a reference for accelerating the innovation of crop germplasm resources.
STEME; double base editing; directed evolution; germplasm innovation
2020-02-17;
2020-02-26
国家转基因专项(编号:2019ZX08010-003)资助 [Supported by the National Transgenic Science and Technology Program (No. 2019ZX08010-003)]
胡风越,硕士研究生,专业方向:作物种质资源学。E-mail: hufy_caas@163.com
王克剑,博士,研究员,博士生导师,研究方向:作物种质资源创新与利用。E-mail: wangkejian@caas.cn
10.16288/j.yczz.20-041
2020/2/29 11:04:42
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20200228.1149.004.html
(责任编委: 韩玉波)