PAI-1过表达促进食管鳞癌细胞的侵袭和迁移
王迪,杨荔艳,刘奏,余竟,张敏杰,张钰,蔡岩,徐昕,郝佳洁,王明荣
研究报告
PAI-1过表达促进食管鳞癌细胞的侵袭和迁移
王迪,杨荔艳,刘奏,余竟,张敏杰,张钰,蔡岩,徐昕,郝佳洁,王明荣
国家癌症中心/国家肿瘤临床医学研究中心, 中国医学科学院北京协和医学院肿瘤医院肿瘤精准医学研究中心, 分子肿瘤学国家重点实验室,北京 100021
食管癌是常见的恶性肿瘤之一。由基因编码的纤溶酶原激活物抑制因子1 (plasminogen activator inhibitor-1, PAI-1)已被报道在多种类型癌症患者的肿瘤组织中存在高表达并参与癌症进展。为探讨PAI-1蛋白在食管鳞癌中的作用及其分子机制,本研究首先利用Western blot实验和酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)检测各食管鳞癌细胞系中PAI-1的表达和分泌水平,结果显示,PAI-1高表达的食管鳞癌细胞系分泌至细胞外的PAI-1水平相对较高。进一步选取PAI-1表达及分泌水平均较高的KYSE150和KYSE450细胞系作为研究模型,通过siRNA(小干扰RNA)瞬时转染和Transwell实验证实敲降可显著抑制食管鳞癌KYSE150和KYSE450细胞的侵袭和迁移。同时,构建了慢病毒介导的稳定敲降细胞株KYSE150和KYSE450,将稳定敲降的细胞培养基中外源加入PAI-1蛋白进行Transwell回复实验,结果表明PAI-1过表达可增强食管鳞癌细胞的侵袭和迁移能力。体内实验结果显示,降低PAI-1表达可显著抑制食管鳞癌细胞的成瘤和肺转移能力。分子水平检测表明PAI-1过表达可激活AKT和ERK信号通路,免疫共沉淀(co-immunoprecipitation, Co-IP)实验结果进一步显示PAI-1可能与膜受体LRP1 (LDL receptor related protein 1)存在相互作用。上述研究结果表明,PAI-1可能通过与LRP1相互作用进而促进食管鳞癌细胞的侵袭和迁移。
PAI-1;食管鳞癌;侵袭;迁移
食管癌是常见的恶性肿瘤之一,死亡率位居我国恶性肿瘤死因的第4位[1]。根据病理类型不同,食管癌可分为鳞癌和腺癌两种亚型。在中国,食管癌的主要病理类型为鳞癌[2]。肿瘤复发和转移是导致患者预后较差的重要原因。因此,深入研究食管癌侵袭和转移的分子机制,将有助于改善食管癌的治疗进而提高患者的生存率。
由基因编码的PAI-1蛋白属于丝氨酸蛋白酶抑制剂超家族成员,是组织型纤溶酶原激活物tPA和尿激酶型纤溶酶原激活物uPA的主要抑制因子,具有抑制纤维蛋白溶解的功能[3]。PAI-1可以促进膀胱移行癌细胞增殖[4]、三阴性乳腺癌细胞侵袭迁移[5,6]、以及非小细胞肺癌和胃癌的转移[7,8],进而促进癌症进展。Sakakibara等[9]研究表明在转移性食管鳞癌患者的肿瘤组织中PAI-1表达升高,且PAI-1高表达的患者生存率较低,提示其可能作为判断食管鳞癌预后的标志物。然而,PAI-1在食管癌中的作用及其分子机制尚不清楚。
本研究分析了PAI-1在各食管鳞癌细胞系中的表达以及分泌情况,利用基因敲降技术在PAI-1高表达细胞系中降低PAI-1的表达,然后向培养基中外源加入PAI-1蛋白,通过Transwell实验检测PAI-1对于食管鳞癌细胞的侵袭迁移能力的影响,发现食管鳞癌细胞自分泌的PAI-1可以增强细胞侵袭迁移能力。裸鼠体内移植瘤实验和肺转移实验表明,PAI-1能够促进食管癌的生存和转移。通过对分子机制的研究,发现PAI-1能够激活AKT和ERK信号通路,进一步研究表明LRP1是PAI-1促进食管鳞癌细胞侵袭迁移的关键分子。本研究初步揭示了PAI-1在食管癌中的作用机制,为食管癌提供了潜在的治疗靶点。
1 材料与方法
1.1 细胞培养
食管鳞癌细胞系KYSE30、KYSE70、KYSE140、KYSE150、KYSE450和KYSE510细胞为日本东京大学Shimada教授惠赠,使用含10%胎牛血清的RPMI 1640培养基,于CO2培养箱中37℃培养。人胚肾细胞293FT购自美国Invitrogen公司,使用含10%胎牛血清的DMEM高糖培养基,于CO2培养箱中37℃培养。
1.2 慢病毒包装及靶细胞感染
慢病毒干扰载体pLKO.1 puro (#8453)、慢病毒包装质粒psPAX2 (#12260)、pMD2G (#12259)均购自美国Addgene公司。干扰基因表达的慢病毒包装时,在生长于6 cm皿中密度为80%左右的293FT细胞中,加入含18 μL lipofectamine 2000、6 μg pLKO.1、3 μg psPAX2、3 μg pMD2G的Opti-MEM溶液,6 h后更换为完全培养基培养,48 h后收集上清,用0.45 μm滤膜过滤,分装,保存于−80℃冰箱。感染靶细胞时,将0.5 mL病毒上清加入六孔板中密度为50%左右的靶细胞中,并按照1∶1000 (体积比)加入8 mg/mL polybrene,培养24 h后更换为完全培养基,利用0.9 μg/mL嘌呤霉素进行筛选。
干扰表达的慢病毒shRNA (sh)序列为5ʹ-GCCGGCAGACAGTTTCAGGCTGACTTCTCGAGAAGTCAGCCTGAAACTGTCTGTTTTT-3ʹ,由上海生工生物工程股份有限公司合成。
1.3 siRNA转染
细胞接种至六孔板中,待密度约为30%时进行转染,将5 μL siRNA和Lipofectamine 2000分别溶于250 μL Opti-MEM中,摇匀,室温孵育5 min,二者合并后室温孵育20 min。六孔板中细胞用PBS清洗1次,每孔加入1 mL Opti-MEM培养基,再将上述混合液加入六孔板中,37℃培养6 h后更换为完全培养基,继续培养,48 h后收集细胞进行后续实验。
敲降基因的siRNA序列为5ʹ- CCAGAUUCAUCAUCAAUGATT-3ʹ和5ʹ-GCCACUGGAAAGGCAACAUTT-3ʹ,由苏州吉玛基因股份有限公司合成。
1.4 细胞侵袭和迁移实验
使用直径6.5 mm,孔径8 μm的Transwell检测细胞侵袭和迁移能力。对于迁移实验,转染48 h后,消化收集目的细胞,用不含血清的RPMI 1640培养基悬浮并计数。在Transwell下室加入700 μL含20%血清的RPMI 1640培养基,上室加入100 μL含1.0~1.5×105个细胞的悬液,将Transwell板置于CO2培养箱中培养(KYSE150培养36 h,KYSE450培养48 h),取出小室,用PBS清洗1次,用固定液(甲醇∶丙酮=1∶1)固定1 h,再用0.5%结晶紫染色30 min,用流水冲洗小室,并小心擦拭掉上层细胞,用中性树胶进行封片,于镜下拍照计数。对于侵袭实验,预先在小室中加入50 μL稀释好的Matrigel基质胶,置于CO2培养箱中,37℃孵育2 h,其余操作同迁移实验。
1.5 细胞培养上清浓缩
培养细胞至密度为85%左右时,更换成不含血清的RPMI 1640培养基,继续培养24 h,收集上清至Amicon Ultra-3 K超滤管(购自美国Millipore公司)中,4000 r/min,4℃离心30 min,将浓缩液移至新的1.5 mL离心管中。BCA法测定蛋白浓度。取10 μg蛋白样品进行Western blot实验。
1.6 酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)
使用人PAI-1 ELISA试剂盒(ab184863;英国Abcam公司)检测各食管鳞癌细胞系的PAI-1蛋白分泌水平,培养各食管鳞癌细胞系并收集培养上清,按照试剂盒说明书进行ELISA实验。
1.7 蛋白提取及Western blot实验
培养细胞至对数生长期时收获(对于转染后的细胞,则于转染48 h后收获),用预冷PBS 洗2次,加入适量PBS,用细胞刮刮取细胞于收集管中,1000 r/min离心5 min,弃上清获得细胞沉淀。加入适量蛋白裂解液,冰上裂解30 min,12000 r/min,4℃离心15 min,取上清移至新的离心管中。采用BCA法进行蛋白定量。取30 μg蛋白样品,加入5×上样缓冲液,金属浴中变性10 min,瞬时离心。SDS-聚丙烯酰胺凝胶电泳90 min,使用湿转电转仪将蛋白从分离胶转移至PVDF膜,用5%脱脂牛奶封闭1 h,加入一抗后4℃孵育过夜。使用TBST清洗3次,每次6 min,加入相应二抗,室温孵育1 h,TBST清洗3次,每次6 min,使用Amersham Imager 600成像仪进行曝光。人重组PAI-1蛋白(10296-H08H)购自北京义翘神州科技有限公司,PAI-1抗体(ab182973;1:1000)、LRP1抗体(ab92544;1:5000)、Albumin抗体(ab137885;1:1000)购自英国Abcam公司,p-AKT (#4060;1:1000)、AKT(#4691;1:1000)、p-ERK1/2 (#4370;1:1000)、ERK(#4695;1:1000)抗体购自美国Cell Signaling Technology公司,GAPDH抗体购自美国Proteintech公司。
1.8 免疫共沉淀(Co-immunoprecipitation, Co- IP)实验
将密度约为90%的两个10 cm皿中的细胞用PBS洗2次,加入适量PBS,使用细胞刮刮取细胞于收集管中,1000 r/min离心5 min,弃上清,获得细胞沉淀。加入2 mL非变性蛋白裂解液,冰上裂解30 min,12,000 r/min,4℃离心15 min,取上清液移至新的离心管中。使用结合/洗涤缓冲液对Protein A/G磁珠(购自美国MedChemExpress公司)进行预处理,向30 μL磁珠中加入抗体(终浓度为10 μg/mL),置于翻转摇匀仪,15 r/min,室温孵育1 h。清洗并富集磁珠,向磁珠中加入适量蛋白上清,置于翻转摇匀仪,15 r/min,4℃孵育过夜。用结合/洗涤缓冲液清洗磁珠4次,磁性分离,小心吸弃上清,加入30 μL 5×上样缓冲液,金属浴中变性10 min,进行Western blot检测。PAI-1抗体(ab222754)、LRP1抗体(ab92544)购自英国Abcam公司,Normal Rabbit IgG(#2729)购自美国Cell Signaling Technology公司。
1.9 裸鼠皮下成瘤实验
SPF级4周龄雌性BALB/cA-nu裸鼠(购自北京华阜康生物科技股份有限公司)在实验前一天称重,按照体重分组,使不同体重的裸鼠在各组间平均分布。将生长状态良好的对数生长期的细胞消化,PBS清洗两遍,然后重悬于PBS中,计数,将含1×106个/100 μL的细胞接种于裸鼠上肢腋下部位。待瘤体长出后每周测量2次皮下瘤体积。计算公式为:体积=长径×短径×短径×0.52。3周后处死裸鼠,解剖并测量瘤体重量。
1.10 肺转移实验
SPF级4周龄雄性NOD/SCID小鼠(购自北京华阜康生物科技股份有限公司)于实验前一天称重,按照体重分组,使不同体重的小鼠在各组间平均分布。将生长状态良好的对数生长期的细胞消化,用PBS洗2遍,然后重悬于PBS中计数,将含6×105个/ 100 μL的细胞通过尾静脉注射入小鼠体内。6周后处死小鼠,剥取肺组织拍照,经Bouin氏固定液固定后观察肿瘤细胞肺转移情况,石蜡包埋并切片。
1.11 统计分析
使用SPSS statistics 19软件对实验数据进行统计学分析,检验比较两组间的检测结果。
2 结果与分析
2.1 PAI-1在食管鳞癌细胞中的表达及分泌情况
首先利用Western blot和ELISA检测了6株食管鳞癌细胞系(KYSE30、KYSE70、KYSE140、KYSE150、KYSE450和KYSE510)及其培养上清中PAI-1的表达(图1)。结果表明,KYSE150和KYSE450细胞内和上清中PAI-1蛋白水平均较高,提示这两种细胞中和分泌至细胞外的PAI-1含量均较高。KYSE70细胞内PAI-1的水平较低,不过其上清中的水平较高。其余的3株细胞(KYSE30、KYSE140和KYSE510)的细胞内和上清中PAI-1的水平均较低。
2.2 SERPINE1基因敲降效果
选取PAI-1表达较高的细胞系KYSE150和KYSE450,将2个针对不同CDS区的siRNA分别转染入上述细胞系中,收集细胞及细胞培养上清,通过Western blot验证各靶点的瞬时敲降效果。结果显示,各靶点在两个细胞系中均敲降成功(图2A)。另外,本研究还成功构建了慢病毒介导的稳定敲降细胞株(图2B)。
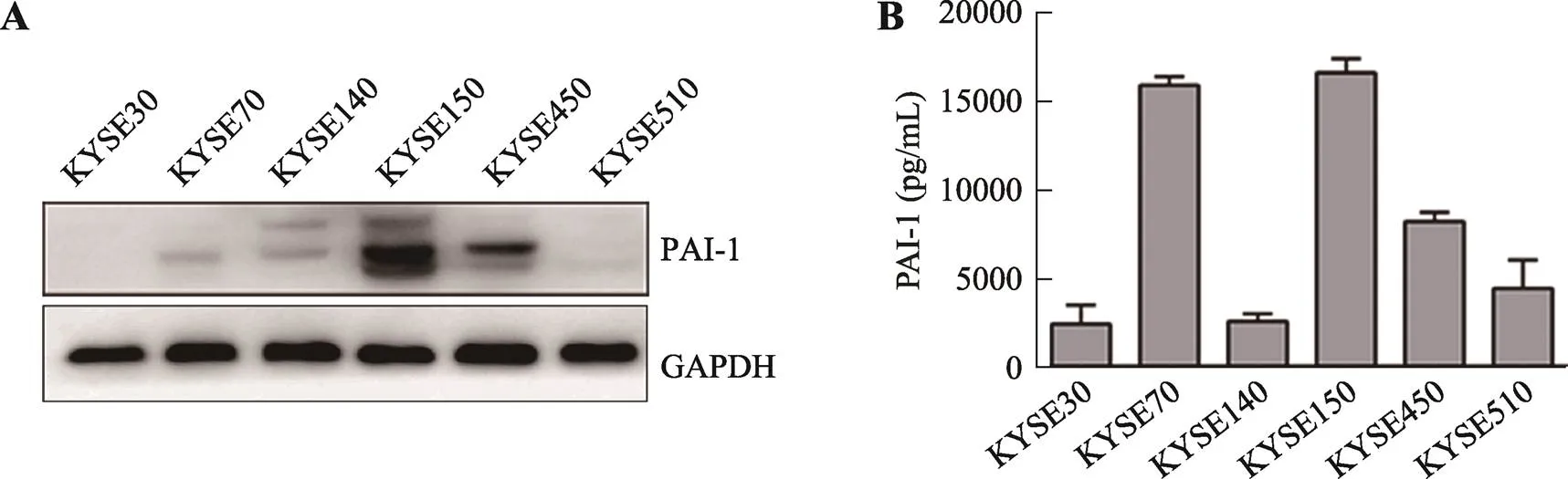
图1 PAI-1在食管鳞癌细胞中的表达及分泌情况
A:Western blot检测食管鳞癌细胞系中PAI-1蛋白的水平(GAPDH为内参);B:ELISA检测食管鳞癌细胞系细胞培养上清中PAI-1蛋白的水平。

图2 SERPINE1敲降效果及构建SERPINE1稳定敲降细胞株的验证
A:SERPINE1 siRNA在食管癌细胞中的瞬时敲降效果验证。干扰表达的siRNA转染至KYSE150和KYSE450细胞后,Western blot检测PAI-1蛋白的表达(左)和分泌水平(右)。B:SERPINE1 shRNA在食管癌细胞中的稳定敲降效果验证。构建慢病毒介导的稳定敲降KYSE150和KYSE450细胞,Western blot检测PAI-1蛋白的表达(左)和分泌水平(右)。Albumin为细胞培养上清内参。
2.3 PAI-1过表达能够显著增强食管鳞癌细胞的侵袭和迁移能力
利用Transwell实验检测PAI-1对于细胞体外侵袭和迁移能力的影响,结果显示PAI-1低表达组的细胞穿过聚碳酯膜数目远远少于对照组(< 0.001) (图3,A和B)。同时,向稳定敲降的KYSE150和KYSE450细胞的培养基中分别加入100 ng/mL人重组PAI-1蛋白,预处理2 h后进行Transwell实验,发现经PAI-1预处理后的细胞穿过聚碳酯膜数目比对照组明显增加(< 0.001) (图3,C和D)。上述结果表明,PAI-1过表达或向培养基中加入PAI-1可以促进食管鳞癌细胞的侵袭和迁移。
2.4 PAI-1激活AKT和ERK信号通路
在稳定敲降细胞株KYSE150和KYSE450的培养基中外源加入100 ng/mL人PAI-1蛋白,分别处理15、30和45 min后收集细胞。Western blot结果显示,外源加入PAI-1升高了细胞内PAI-1的蛋白含量,并提高AKT和ERK1/2的磷酸化水平(图4),表明PAI-1可能通过激活AKT和ERK信号通路,促进食管鳞癌细胞的侵袭和迁移。
2.5 LRP1是PAI-1促进食管鳞癌细胞侵袭迁移能力的关键分子
PAI-1可以通过与LRP1受体结合而调控肿瘤细胞以及肿瘤相关巨噬细胞的运动能力[10,11]。在食管鳞癌细胞中,LRP1是否作为PAI-1调控细胞侵袭迁移的潜在受体?本研究利用Co-IP实验进一步表明,PAI-1与LRP1在KYSE150和KYSE450细胞中可能均存在相互作用(图5),提示LRP1可能是PAI-1激活细胞内信号通路的作用靶点。

图3 PAI-1过表达促进食管鳞癌细胞的侵袭和迁移
A:KYSE150和KYSE450中敲降组与对照组中穿过聚碳酯膜的细胞数目对比;B:聚碳酯膜下表面的3个不同视野的统计分析结果;C:稳定敲降的KYSE150和KYSE450细胞中加入100 ng/mL人重组PAI-1蛋白与对照组中穿过聚碳酯膜的细胞数目对比;D:聚碳酯膜下表面的3个不同视野的统计分析结果。***< 0.001,表明差异极显著。

图4 PAI-1激活AKT和ERK信号通路
在稳定敲降细胞株KYSE150和KYSE450中外源加入100 ng/mL人PAI-1蛋白,Western blot检测加入不同时间后AKT和ERK1/2磷酸化水平的改变。

图5 PAI-1与LRP1在体内存在相互作用
利用PAI-1抗体、LRP1抗体、IgG抗体分别免疫沉淀KYSE150和KYSE450细胞裂解液,Western blot检测各组LRP1和PAI-1的蛋白水平,细胞总裂解液作为对照Input组。
2.6 敲降SERPINE1降低食管鳞癌细胞的体内成瘤和转移能力
将稳定敲降的KYSE150细胞及对照组细胞分别接种于裸鼠腋下,测定皮下瘤的生长情况,饲养3周后处死裸鼠,解剖并测量瘤体重量。结果显示,与对照组相比,敲降后细胞成瘤能力明显降低(图6,A和B)。将敲降组及对照组细胞通过尾静脉分别注射入小鼠体内,饲养6周后处死小鼠,观察细胞的肺转移情况。结果显示,与对照组相比,敲降后细胞的肺转移能力明显降低(图6C)。以上结果表明,PAI-1能够促进食管鳞癌细胞的生长存活和侵袭转移。
3 讨论
肿瘤侵袭转移严重影响肿瘤患者的生存率。近年来研究发现很多分子在食管癌中高表达且能够促进食管癌细胞的侵袭迁移,例如IGHMBP2、ANXA2和KRT17等[12~14]。深入解析食管癌细胞侵袭迁移的分子机制,对于探索如何预防或阻止食管癌进展及延长食管癌患者的生存具有重要意义。
PAI-1属于丝氨酸蛋白酶抑制剂超家族,参与调控肥胖、血管类疾病、代谢类疾病以及多种类型的肿瘤进展[15]。研究发现,PAI-1与癌症患者不良预后[16~18]和肿瘤化疗及靶向治疗的抗性相关[19~21],其在肿瘤中的生物学作用包括诱导血管生成、促进细胞侵袭和迁移、维持增殖信号和抗凋亡等[4,22~24]。尽管人们对于PAI-1在癌症中的作用已经有了一定的认识,但是其在食管癌中发挥的作用及分子机制尚不清楚。

图6 敲降SERPINE1降低食管鳞癌细胞的体内成瘤和肺转移能力
A:稳定敲降细胞株KYSE150及对照组在裸鼠体内成瘤情况。上图:各组皮下移植瘤的照片;下图:统计分析表明,敲降组裸鼠肿瘤重量显著轻于对照组,***< 0.001,表明差异极显著。B:各组皮下移植瘤的生长曲线。***< 0.001,表明差异极显著。C:稳定敲降细胞株KYSE150及对照组在裸鼠体内肺转移情况。上图:经固定液固定后的肺组织代表性照片和H&E染色结果,箭头指示为肿瘤转移灶;下图:统计分析表明,敲降组细胞发生转移的数目低于对照组,*< 0.05,具有统计学意义。
PAI-1是一种分泌蛋白。除肿瘤细胞自分泌外,肿瘤微环境中的成纤维细胞等也可能分泌PAI-1,通过旁分泌途径影响肿瘤细胞[19]。本研究发现,PAI-1蛋白在不同食管鳞癌细胞系中的表达存在差异,且可分泌至胞外。本研究利用敲降细胞内源性表达水平、以及向培养基中外源性加入该蛋白进行表型研究,发现PAI-1过表达或通过旁分泌途径,均能够增强食管鳞癌细胞的侵袭运动能力。
已有研究发现,PAI-1在头颈鳞癌、乳腺癌等细胞中可以通过激活AKT、ERK等信号通路而促进细胞运动[25,26]。为了进一步探究PAI-1过表达促进食管鳞癌细胞侵袭运动的作用机制,本研究发现向培养基中外源性加入PAI-1蛋白后可以激活AKT和ERK信号通路。根据文献报道,LRP1是PAI-1在肿瘤中发挥作用的潜在受体分子。LRP1是一种广泛表达于细胞表面的受体蛋白,其既可以作为清道夫受体调节脂蛋白代谢,也能作为信号通路受体调节细胞存活和运动[27]。LRP1表达异常可诱发阿尔茨海默病[28~30],近年来的研究发现LRP1与癌症进展密切相关。Gheysarzadeh等[31]研究表明LRP1过表达与胰腺导管腺癌不良预后和侵袭相关。Feng等[32]发现LRP1过表达与透明肾细胞癌不良预后相关。另有研究表明,一些分泌蛋白可通过LRP1激活AKT和ERK,进而促进肿瘤的生长和侵袭转移[33,34]。本研究利用Co-IP实验表明食管鳞癌细胞的PAI-1与LRP1存在相互作用。后续的研究将进一步关注PAI-1与LRP1是否存在直接的相互作用且如何相互作用,以及该相互作用是否及如何通过激活AKT和ERK通路进而促进食管鳞癌细胞的侵袭运动。
[1] Chen WQ, Zheng RS, Baade PD, Zhang SW, Zeng HM, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015., 2016, 66(2): 115–132.
[2] Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012, 2015, 65(2): 87–108.
[3] McMahon B, Kwaan HC. The plasminogen activator system and cancer., 2008, 36(3–4): 184–194.
[4] Giacoia EG, Miyake M, Lawton A, Goodison S, Rosser CJ. PAI-1 leads to G1-phase cell-cycle progression through cyclin D3/cdk4/6 upregulation., 2014, 12(3): 322–334.
[5] Xu J, Zhang WW, Tang L, Chen WW, Guan XX. Epithelial-mesenchymal transition induced PAI-1 is associated with prognosis of triple-negative breast cancer patients., 2018, 670: 7–14.
[6] Zhang WW, Xu J, Fang HH, Tang L, Chen WW, Sun Q, Zhang Q, Yang F, Sun ZJ, Cao LL, Wang YC, Guan XX. Endothelial cells promote triple-negative breast cancer cell metastasis via PAI-1 and CCL5 signaling., 2018, 32(1): 276–288.
[7] Lin X, Lin BW, Chen XL, Zhang BL, Xiao XJ, Shi JS, Lin JD, Chen X. PAI-1/PIAS3/Stat3/miR-34a forms a positive feedback loop to promote EMT-mediated metastasis through Stat3 signaling in Non-small cell lung cancer., 2017, 493(4): 1464–1470.
[8] Nishioka N, Matsuoka T, Yashiro M, Hirakawa K, Olden K, Roberts JD. Plasminogen activator inhibitor 1 RNAi suppresses gastric cancer metastasis., 2012, 103(2): 228–232.
[9] Sakakibara T, Hibi K, Kodera Y, Ito K, Akiyama S, Nakao A. Plasminogen activator inhibitor-1 as a potential marker for the malignancy of esophageal squamous cell carcinoma., 2004, 10(4): 1375–1378.
[10] Placencio VR, DeClerck YA. Plasminogen Activator Inhibitor-1 in Cancer: Rationale and Insight for Future Therapeutic Testing., 2015, 75(15): 2969– 2974.
[11] Kubala MH, Punj V, Placencio-Hickok VR, Fang H, Fernandez GE, Sposto R, DeClerck YA. Plasminogen activator inhibitor-1 promotes the recruitment and polarization of macrophages in cancer, 2018, 25(8): 2177–2191.e7.
[12] Wang CL, Hao JJ, Wu LF, Pan BQ, Xu X, Cai Y, Wang MR, Jia XM. IGHMBP2 overexpression promotes cell migration and invasion in esophageal squamous carcinoma., 2015, 37(4): 360–366.王春丽, 郝佳洁, 吴李飞, 潘蓓青, 徐昕, 蔡岩, 王明荣, 贾雪梅. IGHMBP2过表达促进食管鳞癌细胞的侵袭和迁移. 遗传, 2015, 37(4): 360–366.
[13] Liu Z, Yu SB, Ye ST, Shen ZM, Gao L, Han ZY, Zhang PP, Luo F, Chen S, Kang MQ. Keratin 17 activates AKT signalling and induces epithelial-mesenchymal transition in oesophageal squamous cell carcinoma., 2020, 211: 103557.
[14] Ma S, Lu CC, Yang LY, Wang JJ, Wang BS, Cai HQ, Hao JJ, Xu X, Cai Y, Zhang Y, Wang MR. ANXA2 promotes esophageal cancer progression by activating MYC- HIF1A-VEGF axis., 2018, 37(1): 183.
[15] Dellas C, Loskutoff DJ. Historical analysis of PAI-1 from its discovery to its potential role in cell motility and disease., 2005, 93(4): 631–640.
[16] Peng Y, Kajiyama H, Yuan H, Nakamura K, Yoshihara M, Yokoi A, Fujikake K, Yasui H, Yoshikawa N, Suzuki S, Senga T, Shibata K, Kikkawa F. PAI-1 secreted from metastatic ovarian cancer cells triggers the tumor- promoting role of the mesothelium in a feedback loop to accelerate peritoneal dissemination., 2019, 442: 181–192.
[17] Ferroni P, Roselli M, Portarena I, Formica V, Riondino S, LA Farina F, Costarelli L, Melino A, Massimiani G, Cavaliere F, Palmirotta R, Guadagni F. Plasma plasminogen activator inhibitor-1 (PAI-1) levels in breast cancer - relationship with clinical outcome., 2014, 34(3): 1153–1161.
[18] Palmirotta R, Ferroni P, Savonarola A, Martini F, Ciatti F, Laudisi A, Sini V, Del Monte G, Guadagni F, Roselli M. Prognostic value of pre-surgical plasma PAI-1 (plasminogen activator inhibitor-1) levels in breast cancer., 2009, 124(4): 403–408.
[19] Che Y, Wang JN, Li Y, Lu ZL, Huang JB, Sun SG, Mao SS, Lei YY, Zang RC, Sun N, He J. Cisplatin-activated PAI-1 secretion in the cancer-associated fibroblasts with paracrine effects promoting esophageal squamous cell carcinoma progression and causing chemoresistance, 2018, 9(7): 759.
[20] Masuda T, Nakashima T, Namba M, Yamaguchi K, Sakamoto S, Horimasu Y, Miyamoto S, Iwamoto H, Fujitaka K, Miyata Y, Hamada H, Okada M, Hattori N. Inhibition of PAI-1 limits chemotherapy resistance in lung cancer through suppressing myofibroblast characteristics of cancer-associated fibroblasts., 2019, 23(4): 2984–2994.
[21] Fang HH, Jin J, Huang DD, Yang F, Guan XX. PAI-1 induces Src inhibitor resistance via CCL5 in HER2-positive breast cancer cells., 2018, 109(6): 1949–1957.
[22] Inoue M, Sawada T, Uchima Y, Kimura K, Nishihara T, Tanaka H, Yashiro M, Yamada N, Ohira M, Hirakawa K. Plasminogen activator inhibitor-1 (PAI-1) gene transfection inhibits the liver metastasis of pancreatic cancer by preventing angiogenesis., 2005, 14(6): 1445– 1451.
[23] Geis T, Döring C, Popp R, Grossmann N, Fleming I, Hansmann ML, Dehne N, Brüne B. HIF-2alpha-dependent PAI-1 induction contributes to angiogenesis in hepatocellular carcinoma, 2015, 331(1): 46–57.
[24] Mashiko S, Kitatani K, Toyoshima M, Ichimura A, Dan T, Usui T, Ishibashi M, Shigeta S, Nagase S, Miyata T, Yaegashi N. Inhibition of plasminogen activator inhibitor-1 is a potential therapeutic strategy in ovarian cancer., 2015, 16(2): 253–260.
[25] Pavón MA, Arroyo-Solera I, Téllez-Gabriel M, León X, Virós D, López M, Gallardo A, Céspedes MV, Casanova I, López-Pousa A, Mangues MA, Quer M, Barnadas A, Mangues R. Enhanced cell migration and apoptosis resistance may underlie the association between high SERPINE1 expression and poor outcome in head and neck carcinoma patients., 2015, 6(30): 29016–29033.
[26] Humphries BA, Buschhaus JM, Chen YC, Haley HR, Qyli T, Chiang B, Shen N, Rajendran S, Cutter A, Cheng YH, Chen YT, Cong J, Spinosa PC, Yoon E, Luker KE, Luker GD. Plasminogen Activator Inhibitor 1 (PAI1) promotes actin cytoskeleton reorganization and glycolytic metabolism in triple-negative breast cancer., 2019. 17(5): 1142–1154.
[27] Herz J, Strickland DK. LRP: a multifunctional scavenger and signaling receptor., 2001, 108(6): 779– 784.
[28] Cai Z, Qiao PF, Wan CQ, Cai M, Zhou NK, Li Q. Role of blood-brain barrier in Alzheimer's disease, 2018, 63(4): 1223–1234.
[29] Shinohara M, Tachibana M, Kanekiyo T, Bu G. Role of LRP1 in the pathogenesis of Alzheimer's disease: evidence from clinical and preclinical studies., 2017, 58(7): 1267–1281.
[30] Holtzman DM, Herz J, Bu GJ. Apolipoprotein E and apolipoprotein E receptors: normal biology and roles in Alzheimer disease., 2012, 2(3): a006312.
[31] Gheysarzadeh A, Ansari A, Emami MH, Razavi AE, Mofid MR. Over-expression of low-density lipoprotein receptor- related Protein-1 is associated with poor prognosis and invasion in pancreatic ductal adenocarcinoma., 2019, 19(3): 429–435.
[32] Feng CC, Ding GX, Ding Q, Wen H. Overexpression of low density lipoprotein receptor-related protein 1 (LRP1) is associated with worsened prognosis and decreased cancer immunity in clear-cell renal cell carcinoma., 2018, 503(3): 1537–1543.
[33] Tian Y, Wang C, Chen S, Liu J, Fu Y, Luo Y. Extracellular Hsp90α and clusterin synergistically promote breast cancer epithelial-to-mesenchymal transition and metastasis via LRP1., 2019, 132(15).
[34] Salama Y, Lin SY, Dhahri D, Hattori K, Heissig B. The fibrinolytic factor tPA drives LRP1-mediated melanoma growth and metastasis., 2019, 33(3): 3465–3480.
PAI-1 overexpression promotes invasion and migration of esophageal squamous carcinoma cells
Di Wang, Liyan Yang, Zou Liu, Jing Yu, Minjie Zhang, Yu Zhang, Yan Cai, Xin Xu, Jiajie Hao, Mingrong Wang
Esophageal squamous cell carcinoma (ESCC) is one of the most common cancers worldwide. Plasminogen activator inhibitor-1 (PAI-1), encoded by, is highly expressed in various types of tumor tissues, which contributes to cancer progression. The present study explored the role and underlying mechanisms of PAI-1 in ESCC. We found that the PAI-1 protein was extracellularly secreted more from ESCC cells with high PAI-1 expression using Western blotting and enzyme linked immunosorbent assay (ELISA). Knockdown ofexpression significantly inhibited the invasion and migration of ESCC KYSE150 and KYSE450 cell lines, which could be restored when adding exogenous human recombinant PAI-1 into the culture medium of the cells stably expressingshRNA.experiments showed thatknockdown significantly inhibited xenograft growth and lung metastasis of ESCC cells. Molecular analysis demonstrated that PAI-1 activated AKT and ERK signaling pathways. Co-immunoprecipitation (Co-IP) assays identified that PAI-1 may interact with the membrane receptor LDL receptor related protein 1 (LRP1). These results indicated that overexpression of PAI-1, through interacting with LRP1, might enhance invasion and migration of ESCC cells as well as promote ESCC progression.
PAI-1; ESCC; invasion; migration
2019-12-31;
2020-02-12
国家自然科学基金项目(编号:81520108023),中国医学科学院医学与健康科技创新工程项目(编号:2019-I2M-1-003,2016-I2M-3-007),北京市科技新星项目(编号:Z171100001117017)资助[Supported by the National Natural Science Foundation of China (No. 81520108023), CAMS Innovation Fund for Medical Sciences (Nos. 2019-I2M-1-003, 2016-I2M-3-007), Beijing Nova Program (No. Z171100001117017)]
王迪,硕士研究生,专业方向:肿瘤遗传学。E-mail: 15604011202@163.com
郝佳洁,博士,副研究员,研究方向:肿瘤遗传学。E-mail: hjj8173@126.com
王明荣,博士,研究员,研究方向:肿瘤遗传学。E-mail: wangmr2015@126.com
10.16288/j.yczz.19-334
2020/2/28 11:15:42
URI: http://kns.cnki.net/kcms/detail/11.1913.r.20200227.0958.002.html
(责任编委: 周钢桥)